遗传性甲状腺髓样癌16例临床病理特征及预后分析
付 欣,刘坦坦,杨 巧,刘家艳,张微晨,王 佩,王 哲,张丽英
甲状腺髓样癌(medullary thyroid carcinoma, MTC)是起源于甲状腺滤泡旁细胞的恶性神经内分泌肿瘤,占甲状腺癌的1%~2%,分为散发性和遗传性。散发性约占75%,常为孤立性结节,多见于中老年人。遗传性甲状腺髓样癌(hereditary medullary thyroid carcinoma, HMTC)相对少见,约占25%,是一种常染色体显性遗传性疾病,常为双侧或多发包块,发病年龄较散发性早10~20年[1]。HMTC可进一步分为多发性内分泌肿瘤(multiple endocrine neoplasia, MEN)2A型、2B型和家族性甲状腺髓样癌(familial medullary thyroid carcinoma, FMTC)。约50%的MEN 2A和MEN 2B可伴发肾上腺嗜铬细胞瘤(pheochromocytoma, PHEO),PHEO可分泌大量儿茶酚胺从而危及生命,美国甲状腺协会(The American Thyroid Association, ATA)最新修订的MTC治疗指南建议在行甲状腺全切术前评估是否伴有PHEO,如有则需在MTC手术前切除[2]。因此,正确诊断和评估HMTC显得尤为重要,国内相关报道较少。本文收集16例HMTC,结合文献探讨该病的临床病理特征及预后,以提高对该病的认识。
1 材料与方法
1.1 材料收集空军军医大学西京医院病理科2007~2021年诊断的MTC病例,查阅并记录患者相关临床及病理信息,从中筛选双侧或多发病例29例。依据HMTC诊断标准:MEN2A需满足单个个体或近亲中发生两种或两种以上MEN2A相关肿瘤,除MTC外,最常见的是PHEO或甲状旁腺功能亢进(hyperparathyroidism, HPTH);仅表现MTC的4例或4例以上家庭诊断为FMTC;MEN2B需同时存在MTC、PHEO或黏膜多发神经瘤等;若临床特征不明显,可通过检测RET基因胚系突变确诊。最终确诊HMTC共16例,收集患者临床资料包括年龄、性别、临床表现、血清及影像学、病史及家族史、发病部位、大小及数量等。所有病例经两位高年资病理医师参照WHO(2017)神经内分泌肿瘤分类标准和第2版甲状腺细胞学Bethesda报告系统重新阅片。
1.2 方法手术标本经10%中性福尔马林固定,常规石蜡包埋制片,行HE、免疫组化及刚果红染色。FNA标本为2张涂片及1份液基标本,涂片经95%乙醇与冰醋酸混合液固定后HE染色,液基标本采用广州安必平医药公司固定、制片及染色。液基剩余标本离心包埋后行免疫组化染色。免疫组化染色采用EnVision两步法,操作步骤均按照试剂说明书进行。所用抗体包括CK(AE1/AE3)、TTF-1、Calcitonin、CEA、Syn、CgA、CD56、TG、PTH均购自福州迈新公司,刚果红染液为实验室自配。RET基因检测由患者在外单位完成。
2 结果
2.1 临床特征16例HMTC中男性5例,女性11例,年龄10~72岁,中位年龄37岁。均为双侧甲状腺结节;8例为多灶性;14例有明确家族史;3例伴甲状旁腺腺瘤,8例伴同时性或异时性PHEO。B超显示:结节多为低回声,边界清楚,部分伴钙化(图1)。血清学检查:术前6例降钙素(Ctn)升高,5例CEA升高,4例PTH升高,3例尿香草苦杏仁酸(vanillylmandelic acid, VMA)升高(表1)。
2.2 病理检查
2.2.1眼观 16例中15例为手术切除标本,1例为术前FNA标本。手术切除标本肿瘤呈结节状,单个结节直径0.6~3.5 cm,切面实性,灰白或灰红色,质硬,3例伴钙化。
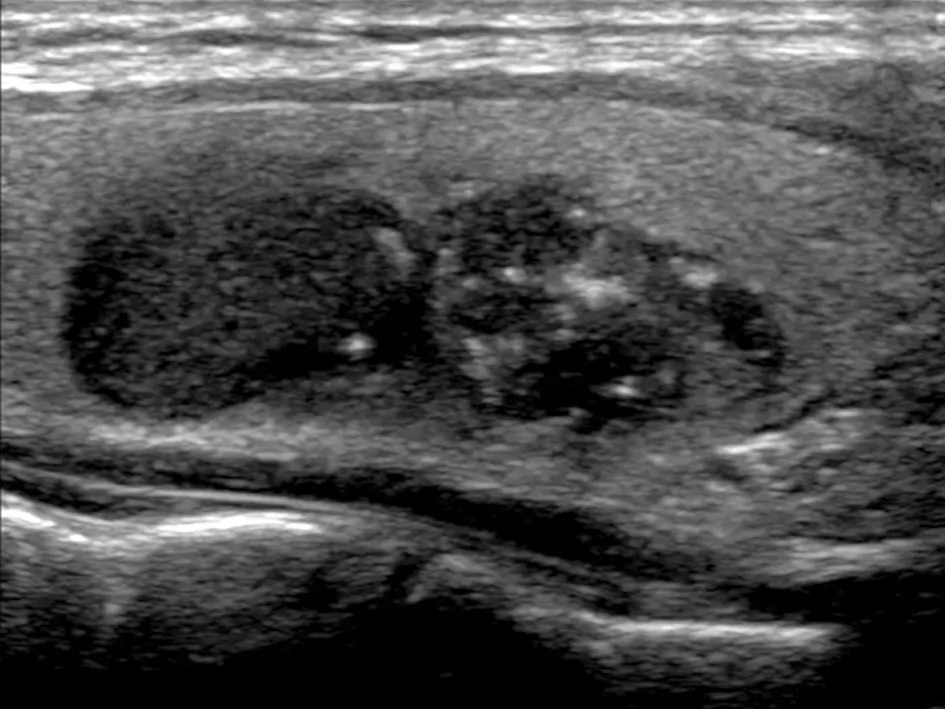
图1 B超示:甲状腺内可见多个低回声区,边界尚清,形态不规则,纵横比<1,内见钙化
2.2.2镜检 手术切除标本:肿瘤细胞呈巢团状、小梁状或岛状生长(图2)。细胞大小不一,呈圆形、多角形或梭形,核圆形或椭圆形,染色质呈细或粗颗粒状,核分裂象少见(图3、4)。13例间质中可见淀粉样蛋白沉积,5例伴钙化。6例肿瘤周围可见肿瘤性C细胞增生(图5)。AJCC分期:6例T1期,4例T2期,5例T3期;7例N0,3例N1a,5例N1b。
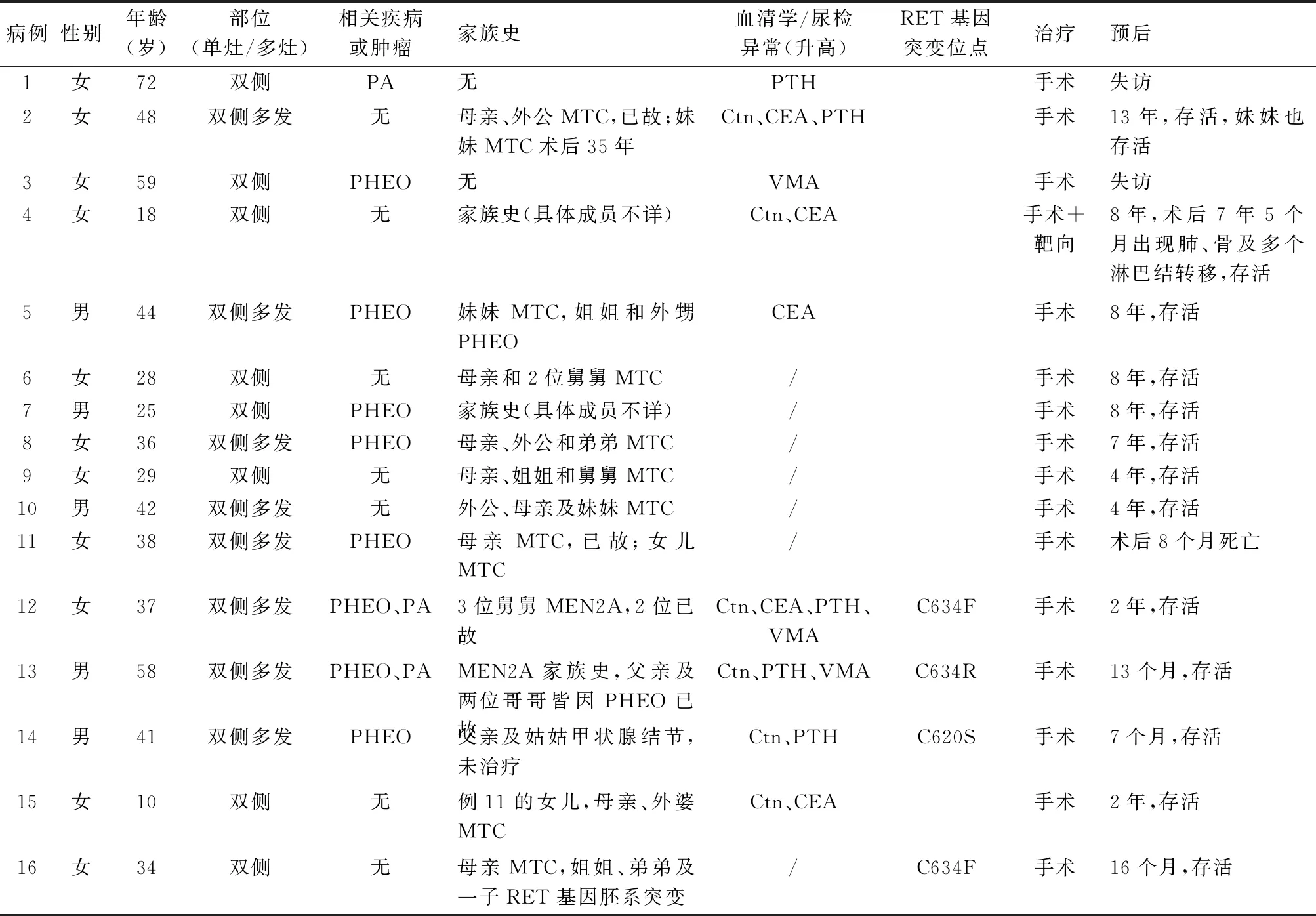
表1 16例遗传性甲状腺髓样癌的临床病理资料
FNA标本:细胞量丰富,肿瘤细胞单个散在或聚集成簇,胞质部分丰富,部分稀少,核染色质呈颗粒状、部分偏位(图6),局部可见砂砾体及淀粉样蛋白沉积。
2.2.3免疫表型及特殊染色 16例CK(AE1/AE3)、Calcitonin(图7)、TTF-1均阳性,14例CD56、Syn、CgA阳性;6例行CEA染色均阳性;PAX-8表达不一,6例行PAX-8染色1例弥漫阳性,2例局灶阳性,3例阴性;Ki-67增殖指数均低于5%;淀粉样蛋白刚果红染色阳性(图8)。所有病例TG、PTH均阴性。
2.2.4RET基因检测 本组16例中4例行RET基因胚系突变检测,其中例12、16为11号外显子C634F位点突变(图9),例13为11号外显子C634R位点突变,例14为10号外显子C620S位点突变。
2.3 随访本组14例患者获得随访,2例失访。随访时间7个月~13年,其中例11患者随访8年,术后8个月死亡,其女儿MTC术后随访2年无复发;例4患者术后7年5个月出现颈部淋巴结并肺、骨转移,目前仍健在;例2的妹妹MTC术后35年仍健在,随访时间最长。其余11例均健在。
3 讨论
3.1 临床特征MEN是一组累及多个内分泌器官且伴有常染色体显性遗传的肿瘤综合征。其特征是同一患者同时或先后出现两个或两个以上内分泌腺肿瘤。按照其基因突变和临床特征不同可分为MEN 1型、MEN 2型、MEN 4型和最近确定的MEN 5型[3-6]。
HMTC是MEN 2型最主要的临床表现,可进一步分为:MEN 2A、2B和FMTC。MEN 2A,又称为Sipple综合征,最常见,约占80%,多见于30~40岁青年人[7-8],除MTC外,50%MEN 2A可伴发PHEO,20%~30%可伴发HPTH,10%可伴发苔藓样皮肤淀粉样变性,7%可伴发先天性巨结肠[3,8]。FMTC是MEN 2A的一种变异亚型,患者存在RET基因胚系突变,但仅表现MTC,无MEN 2A的其他临床表现[8],发病年龄晚,平均50~60岁。MEN 2B,也称MEN 3型,最少见,占5%~10%,常见于婴幼儿,侵袭性强,可发生早期淋巴结或远处转移,一般不伴发HPTH,约50%可伴发PHEO,此外,还可出现胃肠神经节细胞瘤、多发性黏膜神经瘤、嘴唇突出、马凡样体型及骨骼畸形等[5,9-11]。
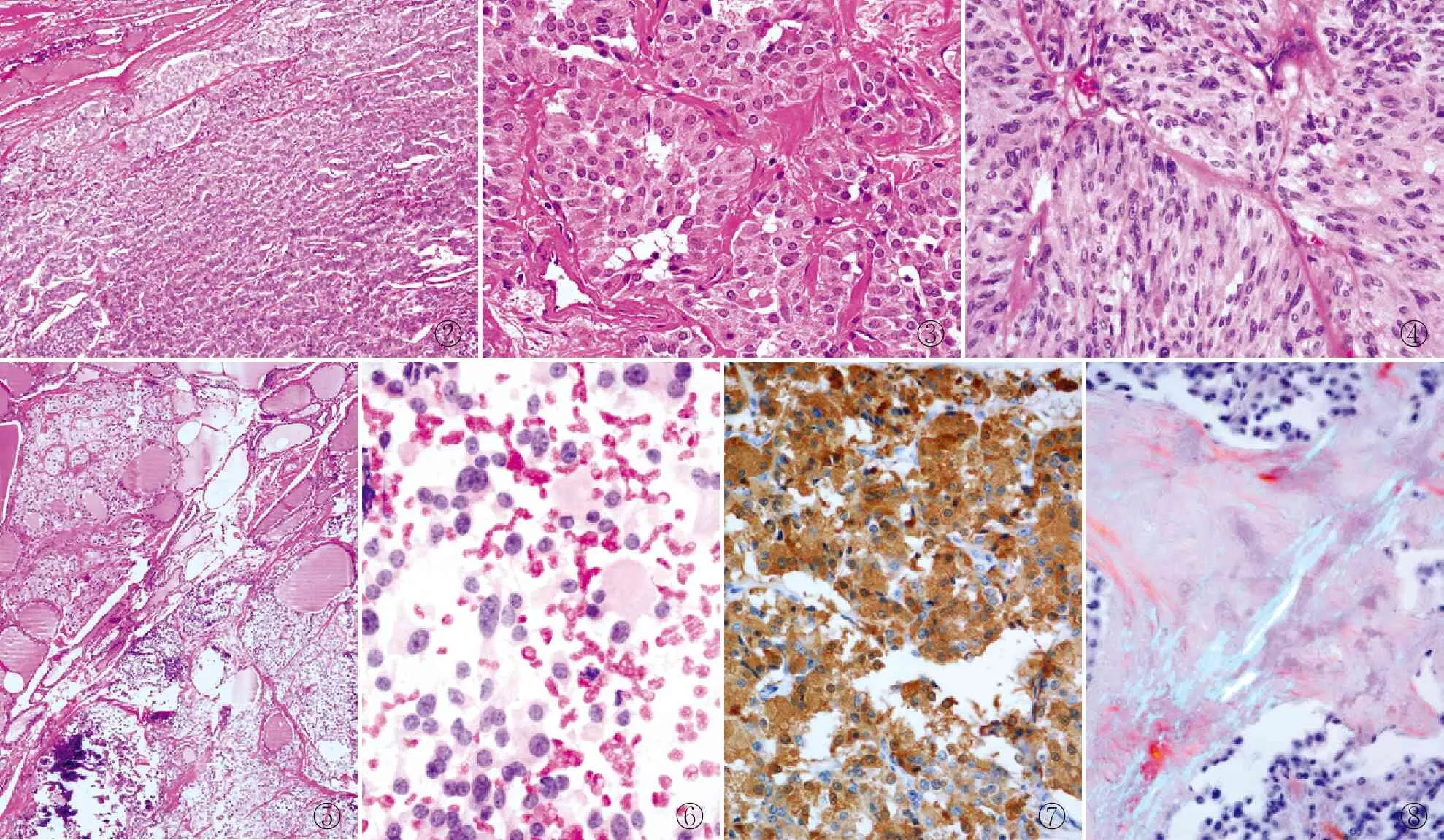
②③④⑤⑥⑦⑧
本组患者年龄10~72岁,中位年龄37岁,与HMTC相关疾病仅见PHEO和甲状旁腺腺瘤,也可能是对该病认识不够深刻而忽略所致。本组例1、12、13和14为MEN 2A型,其余病例根据目前临床表现或基因检测尚无法确定类型。
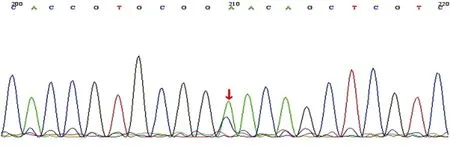
图9 例16 RET基因11号外显子p.C634F杂合变异(c.1901G>T)
3.2 分子改变HMTC由位于10q11.2 RET基因胚系突变引起[3,7-8,11-13]。RET基因由21个外显子组成,负责编码一种受体酪氨酸激酶,包括胞外结构域、胞内结构域和跨膜结构域。MEN 2A型RET基因突变位点主要发生于胞外结构域(如第10号外显子中密码子609、611、618和620,第11号外显子中密码子630和634),其中约85%为第11号外显子密码子634位点突变[14]。MEN 2B目前仅发现两个突变位点,其中约95%为16号外显子M918T位点,5%为15号外显子A883F位点[4,14]。FMTC RET基因突变位点与MEN 2A类似。RET基因突变位点与疾病的临床表型和MTC侵袭性有较强的相关性[15]。2015年ATA协会根据RET突变位点将HMTC风险分为三级,最高风险:包括MEN 2B和RET密码子M918T突变的患者;高风险:包括RET密码子C634和A883F突变的患者;中等风险:指M918T、C634和A883F以外突变的患者。本组4例行RET基因检测中2例C634F位点突变,1例C634R位点突变,1例C620S位点突变。
3.3 诊断HMTC的诊断需结合临床表现、血清学、影像学及病理检查几个方面。与散发性MTC相比,HMTC临床上常表现为双侧和(或)多发包块,体积常较小(≤1 cm)。HMTC血清学和影像学与散发性MTC相同,即血清Ctn和CEA常升高,B超常为低回声,边界相对清楚,形态不规则,纵横比多<1,易出现外侧组淋巴结转移及粗大钙化[16]。此外,因HMTC可伴发PHEO和HPTH,故VMA和血清PTH水平亦可升高。本组中术前B超和血清学检查均与文献报道一致。
HMTC镜下形态与散发性MTC相同,包括组织学和细胞学两方面。MTC组织学表现多样,可模拟任何一种甲状腺内恶性肿瘤形态。典型MTC呈实性巢状、小叶状、小梁状或岛状生长。细胞大小不一,呈圆形、多角形、浆细胞样或梭形,常混合存在。核圆形,染色质呈细或粗颗粒状,核仁不明显,核分裂象少见,偶见核内假包涵体。90%病例间质中可见淀粉样蛋白沉积。文献报道肿瘤性C细胞增生常提示HMTC,其特点是C细胞呈结节状聚集,围绕在甲状腺滤泡周围,并被基底膜所包绕,但也偶见于散发性MTC和其他原因切除的甲状腺中[17-18]。本组仅6例可见C细胞增生。FNA标本中MTC特点:细胞量中等至丰富,呈浆细胞样、多角形、圆形或梭形,核圆形、椭圆形或被拉长,染色质颗粒状,常见双核细胞。少数病例可见核内假包涵体。MTC表达神经内分泌标志物Syn、CgA、CD56及Calcitonin、CEA,TTF-1、PAX-8表达不一,滤泡上皮标记TG阴性。淀粉样蛋白刚果红染色阳性。
在日常工作中,结合病理形态及免疫表型诊断MTC较为容易,而如何筛选出HMTC是病理医师当前所面临的挑战。ATA指南建议当FNA怀疑MTC时,应做进一步检查以明确是否为HMTC,应对HMTC患者的一级亲属进行遗传学筛查,以全面评估基因携带者的风险分层,并根据分层结果进行早期干预。本组中例16经FNA诊断HMTC后,遗传学筛查发现直系亲属中4人存在RET基因胚系突变,且姐姐有甲状腺结节;另例11诊断MTC后,遗传学筛查发现女儿MTC,随后行手术。我们建议为这两个家庭的其他成员提供早期手术机会。
3.4 治疗及预后HMTC目前首选的治疗方法是手术治疗。需注意的是,所有HMTC患者术前应常规筛查PHEO和HPTH,PHEO手术应在甲状腺手术前进行[14,19-20]。HMTC患者一般术后无需I131治疗。晚期或局部转移患者可考虑使用酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)进行靶向治疗,已获FDA批准的有凡德他尼、卡博替尼,LOXO-292、BLU-667正在临床实验阶段[20]。文献报道PD-1、PD-L1和TIM-3、CTLA-4等免疫治疗也可用于晚期MTC[21-22]。本组仅例4患者手术后接受了靶向治疗,其余均仅手术治疗。
与散发性MTC相比,HMTC发展相对缓慢。其预后与初次诊断时肿瘤分期、手术切除效果及术后Ctn和CEA倍增时间等有关。文献报道年龄>55岁、手术时远处转移、侧颈淋巴结受累、T3期以上、甲状腺外浸润、术后Ctn和CEA倍增时间≤1年均是预后差的因素[23-24]。文献报道,RET基因M918T位点突变提示肿瘤更具侵袭性,但HMTC在高风险和中风险组之间的生化治愈率和总生存率无明显差异[25-28]。本组14例患者获得随访,其中2例年龄>55岁,目前无瘤生存。3例pT3N1b患者中1例术后7年出现颈部淋巴结及肺、骨转移,但随访时均健在。本组例12、13、16为RET基因C634位点突变,属于高风险,例14为C620S位点突变,属于中等风险,目前患者均存活。本组随访数据也提示HMTC患者预后较好。
综上,HMTC临床少见,容易被忽视,尤其是目前FNA作为甲状腺结节术前诊断的重要手段,如何识别出HMTC成为病理医师的一大挑战。深入了解和学习HMTC的临床特点、发病机制、病理诊断、治疗、预后及筛查策略,将有利于提高其诊断准确性。

