线粒体途径参与LASS2/TMSG1基因诱导人肺癌95C细胞凋亡的机制
李艳伟,刘水仙,刘峥璐,徐晓艳
肺癌是全球最常见的恶性肿瘤,根据2022年美国癌症协会数据统计显示肺癌男女性的病死率皆位居首位[1]。肺癌早期症状不明显,往往确诊时已为晚期。因此,寻找与肺癌诊断和治疗相关的靶基因至关重要。肿瘤转移抑制基因TMSG1基因又称作LASS2基因,包含有同源域(homeodomain)(又称HOX域)和TLC(TRAM-LAG1-CLN8)域。文献报道HOX域对细胞生长起一定的作用,其可能是通过调节细胞周期进程实现的[2]。此外,HOX域可能通过与液泡型ATP酶(Vacuolar H+-ATPase, V-ATPase)V0区域的C亚基结合,对肿瘤的生长、侵袭、转移起抑制作用,促进其凋亡[3]。在调控细胞凋亡的多种转导途径中以线粒体通路最为经典[4-5]。本课题组前期研究发现[6-7],LASS2/TMSG1蛋白的HOX域通过与V-ATPase C亚基结合,降低V-ATPase运输H+的能力,细胞内呈酸性环境,进而使线粒体发生级联反应,参与肿瘤细胞的凋亡,但具体机制尚不明确。本文初步探讨LASS2/TMSG1基因是否通过V-ATPase调控人肺癌95C细胞的凋亡及其机制,为临床与病理医师提供参考。
1 材料与方法
1.1 材料人肺巨细胞癌低转移亚系95C细胞株,购自上海康朗生物公司;人肺巨细胞癌高转移亚系95D细胞株,购自上海复祥生物公司。LASS2/TMSG1-RNAi慢病毒转染试剂购自上海吉凯基因公司;LASS2(C-11):sc-390745抗体购自美国SANTA CRUZ公司;线粒体膜电位检测试剂盒,购自索莱宝公司。
1.2 方法
1.2.1细胞慢病毒感染及抗性基因筛选稳定株 取对数生长期细胞,1×105个/孔接种到6孔板中培养24 h,转染慢病毒48 h后更换成加有嘌呤霉素的完全RPMI 1640培养基,继续培养72 h后提取总RNA和蛋白进行后续检测。实验分为三组:人肺癌95C细胞(正常组)、转染空载质粒组(阴性对照组)、LASS2/TMSG1基因沉默组。
1.2.2RT-PCR法检测mRNA表达 收集细胞沉淀,反转录成cDNA。LASS2/TMSG1的PCR引物:正向引物为5′-GCATGGCCCACAAGTTCA-3′,反向引物为5′-CTGGGGATAGGCTGGTTA-3′,于PCR仪中扩增完成。
1.2.3Western blot法检测蛋白表达 用SDS-PAGE凝胶电泳分离后,转移至NC膜上,按照β-actin(1 ∶1 000)、LASS2/TMSG1(1 ∶300)、P-Akt3(1 ∶200)、Akt3(1 ∶200)、Bax(1 ∶200)、BCL-2(1 ∶200)配制一抗、二抗(羊单克隆抗兔,1 ∶1 500)。
1.2.4流式细胞术 取对数生长期细胞以1×105个/瓶接种于T25培养瓶,细胞融合度达70%后收集细胞;高速离心机中4 ℃、500g离心5 min,收集沉淀;按照Annexin V-FITC细胞凋亡检测试剂盒说明书进行操作。
1.2.5MTT比色法 取对数生长期细胞以1 000个/孔接种到95孔板中,每组设4个复孔,待细胞贴壁后,每隔24 h加入MTT溶液,培养箱孵育4 h后加入DMSO溶液,检测490 nm处的OD值,连续记录5天,独立重复3次。
1.2.6倒置显微镜观察细胞形态及电镜观察细胞线粒体的超微结构 (1)将对数生长期的细胞消化后制成悬液,以1×105个/孔接种到6孔板中孵育24 h,显微镜下观察各组细胞形态并拍照。(2)将对数生长期细胞处理后取沉淀,2.5%戊二醛4 ℃固定1 h,PBS漂洗10 min×3次,锇酸固定后,超纯水再次漂洗,洗好的细胞团块梯度乙醇冰上脱水,放入丙酮与Epon812树脂配置的液体中室温浸透、包埋,电镜观察线粒体超微结构。
1.2.7JC-1染色观察细胞线粒体膜电位的变化 将95C细胞种入6孔板内培养24 h,次日每孔加入1 mL新培养基和1 mL JC-1工作液。细胞培养箱中孵育20 min。孵育结束后JC-1染色缓冲液(1×)清洗2次。更换新培养基后荧光显微镜下观察。

2 结果
2.1 RT-PCR及Western blot检测肺癌95C与95D细胞LASS2/TMSG1 mRNA及蛋白的表达95C细胞中LASS2/TMSG1 mRNA表达以及蛋白表达明显高于95D细胞(t=16.85,P=0.004;t=15.26,P=0.004,图1),选择95C细胞进行后续实验。

图1 RT-PCR及Western blot检测肺癌95C、95D细胞系中LASS2/TMSG1 mRNA(A)及蛋白(B)的表达水平:**P<0.01
2.2 LASS2/TMSG1基因沉默后肺癌细胞LASS2/TMSG1 mRNA及蛋白的表达RT-PCR检测结果:与正常组(4.116±0.300)和阴性对照组(3.984±0.038)相比,LASS2/TMSG1沉默组(1.032±0.276) LASS2/TMSG1 mRNA表达水平明显降低(F=164.053,P<0.001)。Westren blot检测结果:与正常组(0.898±0.044)和阴性对照组(0.926±0.207)相比,LASS2/TMSG1沉默组(0.356±0.764)LASS2/TMSG1蛋白水平显著降低(F=18.293,P=0.003,图2),证明转染成功。

图2 RT-PCR及Western blot检测沉默LASS2/TMSG1各组细胞中LASS2/TMSG1 mRNA(A)及蛋白(B)的表达:与正常组相比,**P<0.01,***P<0.001;与阴性对照组相比,##P<0.01,###P<0.001;1.正常组;2.阴性对照组;3.LASS2/TMSG1沉默组
2.3 流式细胞仪检测LASS2/TMSG1基因沉默后肺癌细胞凋亡情况与正常组(14.85±2.33)%和阴性对照组(15.51±1.09)%相比,LASS2/TMSG1沉默组早期凋亡细胞百分数(8.48±1.12)%明显降低(F=17.340,P=0.003),而晚期凋亡差异无统计学意义(图3)。

图3 LASS2/TMSG1基因沉默后三组细胞的细胞凋亡情况:与正常组相比,**P<0.01;与阴性对照组相比,##P<0.01
2.4 LASS2/TMSG1基因沉默对肺癌细胞体外增殖能力的影响MTT检测接种细胞1、2、3、4、5天后的OD值,LASS2/TMSG1沉默组从第4天(F=66.318,P<0.001)、第5天(F=224.582,P<0.001)开始,细胞增殖能力明显升高(图4)。

图4 LASS2/TMSG1基因沉默对肺癌细胞体外增殖能力的影响:与正常组相比,***P<0.001;与阴性对照组相比,###P<0.001
2.5 LASS2/TMSG1基因沉默后各组肺癌细胞的形态变化正常组:95C细胞大部分区域呈多边形贴壁生长,细胞轮廓较清晰,部分区域细胞逐渐皱缩变圆,部分细胞有脱壁,细胞分布不均匀,数量较少;阴性对照组:大部分细胞呈多边形贴壁生长,部分区域有变圆脱壁的细胞,细胞密度不高,分布较散,可见细胞成堆生长;LASS2/TMSG1沉默组:细胞呈多边形贴壁生长,细胞数量较多,分布均匀,细胞轮廓清晰,生长状态良好(图5)。
2.6 LASS2/TMSG1基因沉默后肺癌细胞线粒体超微结构的变化阴性对照组细胞线粒体结构基本完整,呈圆形、棒状或椭圆形,膜基本完整,线粒体嵴疏松,部分有断裂,排列不规则,尚未见明显的凋亡小体;LASS2/TMSG1沉默组细胞线粒体结构完整,呈棒状,线粒体外膜完整,较清晰,线粒体内嵴正常清晰,分布较密集,未见凋亡小体(图6)。
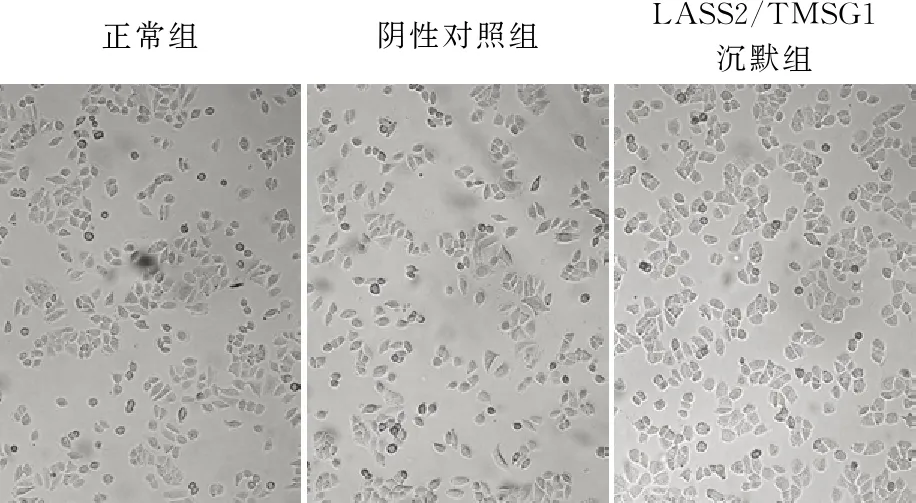
正常组阴性对照组LASS2/TMSG1沉默组
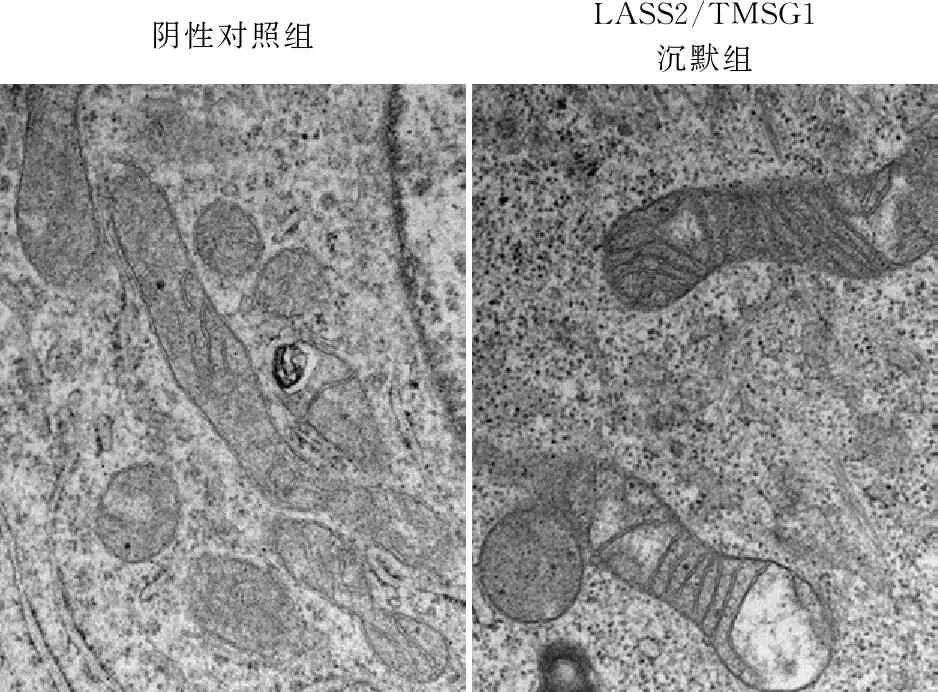
阴性对照组LASS2/TMSG1沉默组
2.7 LASS2/TMSG1基因沉默后肺癌细胞线粒体膜电位的变化JC-1存在单体和多聚体两种状态,当细胞状态较好时,JC-1在线粒体呈现多聚体状态,显示红色荧光;当细胞发生凋亡时,JC-1以单体形式呈现,显示绿色荧光,红/绿荧光强度的比值反应ΔΨm水平,荧光显微镜观察染色细胞并拍照,对荧光强度进行分析。与正常组(0.398±0.068)和阴性对照组(0.476±0.073)相比,LASS2/TMSG1沉默组(0.713±0.080)红色荧光强度相当,绿色荧光相对低,红/绿荧光比值下降(F=14.687,P=0.005,图7)。

正常组阴性对照组LASS2/TMSG1沉默组
2.8 LASS2/TMSG1基因沉默肺癌细胞中P-Akt3、Akt3、BCL-2、Bax蛋白表达与正常组(0.327±0.028)及阴性对照组(0.341±0.026)相比,LASS2/TMSG1沉默组P-Akt3蛋白表达量(0.553±0.060)明显增高(F=28.628,P<0.001),Akt3蛋白表达量差异无统计学意义,P-Akt3/Akt3显著提高;Bax表达量无影响;与正常组(0.839±0.172)和阴性对照组(0.860±0.122)相比,LASS2/TMSG1沉默组(1.162±0.061)BCL-2蛋白的表达量升高(F=6.049,P=0.036),BCL-2/Bax升高(图8)。
3 讨论
肺癌作为全球病死率最高的肿瘤,严重威胁人类健康。寻找有效的治疗靶点是当务之急。既往研究显示,LASS2/TMSG1通过其HOX功能域,提高细胞内H+含量[8],使线粒体产生级联反应,促使肿瘤细胞凋亡。本实验探索LASS2/TMSG1基因的表达对肺癌细胞增殖、凋亡的影响,以及能否通过线粒体凋亡途径发挥作用。徐晓艳[9]利用脂质体转染法沉默人前列腺癌PC-3M-2B4(低转移潜能)细胞中LASS2/TMSG1基因后,对PC-3M-2B4细胞的恶性进程起促进作用。LASS2/TMSG1在肺癌[7]、肝癌[10]、乳腺癌[11]、鼻咽癌[12]等癌症转移过程中发挥的负调控作用也被证实,但在凋亡方面的研究较少。
本课题组前期研究[6]发现,LASS2/TMSG1能够抑制95C细胞的侵袭和转移,能够使95C细胞内H+浓度升高。有文献表明[13],细胞内酸性环境可促进细胞凋亡,因此推测LASS2/TMSG1高表达可能造成95C细胞凋亡率升高。构建LASS2/TMSG1基因低表达人肺癌95C细胞,对细胞株进行流式细胞术结合AV-PI双染,LASS2/TMSG1沉默组的细胞凋亡率明显低于另外两组(P<0.05)。MTT实验结果显示:从第4天开始,LASS2/TMSG1沉默组细胞增殖能力明显增加,可能是LASS2/TMSG1基因沉默后,抑制细胞凋亡,促进细胞增殖。细胞受到启动凋亡通路的各种信号刺激,线粒体内外膜之间的线粒体通透性转变孔(mPTP)会不可逆的过度开放,使线粒体跨膜电位ΔΨm崩解,ΔΨm下降,呼吸链解偶联,线粒体基质渗透压升高,线粒体内膜肿胀,释放膜间促凋亡蛋白(Cyt-c、Bax等),促进细胞凋亡[14-15]。在凋亡过程中,线粒体结构和功能的改变往往早于核及染色体的改变,揭示在凋亡进程中线粒体可能起到了一定的枢纽作用。前期研究表明:LASS2/TMSG1通过使线粒体产生的级联反应,参与肿瘤细胞凋亡[16]。因此,线粒体结构常用来间接反映凋亡状态。线粒体功能障碍时,常表现为小泡状膜结构,电镜下不同截面的线粒体会增多,线粒体会发生肿胀、嵴消失等变化[17]。本实验用电镜对细胞线粒体的超微结构进行了观察:阴性对照组细胞线粒体结构显示出早期凋亡的特征;而LASS2/TMSG1沉默组未见明显凋亡形态。推测LASS2/TMSG1基因沉默后,对95C细胞的线粒体超微结构起到一定的保护作用,抑制了肿瘤细胞的早期凋亡过程。提示线粒体参与肿瘤细胞凋亡的过程。JC-1染色发现:LASS2/TMSG1沉默组的红/绿荧光强度比值较正常组和阴性对照组高,推测LASS2/TMSG1基因能够使95C细胞的线粒体膜电位下降,线粒体内膜肿胀,诱导细胞凋亡。在线粒体参与细胞凋亡的途径中,多种信号转导通路发挥重要作用,PI3K/AKT信号通路与肿瘤进展较为密切,在细胞的增殖、存活和凋亡[18-19]过程中有一定的调控意义。BCL-2家族是线粒体凋亡途径中的主要调控者,通过激活一系列下游基因调节细胞凋亡[20-21],同时作为PI3K/AKT信号通路重要靶点,通过BCL-2/Bax的比例影响细胞凋亡。AKT激活可促进BCL-2的生成,抑制Bax等促凋亡蛋白的形成,导致BCL-2/Bax比例上调,进而抑制细胞凋亡。本实验发现LASS2/TMSG1基因沉默后,P-Akt3/Akt3及BCL-2/Bax升高,细胞凋亡受到抑制,与流式细胞仪检测结果一致。提示LASS2/TMSG1基因沉默后抑制95C细胞凋亡,可能与激活PI3K/AKT联合线粒体参与的信号通路有关。

图8 LASS2/TMSG1基因沉默后肺癌细胞P-Akt3、Akt3、BCL-2、Bax蛋白表达:与正常组相比,*P<0.05,***P<0.001;与阴性对照组相比,#P<0.05,###P<0.001
综上,沉默人肺癌95C细胞LASS2/TMSG1基因,其可以通过HOX域与ATP6L亚基结合使胞内H+浓度升高,进而使线粒体超微结构发生变化,ΔΨm降低,线粒体凋亡通路中的相关蛋白释放,促进95C细胞凋亡,抑制细胞增殖。目前,LASS2/TMSG1基因是否影响线粒体凋亡通路中其它蛋白的表达及TLC参与的神经酰胺合成等,还需进一步分析。

