miR-296-5p在糖尿病肾病db/db小鼠血浆外泌体中的表达及功能
刘 苏,徐巍龙,查 敏,李 楠,周静波,叶丽芳
南京中医药大学附属医院内分泌科,江苏 南京 210029
肾间质纤维化是糖尿病肾病(diabetic nephropathy,DN)进展至终末期肾病的主要病理途径,转录因子Snail1介导的肾小管上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)通过旁分泌等作用,促进肌成纤维细胞的募集或增殖,是加速肾间质纤维化的重要环节之一[1]。Snail1 受到多种微小核糖核酸(miRNA,miR)的调控[2],血浆/血清外泌体包裹的miRNA 具有高稳定性、源细胞特征及靶向功能性[3],是体内各组织/器官间细胞通讯的新途径[4],血浆外泌体miR-296-5p 与肿瘤细胞的EMT相关[5],目前尚无miR-296-5p在DN血浆外泌体中表达及对肾小管上皮细胞EMT 影响的相关研究,因此,本研究拟通过DN小鼠模型,利用外泌体RNA测序及生物信息学分析等手段,明确miR-296-5p 在DN 小鼠血浆外泌体中的表达变化,并进一步探索其参与糖尿病肾病EMT进程的可能机制。
1 材料和方法
1.1 材料
动物:10周龄SPF级健康雄性db/db小鼠12只,雄性db/m小鼠12只,体重20~45 g,由南京大学实验动物中心提供[动物许可证号:SCXK(苏):2018-0008]。
主要试剂:exoRNeasy Midi Kit(Qiagen 公司,美国);miRNA 1st Strand cDNA Synthesis Kit(by stemloop)、miRNA Universal SYBR qPCR Master Mix(南京诺唯赞生物);Snail1 野生型双荧光素酶报告质粒、Snail1突变型双荧光素酶报告质粒(安徽通用生物);miR-296 mimics、NC(苏州吉玛基因);293T 细胞(ATCC,美国);LipofectamineTM2000(Invitrogen 公司,美国);DMEM 高糖、FBS(Hyclone 公司,美国);青链双抗(上海生工生物);双荧光检测试剂盒(Promega公司,美国);苏木素-伊红染液试剂盒(南京凯基生物)。
主要仪器:荧光定量PCR仪(ABI7300)、细胞培养箱(Thermo)、荧光倒置显微镜(OLYMPUS,IX71)、超净工作台(苏州安泰科技有限公司)、低温冷冻离心机(Sigma 3K15)、脱色摇床(海门市其林贝尔TS200A)、发光检测仪(Molecular Devices SpectraMax®i3)、超速离心机(Himac CP80WX)、透视电子显微镜(Tecnai)、ZetaView Particle Metrix(Particle Metrix)。
1.2 方法
1.2.1 分组及取样
首先选取6只10周龄db/db小鼠为模型组,6只10周龄db/m小鼠为对照组,在南京医科大学实验动物中心适应性喂养2 周,麻醉后对小鼠行眼眶采血致死,血浆混样后行外泌体RNA 测序及生化检测。完成差异miRNA 筛选后,再次选取6 只10 周龄db/db 小鼠为模型组,6 只10 周龄db/m 小鼠为对照组,重复上述饲养及处死流程,血浆混样后行外泌体鉴定及外泌体miRNA 验证。24 h 尿液标本利用代谢笼收集。肾组织标本部分冻存于液氮中,用于RNA和蛋白提取;部分保存于多聚甲醛,包埋后用于Masson 染色及免疫组化。动物实验按照南京医科大学实验动物福利伦理委员会规定进行操作,伦理批件编号:IACUC-2103058。
1.2.2 小鼠生化指标检测
血、尿标本送南京润太医学检验有限公司实验室,测定血尿素(BUN)、血肌酐(Scr)、血胱抑素C(Cys-C)、空腹血糖(FBG)、24 h尿蛋白定量(Upro)。
1.2.3 小鼠血浆外泌体miRNA测序
分别取2 mL db/m 组和db/db 组小鼠血浆,送上海其明生物技术有限公司进行血浆外泌体miRNA测序,并利用生物信息学软件进行分析。按|log2FC|值由高到低进行验证。
1.2.4 血浆外泌体提取
分别取2 mL db/m 组和db/db 组小鼠血浆,采用差速超速离心法,予300g,4 ℃离心10 min;取上清液,2 000g4 ℃离心10 min,12 000g4 ℃离心30 min;120 000g4 ℃离心70 min,取透明沉淀重悬于PBS,所得即为外泌体溶液;取其中20 μL,加入PBS后再次120 000g4 ℃离心70 min,取透明沉淀重悬于PBS,所得即为电镜使用。
1.2.5 透视电子显微镜及纳米颗粒跟踪分析(nanoparticle tracking analyze,NTA)鉴定外泌体
外泌体样本静置于铜网上1 min,2%醋酸双氧铀染色液室温染色1 min,将染色完成的样本放于灯下烤10 min,透射电镜观察拍照,保存图片。外泌体样本以1×PBS buffer 稀释,使用ZetaView PMX110进行NTA,结合Stockes-Einstein 方程式计算外泌体粒径和浓度。
1.2.6 小鼠血浆外泌体RNA提取
使用QIAGEN exoRNeasy Midi Kit 试剂盒直接提取血浆外泌体RNA,步骤为:加等体积Buffer XBP到样品中,500g离心1 min;5 000g离心1 min,将离心柱转移到新的收集管中,加700 μL QIAzol 到膜上,5 000g离心5 min,收集裂解液,室温孵育5 min;加入90 μL 氯仿,震荡15 s,室温孵育2~3 min,4 ℃12 000g离心15 min;转移上层水相到新的离心管中,加入2倍体积的无水乙醇,颠倒混匀;转移混合样品到离心柱中,放入2 mL收集管中,室温,>8 000g离心15 s;加700 μL Buffer RWT到离心柱中,>8 000g离心15 s;加500 μL Buffer RPE到离心柱中,>8 000g离心15 s,重复这一步骤;将离心柱转移到新的收集管中,开盖全速离心5 min使膜晾干;将离心柱放入新的1.5 mL离心管中,加14 μL水到膜中央,室温放置1 min,全速离心1 min,获得的RNA放-80 ℃冰箱备用,行血浆外泌体miRNA验证。
1.2.7 实时定量qPCR(RT-qPCR)检测
外泌体RNA 提取、逆转录及荧光定量PCR 反应体系及程序参照试剂说明书,miR-296-5p 和Snail1 mRNA 的表达情况用2-ΔΔCt方法进行相对定量分析,分别以U6 和GAPDH 为内参,引物序列见表1。

表1 用于RT-qPCR的引物序列Table 1 Primer sequences for RT-qPCR
1.2.8 生物信息学分析
利用TargetScan、miRanda软件,预测靶向Snail1的miRNA,取两种软件预测结果的并集。mmu-miR-296-5p成熟体序列来自miRBase 数据库。利用TargetScan 软件预测mmu-miR-296-5p 与Snail1 的结合位点,根据结合位点碱基序列设计突变型载体序列,突变序列为:5′-ACATGTCCAGGTGCCCCTGGGCCTGGGCAACTGTTTCAGCCCCCGCCCCCAT -TTGTCCTGGTGACACCTGTTTCACAGCAGTTTAACTGTCTCAGAAGGGACCATGAATAATGGCCATCACTTGTTAGGGGCCAAGTGGGGTGCTTCAGCCTGGC -CAATGTGTCTCCCAGAACTATTTTCCCCGGGTACAGGTGGCCCCGGGAGAAAGATGTTTACATTTTAAAGGTATTTATATTGTAAGCAGCATTTTGTATAGTTAATATGTACAGT T T ATTGATATTCAATAAAATGGTTAATTTATATACTAAAAA-3′(下划线部分为结合位点突变后的基因序列)。
1.2.9 双荧光素酶实验
构建野生型和突变型的Snail1-UTR 双荧光报告质粒(Snail1-WT,Snail1-MUT)。将对数生长期的293T 细胞以1×105个/mL 接种至24 孔培养板,每孔500 μL。将Snail1-WT、Snail1-MUT 与miR-296-5p mimics 和mimics NC 按照LipofectamineTM2000 说明书步骤转染至293T 细胞,每组实验设置3 个重复。培养箱内培养48 h后,参照双荧光素酶报告基因检测试剂盒步骤检测荧光素酶活性。
1.2.10 小鼠肾组织病理学检查
肾组织用4%多聚甲醛固定,梯度乙醇脱水,二甲苯透明,浸蜡包埋,4 μm 切片,Masson、HE染色后光镜下观察肾组织病理学变化。免疫组化分析小鼠肾组织E-cadherin、α-SMA及Snail1蛋白表达。定量方法为将每个指标db/m 组小鼠的染色面积作为1,db/db组小鼠的染色面积与db/m组小鼠的染色面积的比值即为该指标的相对表达量。
1.3 统计学方法
数据分析采用GraphPad Prism 5 软件,计量资料采用均数±标准差()表示,两组间比较采用student-t检验;计数资料采用频数和百分比(%)表示,两组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠代谢及生化指标比较
与db/m组比较,db/db组小鼠24 h尿蛋白定量、血尿素、血肌酐、血胱抑素C、空腹血糖、体重均升高,其中Upro、FBG、体重升高显著(P=0.003,P<0.001,P=0.020),符合2 型糖尿病肾病小鼠临床表现(表2)。
表2 小鼠尿蛋白、肾功能、血糖及体重比较Table 2 Comparison of urine protein,renal function,blood glucose and weight in mice (,n=6)

表2 小鼠尿蛋白、肾功能、血糖及体重比较Table 2 Comparison of urine protein,renal function,blood glucose and weight in mice (,n=6)
2.2 小鼠血浆外泌体鉴定
电镜视野下,两组小鼠血浆均可见少量外泌体样结构(图1)。NTA 结果显示,db/m 组小鼠血浆外泌体的颗粒检测浓度为6.4×107个/mL,平均粒径132.1 nm;db/db组小鼠血浆外泌体的颗粒检测浓度7.7×107个/mL,平均粒径126.8 nm,均符合外泌体分布范围,两组血浆外泌体粒径比较,差异无统计学意义(P=0.890)。
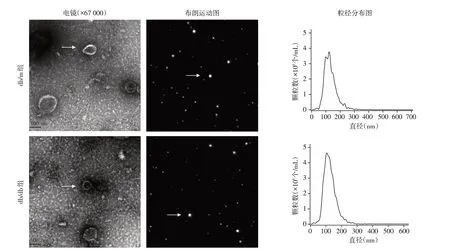
图1 透视电镜及NTA技术鉴定小鼠血浆外泌体Figure 1 Characterization of mouse plasma exosomes by transmission electron microscope and NTA
2.3 小鼠血浆外泌体miRNA测序分析及验证
db/m 组、db/db 组小鼠血浆外泌体行miRNA 测序,通过TargetScan、MiRanda软件,并集筛选出32个靶向Snail1的差异miRNA,其中17个miRNA表达上调,15个miRNA表达下调(表3)。

表3 靶向Snail1的小鼠血浆外泌体差异miRNATable 3 Sequencing results of different plasma exosomal miRNA targeting Snail1
按照|log2FC|值由高到低顺序,利用小鼠肾组织行RT-qPCR 验证,优先检测TargetScan、MiRanda 软件中重复的miRNA。结果显示,与db/m 组相比,db/db 组小鼠肾组织mmu-miR-296-5p 降低,mmu-miR-34a-5p 升高(P=0.001,P=0.011),差异有统计学意义(图2)。进一步利用小鼠血浆外泌体行RT-qPCR 验证,发现db/db 组小鼠血浆外泌体中mmu-miR-296-5p 表达下降,mmu-miR-34a-5p 表达升高(P=0.011,P=0.013),差异有统计学意义(图3)。结合|log2FC|值,选取miR-296-5p为本研究目标miRNA。
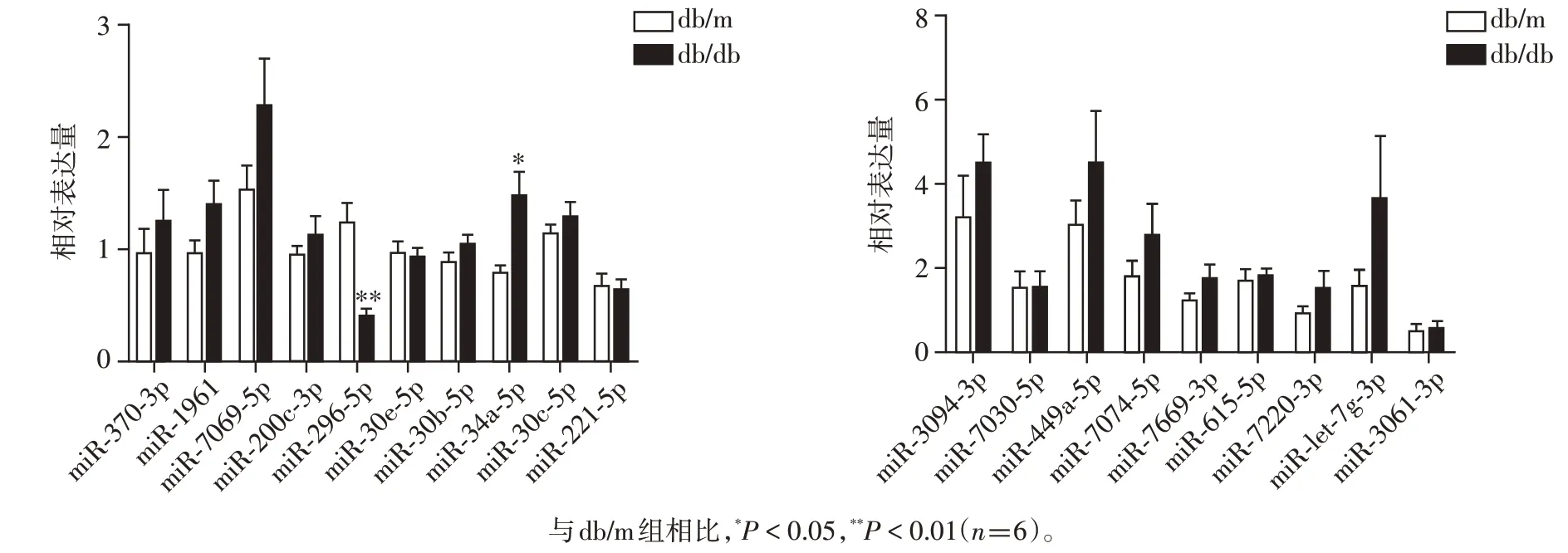
图2 RT-qPCR验证小鼠肾组织miRNA表达Figure 2 Verification of miRNAs in mouse kidneys by RT-qPCR
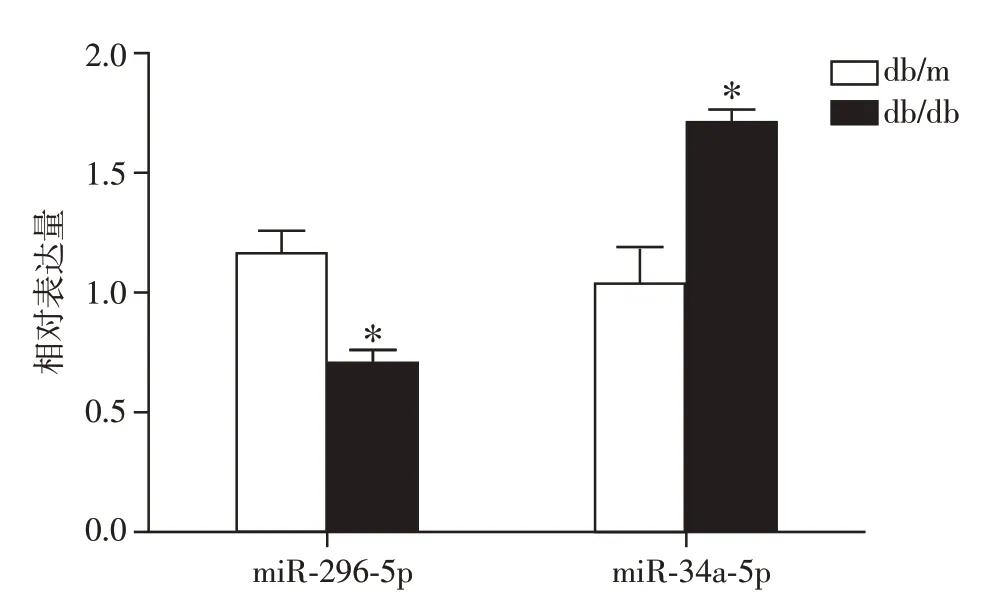
图3 RT-qPCR验证小鼠血浆外泌体miRNA表达Figure 3 Verification of miRNAs in mouse plasma exsomes by RT-qPCR
2.4 双荧光素酶实验检测mmu-miR-296-5p与Mus-Snail1的靶向关系
TargetScan 软件预测mmu-miR-296-5p 与Snail1 3′UTR 的结合位点位于Snail1 3′UTR 区596~603 位置(图4)。双荧光素酶报告基因检测实验结果显示:与miR-296-5p mimics NC组相比,miR-296-5p mimics组Snail1-WT 细胞的荧光素酶活性强度明显降低(P<0.001);Snail1-MUT 细胞的荧光素酶活性强度无明显变化(P=0.060);Snail1-WT 细胞miR-296-5p mimics 组与Snail1-MUT 细胞miR-296-5p mimics组比较,荧光素酶活性强度差异有统计学意义(P=0.003,图5),证明miR-296-5p靶向结合Snail1。

图4 Snail1与miR-296-5p的结合位点序列图Figure 4 Sequence of the binding sites of Snail1 and miR-296-5p
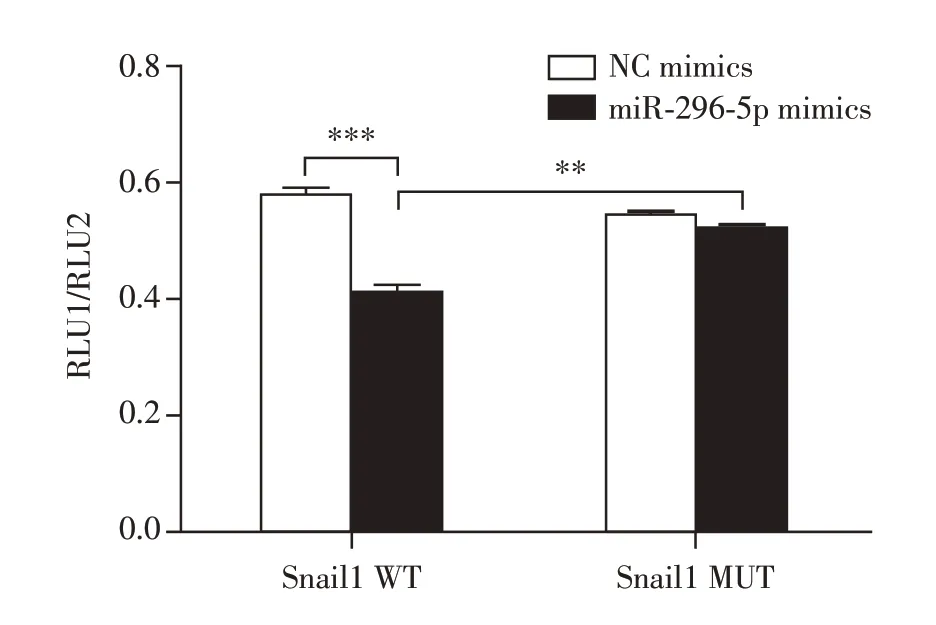
图5 双荧光素酶检测结果Figure 5 Results of dual luciferase assay
2.5 RT-qPCR检测小鼠肾组织EMT相关基因表达水平
与db/m 组相比,db/db 组小鼠肾组织中E-cadherin mRNA 表达下调(P=0.012),α-SMA mRNA 表达上调(P=0.042),差异有统计学意义;Snail1 mRNA表达极度上调(P<0.001,图6),提示db/db 小鼠肾组织存在α-SMA阳性肌成纤维细胞增殖及Snail1介导的EMT。
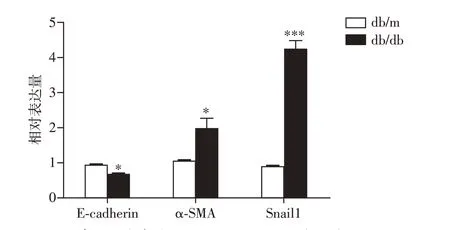
图6 RT-qPCR 检测小鼠肾组织中E-cadherin、α-SMA 及Snail1 mRNA表达Figure 6 The mRNA expression of E-cadherin,α-SMA and Snail1 in mouse kidney by RT-qPCR
2.6 小鼠肾组织病理切片的观察
Masson染色见db/m组小鼠肾小球大小正常,无肾小管扩张、萎缩,细胞外Masson 染色阳性面积小于视野面积的10%。db/db 组小鼠肾小球、肾间质均见Masson 阳性染色,肾小管扩张明显,细胞外Masson 染色阳性面积占视野面积的50%左右。HE染色见db/m 组小鼠系膜基质无增多,肾小管上皮细胞形态正常;db/db 组小鼠肾小球中性粒细胞浸润,系膜基质增多,间质见炎症细胞、浆细胞浸润(图7)。db/db小鼠肾组织呈现间质炎症、纤维化的病理表现。

图7 Masson、HE染色观察小鼠肾组织形态学(×100)Figure 7 The morphology of mouse kidney by Masson and HE staining(×100)
2.7 免疫组化染色观察小鼠肾组织中E-cadherin、α-SMA、Snail1蛋白表达水平
与db/m组相比,db/db组小鼠E-cadherin蛋白表达量下降,差异具有统计学意义(P=0.020);α-SMA蛋白表达量有上升趋势(P=0.152),但无统计学差异;Snail1蛋白表达量明显增加(P=0.005,图8)。
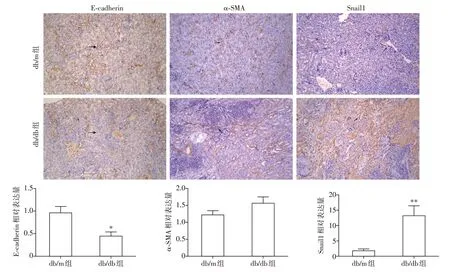
图8 免疫组化染色观察小鼠肾组织E-cadherin、α-SMA、Snail1的表达(×100)Figure 8 The expression of E-cadherin,α-SMA and Snail1 in mouse kidney by immunohistochemical staining(×100)
3 讨论
肾间质纤维化的主要特征是α-SMA 阳性肌成纤维细胞增殖和细胞外基质过度沉积,是DN 肾功能进行性下降的主要原因之一。目前研究显示,肾小管上皮细胞EMT 不是肌成纤维细胞的主要来源[6],而是通过诱导上皮细胞周期阻滞[7]、促进肌成纤维细胞分化及维持间质炎症等方式[8],加速肾间质纤维化。因此,明确EMT 的调控机制,对防治糖尿病肾病至关重要。
EMT 的本质是上皮细胞向间充质细胞表型转化的过程,在糖尿病背景下,损伤的肾小管上皮细胞E-cadherin表达下调,细胞丧失黏附特性,逐渐从基底膜上脱落,表达α-SMA 间充质细胞表型,并通过断裂的肾小管基底膜移行到肾间质中。本研究中,12 周龄db/db 小鼠肾组织病理见间质炎症细胞浸润,Masson 染色阳性;肾组织α-SMA 基因表达增加,蛋白表达有上升趋势,符合早期DN肾小管间质纤维化改变。与此同时,肾组织E-cadherin 基因和蛋白下调显著,提示在DN 肾小管间质病变早期即存在上皮细胞EMT,EMT与间质炎症及肌成纤维细胞增殖相关。本研究免疫组化检测未见α-SMA 蛋白显著上升,可能和造模时间短、肾间质病变早期纤维化程度不严重有关。
E-cadherin 表达减少或缺失是EMT 的标志,受到转录因子Snail1的调节[9]。在肾脏上皮细胞正常分化过程中,低表达的Snail1 可维持肾组织结构及内环境稳态;而病理状态下,升高的Snail1与E-cadherin 启动子的E2-box 特异性结合,抑制E-cadherin基因的转录,下调E-cadherin 表达,触发上皮细胞EMT[10]。既往文献报道,Snail1 在糖尿病肾病、IgA肾病、微小病变肾病等多种肾脏疾病中均可升高,而在DN时升高显著[11]。肾纤维化小鼠模型[12]及肾小管上皮细胞EMT 模型[13]进一步证实,升高的Snail1 可诱导肾小管上皮细胞EMT。本研究db/db小鼠肾组织Snail1 基因及蛋白表达显著增加,而E-cadherin 降低明显,结合文献资料,本研究提出,DN 时,肾组织局部Snail1 表达增加,通过下调E-cadherin,诱导了肾小管上皮细胞EMT。
Snail1又受到多种miRNA的靶向调控[2,14],而血浆或血清中的miRNA 发挥调控功能需要外泌体介导。首先,外泌体是循环miRNA 的主要存在形式,其特殊的脂质双层膜结构将miRNA 与外界核酸酶相隔绝,相比血循环中游离的miRNA,外泌体中的miRNA具有良好的生物稳定性。其次,外泌体由来源细胞主动胞吐释放到细胞外,其包裹的miRNA能够直接反映机体的生理病理状态,在癌症[15]、脂肪营养不良[16]、心血管疾病[17]等疾病中,循环外泌体miRNA表达谱呈特异性改变,是疾病诊断的新型标志物。本研究通过小鼠血浆外泌体miRNA 测序及RT-qPCR 验证,发现db/db 小鼠miRNA 在血浆外泌体中呈差异表达,其中miR-296-5p 显著下调,可能是DN潜在的生物标志物。本研究认为,miR-296-5p在db/db 小鼠血浆外泌体表达下降,是在糖尿病背景下,肾脏及肾外组织功能障碍的共同结果。首先,肾脏作为DN的主要病变器官,可能释放富集差异表达miRNA 的外泌体[18];其次,脂肪细胞被认为是循环外泌体miRNA 的主要来源[16],在高糖背景下,包括肾脏、脂肪在内的胰岛素敏感组织均可出现功能障碍,血浆外泌体miR-296-5p的来源细胞有待后续研究进一步明确。
目前血浆外泌体miRNA 的研究多围绕疾病诊断及病情评估,其靶向调节功能的相关研究甚少,血浆外泌体可通过直接融合胞膜或内陷胞吞、水平转移miRNA 等进入靶细胞,调控靶细胞基因。本研究miR-296-5p 在db/db 小鼠肾组织中表达下调,与血浆外泌体中表达一致,双荧光素酶检测提示,miR-296-5p与Snail1存在靶向关系,因此,本研究提出,表达下调的miR-296-5p可能通过血浆外泌体递送,靶向上调肾小管上皮细胞Snail1,诱导肾小管上皮细胞EMT,加速DN肾间质纤维化。
综上所述,miR-296-5p在DN db/db 小鼠血浆外泌体中表达显著下降,是DN 的潜在生物标志物之一。同时,本研究在动物实验水平提出,表达下调的miR-296-5p可能通过血浆外泌体递送,靶向上调肾小管上皮细胞Snail1,诱导肾小管上皮细胞EMT,加速DN 肾间质纤维化,但仍需通过细胞实验及药物干预实验等进一步验证。
——外泌体与老年慢性疾病相关性的研究进展

