Caspase依赖的氧化应激对脓毒症肾小管上皮细胞损伤的作用及机制
孙林春,刘建璟,张 利
1南京医科大学附属儿童医院儿科研究所,江苏 南京 210008;2江苏省中医药研究院,江苏 南京 210009;3南京中医药大学附属中西医结合医院肾内科,4检验科,江苏 南京 210009
急性肾损伤(acute kidney injury,AKI)是致病因素引起的短时间内肾脏功能急剧下降和/或肾实质损伤,在临床极为常见,在住院患者中的发生率为2%~12%,重症监护室患者可高达30%[1]。AKI 增加了肾脏病患者进展到终末期的风险,导致预后不良,尤其是同时发生肾功能下降和肾实质损伤的患者[2]。引起AKI 的病因很多,如缺血-再灌注损伤、烧伤、药物毒性、脓毒症等,其中脓毒症所致AKI 占临床AKI的比例不断增加,占到AKI病因的29.6%~47.6%[3]。AKI又能加重其他脏器损伤,引起多器官功能障碍。与非脓毒症性AKI和单纯脓毒症患者相比,合并AKI的脓毒血症患者预后明显变差,病死率在50%~80%[4]。如何防治AKI 已经成为全球性的公共卫生问题,是肾脏病学及重症医学面临的重要挑战。
氧化应激是脓毒症肾损伤的重要机制之一。线粒体是肾小管细胞产生活性氧(reactive oxygen species,ROS)的主要来源。脓毒症时,肾组织受全身炎症反应的影响,ROS 生成增多,最终引起脓毒症肾损伤[5]。调节ROS 和氧化应激状态可能成为脓毒症肾损伤的潜在治疗靶点。线粒体途径是经典的细胞凋亡信号通路。近来研究发现,ROS 爆发涉及线粒体途径的细胞凋亡[6]。肿瘤细胞局部高浓度ROS 能引起线粒体膜通透性转运孔开放,跨膜电位降低,细胞色素释放并激活半胱氨酸蛋白酶Caspase,通过下游级联反应导致DNA碱基断裂,诱导凋亡[7]。但脓毒症肾细胞损伤中氧化应激和Caspase途径细胞凋亡的研究还较少。
模式识别分子通过模式识别受体作用于肾小管上皮细胞,诱导炎症反应和组织细胞损伤。脓毒症时,病原体相关分子模式被体内的模式识别受体识别,引发炎症反应;革兰阴性细菌外膜的脂多糖(lipopolysaccharide,LPS)是目前脓毒症中研究最多的外源性模式识别分子[8]。H2O2能在短时间内提高细胞中氧化应激水平,且涉及多种信号通路,被广泛用于体外诱导氧化应激损伤的细胞模型[9]。本研究通过LPS 刺激建立人肾小管上皮细胞HK-2 的脓毒症细胞模型,用H2O2和Caspase 3特异性肽类抑制剂Ac-DEVD-CHO 单独或联合干预细胞,观察Caspase 依赖的氧化应激对肾小管上皮细胞损伤的调节作用,探讨脓毒症肾小管上皮损伤的机制。
1 材料和方法
1.1 材料
人肾小管上皮细胞HK-2细胞购自中科院典型培养物保藏中心,用含10%胎牛血清、100 U/mL 青链霉素双抗的DMEM/F12 培养基,在37 ℃、饱和湿度的二氧化碳培养箱中培养。
兔抗人Cleaved-Caspase 3 多克隆抗体、兔抗人Cleaved-PARP 多克隆抗体和兔抗人β-actin 多克隆抗体(ABI 公司,美国);酶标羊抗兔IgG(南京建成生物工程研究所);H2O2、Caspae 3抑制剂Ac-DEVDCHO(上海碧云天生物技术研究所);MTT 试剂盒(上海生工生物工程有限公司);Annexin V/PI 凋亡检测试剂盒(BD 公司,美国);DHE 试剂盒(Invitrogen 公司,美国)。凝胶成像系统(Bio-Rad 公司,美国),流式细胞仪(BD公司,美国)。
1.2 方法
1.2.1 脓毒症细胞模型分组
用终浓度10 μg/mL 的LPS 处理12 h 建立脓毒症细胞模型,分为:阴性对照组(不做处理)、过氧化氢组(H2O2300 μmol/L)、Caspase 抑制剂组(Ac-DEVD-CHO 15 μmol/L)、Caspase 抑制剂+过氧化氢组(H2O2300 μmol/L+Ac-DEVD-CHO 15 μmol/L),并以正常培养的HK-2细胞为空白对照组。
1.2.2 Western blot检测
提取细胞总蛋白,用蛋白标准品绘制标准曲线进行蛋白定量。80 V恒压电泳30 min后,继续用120 V 恒压电泳至蛋白Marker 跑至距离胶底1 cm,停止电泳。用硝酸纤维素薄膜90 V 恒压下电转2 h。将蛋白膜用封闭液(含5%脱脂奶粉)室温封闭2 h,再浸入用封闭液按1∶500 稀释的一抗溶液中,4 ℃过夜;将蛋白膜用TBST 洗涤3 次,5 min/次后,再浸入用TBST 按1∶1 000 稀释的二抗溶液中,室温孵育1 h。洗膜后,用显影剂显色,用自动凝胶成像系统记录并分析Cleaved-Caspase 3 和Cleaved-PARP蛋白条带。
1.2.3 ROS检测
将各组细胞制成1×105个/mL 单细胞悬液,按100 μL/孔加入流式管中,加入5 μmol/L DHE,37 ℃避光孵育30 min,PBS洗涤后,上流式细胞仪检测。
1.2.4 细胞增殖检测
将细胞按1×103个/孔接种到96孔板,给予相应处理,每组设6 个平行孔。分别在处理后的0 h 和48 h,每孔加入20 μL MTT溶液,置培养箱中孵育4 h。用酶标仪检测各孔在490 nm处的吸光度,计算细胞存活率,以时间为横坐标,存活率为纵坐标,绘制细胞增殖曲线。
1.2.5 细胞凋亡检测
将各组细胞用胰酶消化后,用PBS 缓冲液制成1×105个/mL 单细胞悬液,按100 μL/孔加入流式管中,再分别加入20 μL Annexin V-异硫氰酸(fluorescein isothiocyanate,FITC),和20 μL 碘化丙啶(propidium iodide,PI)。另设单阳管和阴性对照管,室温避光孵育20 min;再加入500 μL PBS 缓冲液,混匀后上流式细胞仪检测。
1.2.6 细胞周期检测
将各组细胞制成1×105个/mL 单细胞悬液,按100 μL/孔加入流式管中,加入1 mL PBS 和2 mL 无水乙醇,用封口膜密封管口置于4 ℃24 h,固定细胞。吸出上清液,加3 mL PBS重悬细胞,离心,向管底加入200 μL 50 mg/mL 的PI 染液,4 ℃避光孵育30 min,上流式细胞仪检测细胞周期。
1.3 统计学方法
用SPSS17.0 软件进行数据处理,结果用均数±标准差()表示,两组间比较采用t检验;多组间比较用单因素方差分析(one-way ANOVA),组间两两比较采用LSD 法。以P<0.05 为差异有统计学意义。
2 结果
2.1 H2O2引起脓毒症肾小管上皮细胞凋亡相关蛋白的异常表达
H2O2组肾小管上皮细胞Cleaved-Caspase 3 和Cleaved-PARP 蛋白表达较阴性对照组显著升高(P<0.05);两组Cleaved-Caspase 3和Cleaved-PARP蛋白均高于空白对照组(P<0.05,图1)。结果表明,H2O2能引起脓毒症肾小管上皮细胞凋亡相关蛋白异常表达。
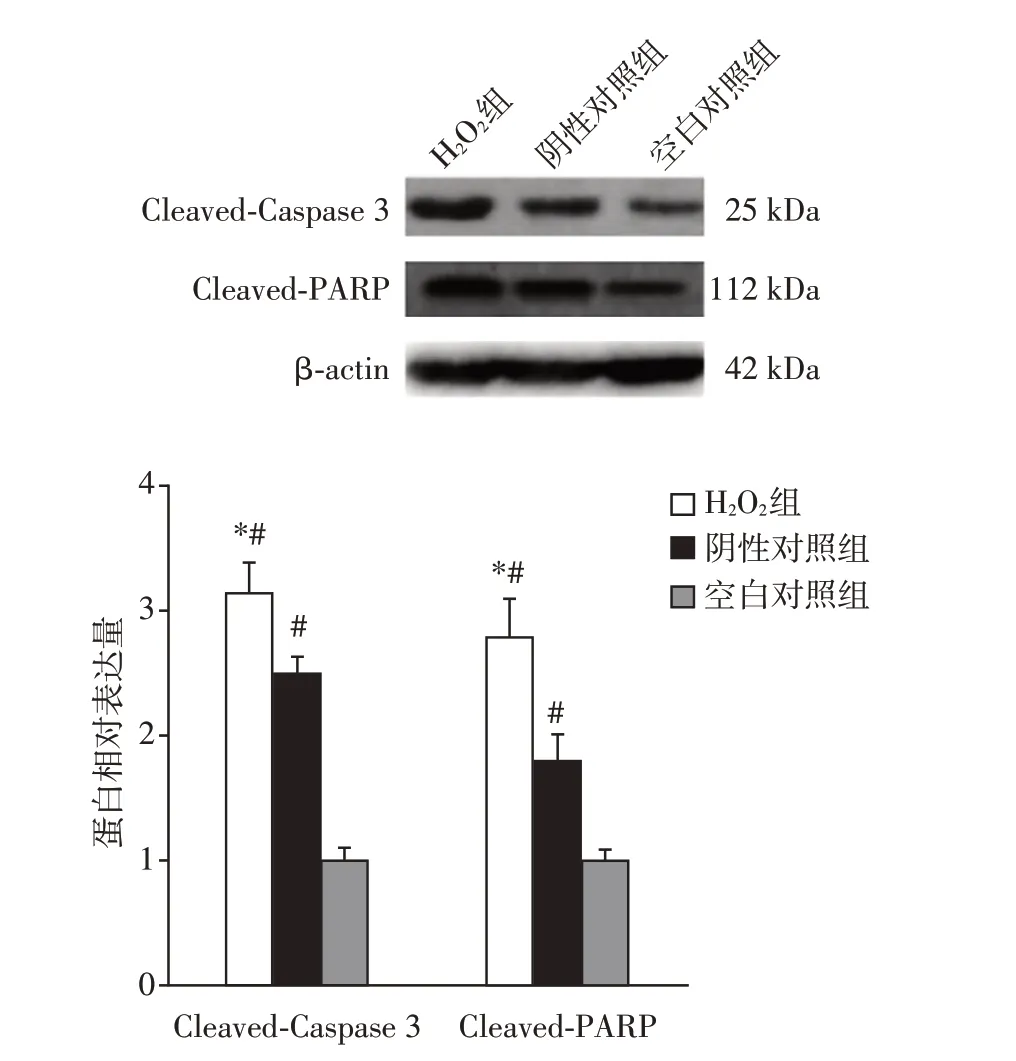
图1 各组凋亡相关蛋白的表达Figure 1 Expression of apoptosis-related proteins in each group
2.2 Caspase 抑制剂降低氧化应激诱导的脓毒症肾小管上皮细胞ROS水平
空白对照组、阴性对照组、H2O2组、Caspase 抑制剂组和Caspase 抑制剂+H2O2组细胞中ROS 平均荧光强度分别为783±67、1 216±92、1 915±122、1 112±85 和1 623±100。阴性对照组中ROS 水平较空白对照组细胞升高(P<0.05);H2O2组ROS 水平较阴性对照组进一步升高(P<0.05),Caspase抑制剂+H2O2组细胞中ROS 水平较H2O2组降低(P<0.05),但仍高于阴性对照组(P<0.05,图2)。结果说明,H2O2能提高脓毒症肾小管上皮细胞的ROS 水平,而Caspase 抑制剂能降低H2O2诱导的ROS 水平升高效应。
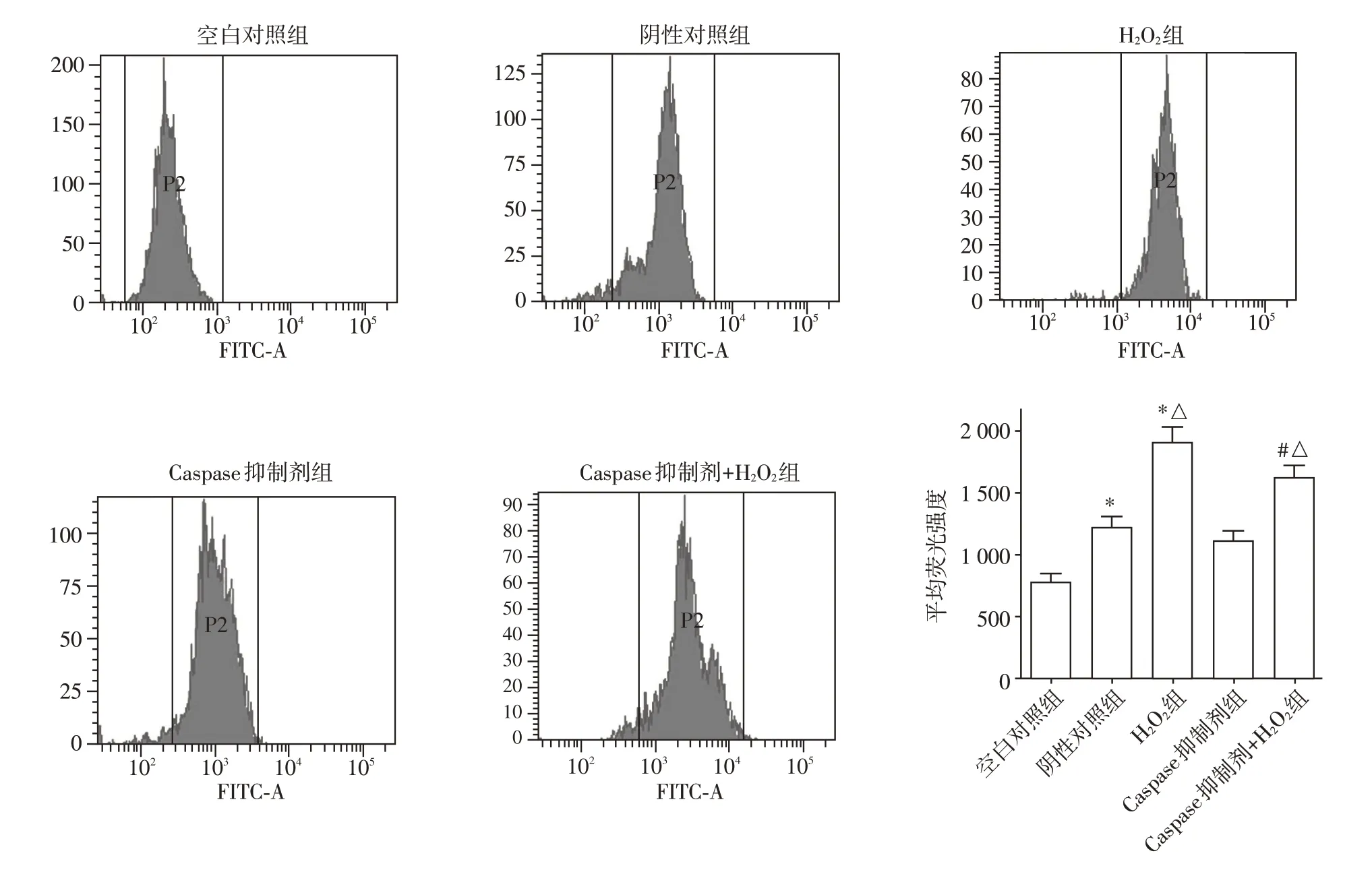
图2 各组细胞ROS水平检测Figure 2 Detection of ROS levels in each group
2.3 Caspase 抑制剂削弱氧化应激对脓毒症肾小管上皮细胞增殖的抑制作用
空白对照组、阴性对照组、H2O2组、Caspase 抑制剂组和Caspase 抑制剂+H2O2组细胞增殖率分别为(179.21±9.00)%、(153.57±7.40)%、(120.20±6.24)%、(159.21±8.25)%和(143.21±5.33)%。阴性对照组细胞增殖率低于空白对照组(P<0.05),H2O2组细胞增殖率低于阴性对照组(P<0.05),说明H2O2诱导的氧化应激能抑制脓毒症肾小管上皮细胞增殖。Caspase 抑制剂+H2O2组细胞增殖率较H2O2组升高(P<0.05),但仍低于阴性对照组(P<0.05,图3),说明Caspase 抑制剂能部分逆转氧化应激对细胞增殖的抑制效应。
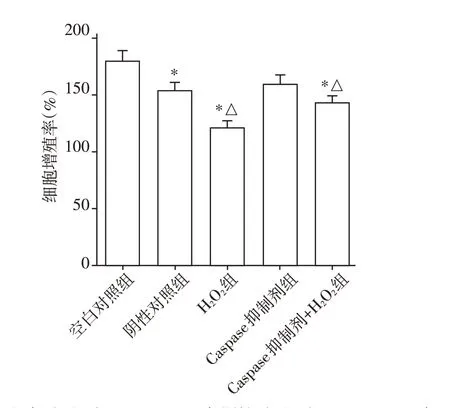
图3 各组细胞增殖水平检测Figure 3 Detection of cell proliferation in each group
2.4 Caspase 抑制剂抑制氧化应激诱导的脓毒症肾小管上皮细胞凋亡
由图4可见,空白对照组、阴性对照组、H2O2组、Caspase 抑制剂组和Caspase 抑制剂+H2O2组的细胞凋亡率分别为(3.18±0.43)%、(6.25±0.40)%、(11.75±1.61)%、(5.01±0.78)%和(9.97±0.47)%。阴性对照组细胞凋亡率较空白对照组升高(P<0.05),H2O2组细胞凋亡率较阴性对照组升高(P<0.05)。Caspase 抑制剂+H2O2组细胞凋亡率较H2O2组降低(P<0.05),仍高于阴性对照组(P<0.05)。H2O2组细胞中Cleaved-Caspase 3 和Cleaved-PARP蛋白表达较阴性对照组升高(P<0.05),Caspase抑制剂+H2O2组细胞中Cleaved-Caspase 3 和Cleaved-PARP 蛋白表达较H2O2组降低(P<0.05,图5)。结果显示,H2O2能诱导脓毒症肾小管上皮细胞凋亡,而Caspase 抑制剂能抑制H2O2诱导的细胞凋亡。
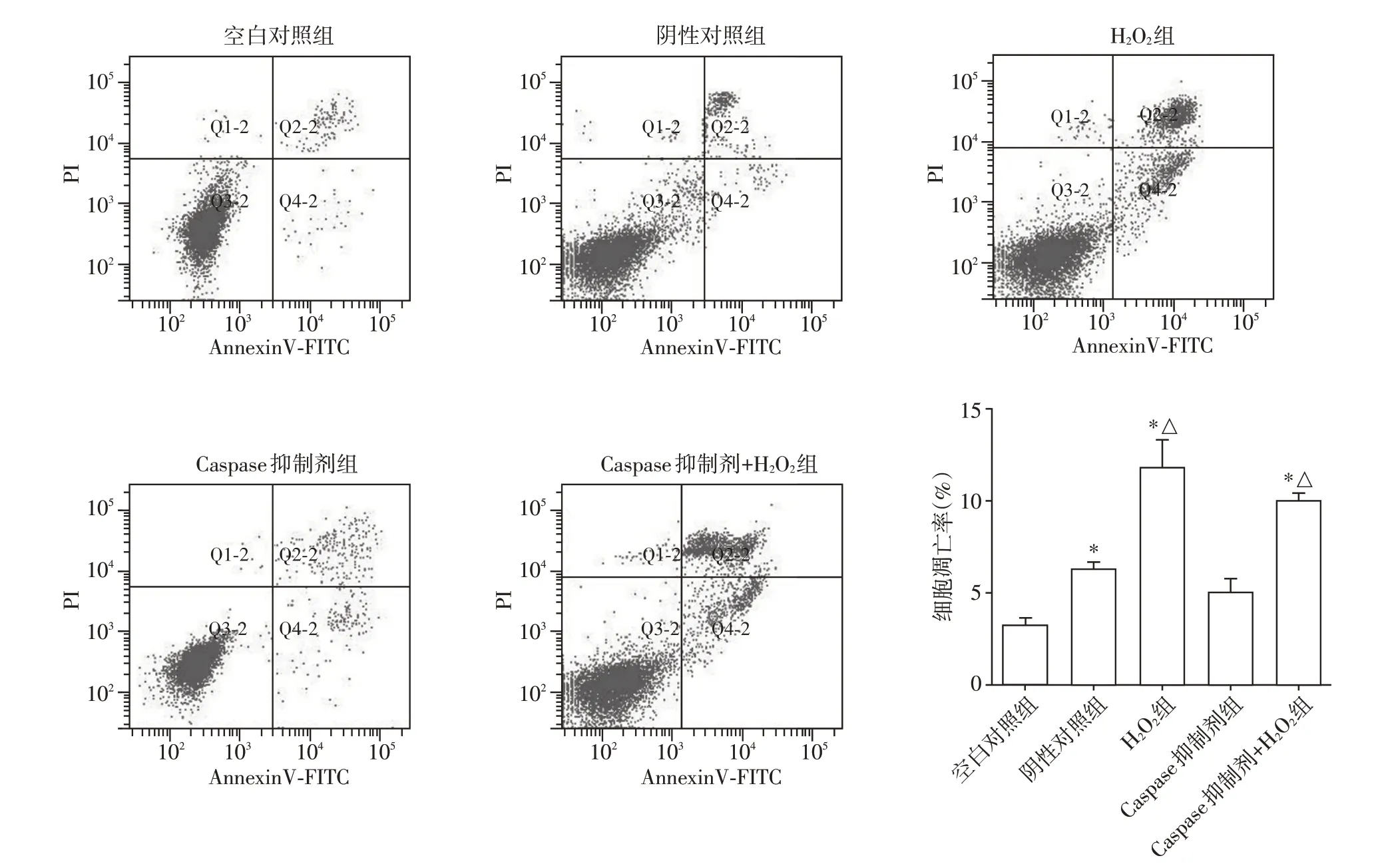
图4 各组细胞凋亡检测Figure 4 Detection of cell apoptosis in each group
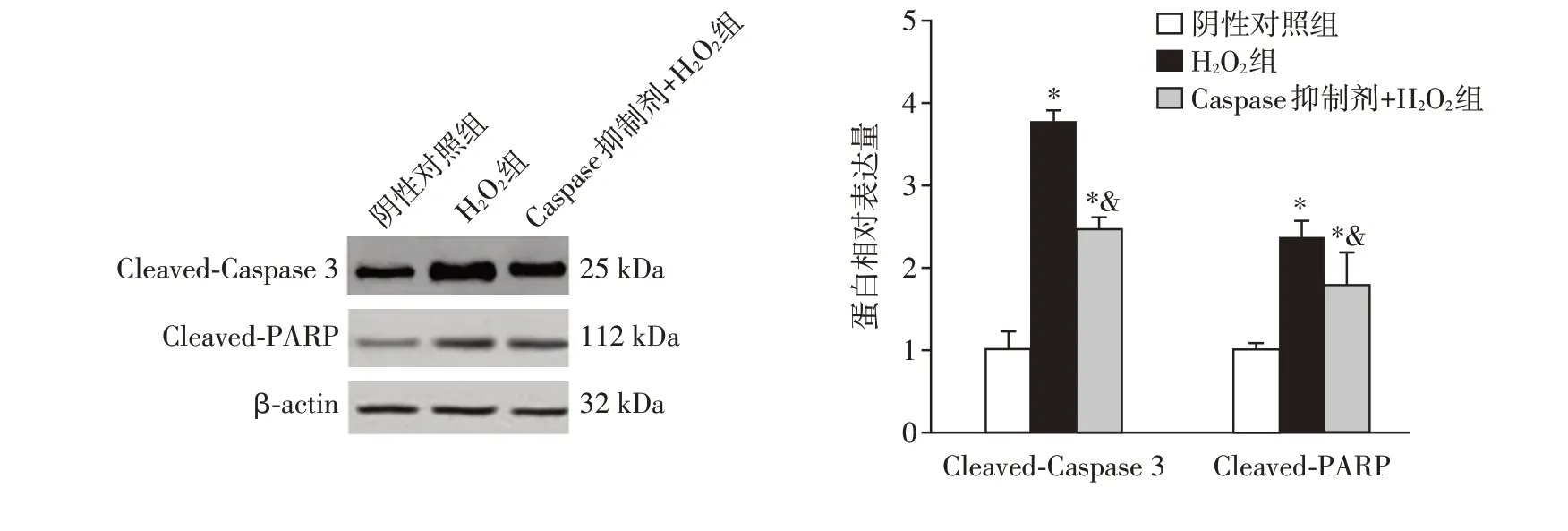
图5 各组凋亡相关蛋白的表达Figure 5 Expression of apoptosis-related proteins in each group of spesis
2.5 Caspase 抑制剂削弱氧化应激对脓毒症肾小管上皮细胞周期的阻滞
由图6 可见,空白对照组处于G1 期、G2 期和S期的细胞分别占(21.50±2.10)%、(32.63±2.76)%和(45.87±4.59)%。阴性对照组处于G1 期、G2 期和S期的细胞分别占(26.50±2.01)%、(27.63±3.34)%和(45.87±4.23)%。H2O2组处于G1 期、G2 期和S 期的细胞分别占(37.23±3.67)%、(15.39±2.10)%和(47.38±5.32)%。Caspase 抑制剂组处于G1 期、G2期和S 期的细胞分别占(28.67±3.87)%、(27.12 ±2.98)%和(44.20±5.10)%。Caspase 抑制剂+H2O2组处于G1 期、G2 期和S 期的细胞分别占(30.22±3.45)%、(21.01±3.44)%和(48.77±3.78)%。各组S期细胞比例无显著差异(P>0.05)。阴性对照组G1期细胞比例高于空白对照组(P<0.05),H2O2组细胞G1 期比例高于阴性对照组(P<0.05),说明H2O2诱导的氧化应激能引起脓毒症细胞周期紊乱,发生G1期阻滞。Caspase 抑制剂+H2O2组细胞G1 期比例低于H2O2组(P<0.05),说明Caspase 抑制剂能逆转H2O2对细胞周期G1期的阻滞作用,促进周期进展。
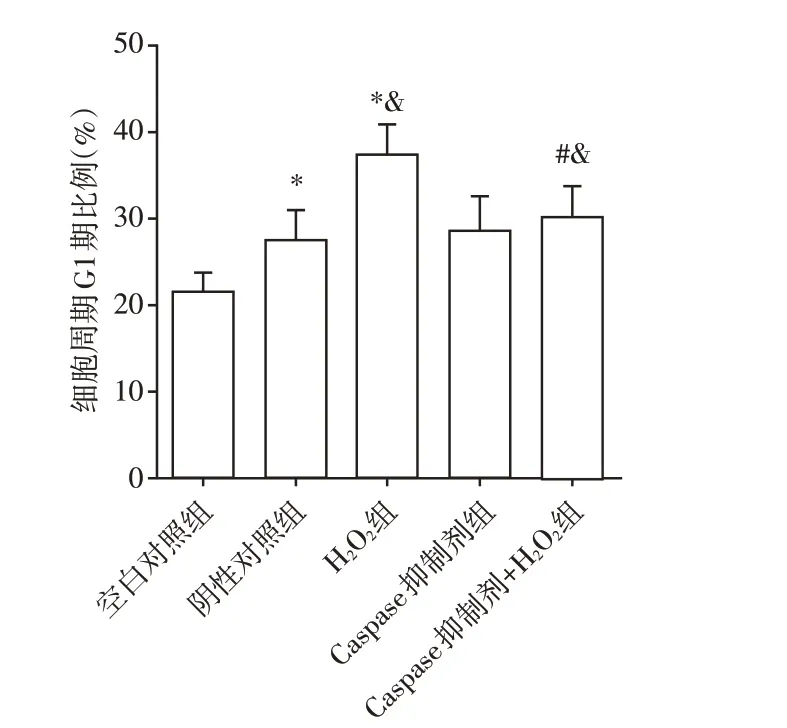
图6 各组细胞G1期比例Figure 6 Proportion of G1 phase cells in each group
3 讨论
脓毒症是宿主在应对感染时反应失调而引起的一种器官功能障碍综合征,临床上50%的脓毒症患者均有不同程度的肾损害,并且与脓毒症的2 年死亡率密切相关[10,11]。大多数脓毒症患者死于多器官衰竭,AKI是最常见的并发症之一,是脓毒症患者死亡的独立危险因素[2],寻找脓毒症急性肾损伤的特异性标志物和有效的防治策略刻不容缓。
氧化应激损伤是脓毒症组织器官损伤的重要机制,且氧化应激和脓毒症全身和局部持续性炎症反应之间存在密切关联。病原体及其释放的毒素激活炎症反应及宿主释放炎症介质会影响氧化呼吸链的偶联过程,引起线粒体损伤和功能障碍,最终导致组织、器官损伤。脓毒症大鼠肺组织超氧化物歧化酶(superoxide dismutase,SOD)活性降低,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)活性升高[12]。产生的大量iNOS 源性一氧化氮对心肌细胞也有毒性作用,能抑制心肌产生ATP,引起心肌收缩障碍,最终导致脓毒症心力衰竭[13]。氧化应激也会对肾组织造成损伤,线粒体是肾实质细胞ROS的主要产生部位[14]。生理条件下,肾实质细胞中的ROS维持在较低水平,对肾小管和肾微循环的生理调节有作用[15];脓毒症时,在各种炎症因子的刺激下,肾小管和肾血管中ROS 生成增强,同时谷胱甘肽(glutathione,GSH)等抗氧化物减少,ROS 攻击肾小管细胞导致膜损伤及线粒体超氧阴离子渗漏,随着细胞中ROS 浓度的进一步增加,最终引起脓毒症肾损伤[16]。以氧化应激损伤为靶点的治疗已经成为近年来脓毒症的研究热点。本研究发现,用LPS刺激肾小管上皮细胞后,细胞ROS水平明显较正常肾小管上皮细胞升高,提示脓毒症时肾小管细胞的氧化应激水平较生理状态异常升高。本研究用H2O2处理细胞,ROS检测显示H2O2引起了细胞更高水平的氧化应激损伤,结果显示,与未经H2O2处理的脓毒症细胞模型相比,H2O2组细胞的增殖率降低,凋亡率升高,同时发生了细胞周期的G1期阻滞。结合文献报告和本研究结果,我们更倾向于认为ROS 对脓毒症肾小管上皮细胞有抑制增殖和周期进展,诱导凋亡的作用,这与文献中以缓解氧化应激作为脓毒症肾损伤治疗的理论依据相吻合。
Caspase 是一类半胱氨酸天冬氨酸特异性蛋白酶,存在于胞质中,线粒体途径细胞凋亡的本质是Caspase 依赖的蛋白酶级联反应[17]。本研究重点关注的正是ROS 与线粒体途径的细胞凋亡。有研究发现,肿瘤细胞高表达Caspase-3/7,能破坏线粒体膜电位和上调ROS 水平,诱导细胞凋亡,ROS 抑制剂能逆转这种效应[18]。原代大鼠软骨细胞中过高水平的ROS能引起细胞色素c和Caspase-3高表达,促进细胞凋亡[19]。本研究用Caspase 抑制剂Ac-DEVD-CHO 联合H2O2处理脓毒症肾小管上皮细胞模型,结果发现,细胞ROS水平较H2O2组降低,但仍高于阴性对照组,说明H2O2诱导的氧化应激在一定程度上具有Caspase 依赖性,抑制Caspase 能部分减弱脓毒症肾小管上皮的氧化应激损伤。细胞的相关生物学行为检测显示,Caspase抑制剂联合H2O2处理的脓毒症肾小管上皮细胞增殖率较H2O2组升高,凋亡率降低,细胞周期处于G1 期的比例减少,说明氧化应激损伤对脓毒症肾小管细胞增殖、凋亡和细胞周期的作用具有Caspase 依赖性,抑制Caspase 能逆转氧化应激损伤对脓毒症肾小管细胞的抑制增殖、促进凋亡和引起细胞周期G1 期阻滞的效应。但是,Caspase 抑制剂联合H2O2处理组的细胞增殖、凋亡和G1 期细胞周期所占比例仍和阴性对照组有差异,说明抑制Caspase 只能部分影响氧化应激对脓毒症肾小管上皮的作用,提示氧化应激可能还通过其他途径对脓毒症肾小管上皮细胞造成损伤。Kaleem 等[20]研究显示Caspase 释放的功能受O2-调节,这与本研究结果相吻合。
综合以上实验结果,认为ROS造成的脓毒症肾小管上皮细胞增殖抑制、凋亡增加和细胞周期G1期阻滞效应,部分是通过线粒体-Caspase 途径实现的。通过直接降低ROS水平或阻断线粒体-Caspase凋亡途径,都能对脓毒症时肾小管上皮细胞中异常升高的氧化应激水平产生抑制作用,并通过促进细胞的增殖和周期进展,减少细胞凋亡坏死,对肾小管上皮损伤起保护作用。但是除了线粒体-Caspase途径,其他细胞凋亡通路是否也在脓毒症肾小管损伤中发挥作用,目前尚不清楚,未来还需要更多的实验进行探讨。

