利用CRISPR/Cas9技术高效构建巴马小型猪F9基因敲除细胞系
朱晓晗,刘晓蕊,李 琳,王 盈,杨海元,戴一凡
南京医科大学江苏省异种移植重点实验室,江苏 南京 211166
血友病乙(hemophilia B)是一种由缺乏凝血因子Ⅸ(factor Ⅸ,FⅨ)而引起的X 染色体隐性遗传性出血性疾病,是最常见的先天性出血性疾病之一[1]。血友病乙在男性中的发病率较高,每10万名男性中约有2.8例发生,无种族或地域差异性[2]。根据FⅨ在患者体内的含量,血友病乙被分类为轻度(>0.05~0.40 U/mL)、中度(0.01~0.05 U/mL)、重度(<0.01 U/mL)3 个等级[1,3]。FⅨ又称血浆凝血活酶,是一种维生素K 依赖性血浆蛋白酶,由肝脏合成,正常情况下在血浆中以无活性的酶原形式存在。人体内FⅪa(activated factor Ⅺ,FⅪa)及FⅦa(activated factor Ⅶ,FⅦa)通过连续切割FⅨ的p.Arg191-Ala192和p.Arg226-Val227位点,从而使FⅨ活化。随后,FⅨa(activated factor Ⅸ,FⅨa)与FⅧa(activated factor Ⅷ,FⅧa)形成FⅩ(factor Ⅹ,FⅩ)酶复合物,切割FⅩ的p.Arg182-Ser183 和p.Arg234-Ile235位点,使FⅩ活化,参与体内凝血级联反应[4]。编码FⅨ的基因F9 位于Xq27.1,全长约34 kb,由8个外显子和7 个内含子构成,该基因的突变或缺失是血友病乙发病的根本原因[5]。截至2020年2月,FⅨ变异体数据库(http://www.factorix.org/)已统计血友病乙患者F9基因突变形式有1 244种,包括点突变、插入、缺失等,分布于内含子、外显子和非编码区域,但最常见的突变发生在蛋白编码区,且以点突变为主[5-7]。
血友病乙作为一种基因病,针对其遗传发病机制、基因诊断、基因治疗的研究是当前血友病乙研究的重点,但是这些研究需要有良好的动物模型。目前经典的血友病动物模型有狗和小鼠,但两者与人类亲缘关系远、生理特性不同,不能精准地模拟人类血友病的生理特性和临床表征[8-9]。猪是除灵长动物以外与人类在进化上亲缘关系最近的物种之一,在遗传、生理生化和疾病发展等方面与人类具有极高的相似性,尤其是凝血系统与人类十分相似,因此是本次血友病乙动物模型构建的良好选择[10]。
本研究首先通过分析人和猪F9基因的同源性,以及对人和猪FⅨ二级结构及三级结构的模拟和分析,验证了人和猪FⅨ的高度同源性。其次以巴马小型猪胎儿原代成纤维细胞(porcine fetal fibroblast,PFF)为原材料,结合CRISPR/Cas9 技术,构建F9 基因第2 外显子突变的单克隆细胞系,为进一步利用体细胞核移植(somatic cell nuclear transfer,SCNT)技术构建血友病乙猪模型提供了原材料。
1 材料和方法
1.1 材料
35 d原代巴马猪胎儿成纤维细胞(PFF)由本组实验室培养。DH5α感受态细胞、质粒小提试剂盒、质粒中提试剂盒(北京天根生化科技公司);pX330质粒(Addgene 423230)、BbsⅠ限制性内切酶、T4 Ligase 连接酶(New England Biolabs 公司,美国);Basic NucleofectorTMKits 和细胞电转仪(Lonza 公司,德国);DMEM 培养液,胎牛血清、胰酶、青链霉素双抗和PBS 缓冲液(Gibco 公司,美国);引物序列和磷酸化的寡核苷酸序列由南京金斯瑞公司合成。
1.2 方法
1.2.1 人/猪F9基因同源性分析
在NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中检索包括人和猪在内的多个物种的F9基因序列,利用MEGA X 软件和在线工具iTOL(https://itol.embl.de/)绘制系统进化树。此外,搜索FⅨ的氨基酸序列,利用ClustalX2 软件进行人和猪FⅨ氨基酸序列的比对,再用DNAman 软件计算两者氨基酸序列的相似值。
1.2.2 人/猪FⅨ蛋白的结构比较
利用DNAstar软件中的protein模块分析人和猪FⅨ蛋白的二级结构,使用Chou-Fasman算法预测人和猪FⅨ蛋白α螺旋、β折叠、β转角的比例。使用Swiss Model在线工具(https://www.swissmodel.expasy.org/)对人和猪FⅨ蛋白进行三维建模,然后利用pymol 软件比较两者三维结构的相似度,得出均方根偏差(root mean square deviation,RMSD)值。
1.2.3 sgRNA的设计
依据NCBI 数据库中猪的F9 基因序列,利用在线工具Primer3 web(http://primer3.ut.ee/)设计包含第2 外显子在内的1 kb 左右基因序列的PCR 引物exon-2,上游:5′-ACCAAAGCTGCTCTCCTGACTCA-3′,下游:5′-TGCTGGCGTAAACCTAGAGT-3′,使用巴马猪PFF的基因组DNA作为模板进行扩增,反应体系:50 μL,反应条件:95 ℃5 min;95 ℃30 s,56 ℃30 s,72 ℃30 s,35个循环;72 ℃7 min;保存于4 ℃。通过琼脂糖凝胶电泳观察PCR 产物长度,并送南京擎科公司进行测序,以确认巴马猪F9基因第2外显子序列与数据库记载的符合程度。将测序获得的巴马猪F9 基因第2 外显子序列作为模板,利用CRISPR 在线靶点设计工具(http://www.e-crisp.org/E-CRISP/designcrispr.html)设计2 对25 bp 左右的sgRNA 寡核苷酸序列,分别命名为2-sgRNA1、2-sgRNA2,5′末端磷酸化修饰,交由南京金斯瑞公司合成(表1)。
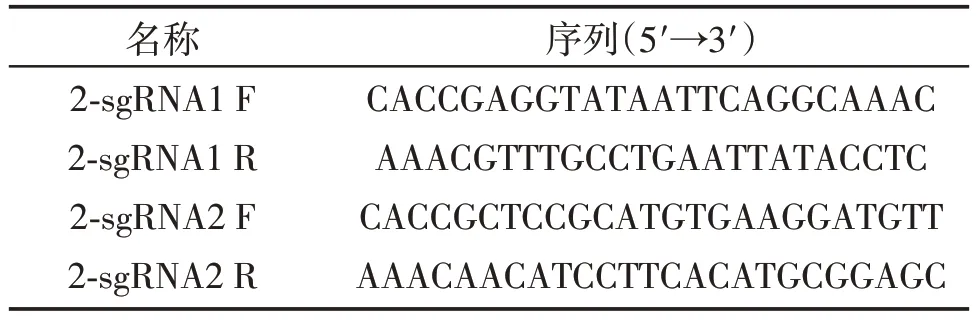
表1 F9基因靶向位点及sgRNA寡核苷酸序列Table 1 F9 gene targeting loci and sgRNA oligonucleotide sequence
1.2.4 CRISPR/Cas9打靶载体的构建
CRISPR/Cas9 打靶载体构建主要包括:引物退火、pX330载体酶切、线性化pX330载体与sgRNA连接等步骤。首先,用高压灭菌的去离子水分别将2对寡核苷酸单链稀释成100 μmol/L 浓度,然后从正链引物与负链引物中各吸取1 μL,加入8 μL去离子水中。将混合好的10 μL 体系,在PCR 仪中进行退火操作:37 ℃30 min,95 ℃5 min;结束后以每分钟降5 ℃的速度降至25 ℃保持。同时,按照说明书步骤,将pX330 载体用BbsⅠ酶进行酶切使其线性化,再分别将线性化的pX330载体与退火的双链sgRNA用T4 Ligase 连接酶进行连接。将连接产物转化至大肠杆菌DH5α中,涂板后挑取单菌落进行菌株保存和测序,根据返回的测序结果筛选包含正确打靶载体的菌株,将对应菌株扩大培养后利用无内毒素质粒中提试剂盒进行质粒提取。
1.2.5 细胞培养
原代巴马猪PFF 用16%FBS 培养约24 h,条件为37 ℃,5%CO2。接着用DPBS清洗贴壁细胞,然后使用0.05%胰酶消化约2 min,终止消化后将细胞悬液收集到15 mL 离心管,1 200 r/min 离心5 min 得到细胞沉淀。按照Lonza成纤维细胞转染试剂盒的说明书配制核转液,在核转液中加入适量打靶载体及抗性质粒(pHY54 SV40-neo),用核转染程序U 023转染。转染结束后用2~3 mL 16%FBS 培养液重悬细胞并分盘至20 个10 cm 培养皿中,使每个视野下的细胞数在50 个左右。细胞培养皿在恒温培养箱中培养,条件为37 ℃,5%CO2[11]。
1.2.6 单细胞克隆的筛选与鉴定
细胞筛选:细胞培养24 h 后,用含有G418 药物的培养液进行换液。药物筛选第9 天左右,在4 倍镜下观察到单细胞克隆,挑选状态佳的单细胞克隆,显微镜下观察其位置,并于培养皿的皿底做标记。去除皿中培养液,DPBS 清洗,在标记处放置合适大小的克隆环,用0.25%的胰酶消化约2 min,加入无药培养液中止消化,转移细胞悬液至24 孔板,孔板盖上标记克隆编号和日期。24 孔板中的细胞隔日用含G418 的培养液进行换液,直至细胞长满皿底,胰酶消化并传代至12 孔板(遗留部分细胞在原皿),待12 孔板中的细胞长满后,即可冻存备用;遗留在24 孔板中的细胞,加入培养液继续培养,长满皿底后提取基因组DNA,用于鉴定单细胞克隆基因型[12]。
单细胞克隆基因型的鉴定:用0.25%的胰蛋白酶消化24孔板里的细胞,用NP40裂解液裂解细胞,提取基因组DNA,用引物exon-2 进行PCR,反应体系50 μL,反应条件:95 ℃5 min;95 ℃30 s,56 ℃30 s,72 ℃30 s,35 个循环;72 ℃7 min;保存于4 ℃。通过琼脂糖凝胶电泳观察PCR 产物长度,并将PCR 产物送南京擎科公司进行测序。测序结果返回后与野生型序列进行对比,得出每个单细胞克隆的基因型;根据结果去除12 孔板中的阴性号,保留阳性号,并进行冻存。
2 结果
2.1 人/猪F9基因同源性分析
利用MEGA X软件和在线工具iTOL绘制系统发育树,结果表明人和猪F9基因遗传距离较近(图1);利用ClustalX2软件对人与猪FⅨ的氨基酸序列进行比对,结果显示两者FⅨ氨基酸序列高度一致(图2);接着用DNAman 软件计算人与猪FⅨ氨基酸序列的相似值,结果为83.33%。以上结果表明人和猪FⅨ氨基酸序列具有很高的同源性。
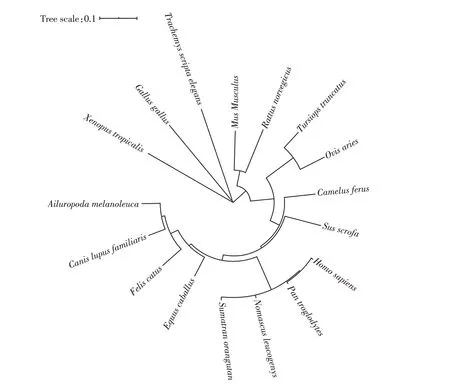
图1 不同物种F9基因系统进化树Figure 1 Phylogenetic tree of F9 genes in different species

图2 人/猪FⅨ蛋白氨基酸序列的同源性分析Figure 2 Homology analysis of amino acid sequence between human/pig FⅨprotein
2.2 人/猪FⅨ结构的比较
利用DNAstar软件中的protein模块分析人和猪FⅨ的二级结构,并使用Chou-Fasman 算法预测人和猪FⅨ的α螺旋、β折叠、β转角比例,结果显示,人的FⅨα螺旋占26.9%,β折叠占35.8%,β转角占33.8%(图3A);猪的FⅨα螺旋占21.2%,β折叠占32.9%,β转角占35.5%(图3B)。由此可见,人和猪FⅨ具有相似的二级结构。使用Swiss Model 在线工具对人和猪FⅨ进行三维建模,接着利用pymol软件比较两者三维结构的相似度,得出RMSD 值为0.149,表明两者在三维结构上亦具有极高的相似性(图3C)。以上结果表明,人/猪FⅨ具有高度一致的同源性,因此可以推测人/猪FⅨ在对应的组织内具有相似的生理功能。

图3 人/猪FⅨ蛋白质二级结构和三级结构分析Figure 3 Analysis of FⅨprotein secondary and three-dimensional structures between human and pig
2.3 F9基因CRISPR/Cas9靶向载体的构建
依据巴马猪F9基因第2外显子序列,利用在线工具设计2对sgRNA寡核苷酸序列(图4A),退火形成双链后分别与线性化pX330 载体连接(图4B)。将连接产物转化至大肠杆菌DH5α中,涂板后挑取单菌落进行摇菌,抽提质粒并送测序,测序结果(图4C、D)表明sgRNA均已成功连接至pX330上。

图4 F9基因靶点和重组载体测序Figure 4 Targets of F9 gene and sequencing of recombinant vectors
2.4 单细胞克隆的获得和鉴定
野生巴马猪胚胎成纤维细胞转染pX330-sgRNA 和抗性质粒pHY54 SV40-neo 后,经过G418筛选,最终得到单细胞克隆共55 个(表2),其中有25个单细胞克隆发生基因突变,敲除率为45.5%;选用敲除号中状态较好的单细胞克隆进行冻存。

表2 F9敲除单细胞克隆基因型Table 2 Genotypes of F9 knockout single cell clones
3 讨论
血友病乙是一种与X 染色体连锁有关的隐性遗传性凝血功能障碍,主要因F9 基因改变致血浆FⅨ活性缺乏[7]。大多数患者表现为自发性或轻微创伤后出血不止,以及长期反复出血导致的关节畸形和躯体残疾等。中国血友病患病率为3.6/10 万,其中,血友病乙所占比例为16.13%[13]。由于中国人口基数大,新增人口多,血友病乙仍是影响众多家庭的遗传疾病之一。目前血友病的治疗方式包括输注凝血因子制品、药物辅助治疗及正处于探索阶段的基因治疗术。疾病动物模型是研究血友病致病机制和治疗策略的重要工具。因此,建立一个与人类血友病乙生物特性和临床表征相近的动物模型显得尤为重要[14-15]。
第1例血友病乙动物模型形成于二十世纪八十年代,美国Chapel Hill 鉴定出患有血友病乙的狗,其发病机制及临床病理表现与人类血友病乙极为相似。二十世纪末,Monahan 等[16]提出将其用于血友病治疗的临床前动物试验。基因工程技术推动了血友病乙动物模型的研究和应用。1997 年,Lin等[17]利用胚胎干细胞基因打靶的方式获得第一例血友病乙小鼠模型。二十一世纪以来,基因编辑技术飞速发展,基于DNA 双链断裂(double-strand break,DSB)激活细胞内部修复机制的工程化核酸酶基因编辑技术逐渐成为基因编辑技术的主流。2013年,Cong等[18]利用规律成簇的间隔短回文重复序列相关核酸酶(CRISPR/Cas9)技术在鼠和人类细胞中实现了基因编辑,开启了基因编辑技术新篇章。此后,利用CRISPR/Cas9 技术构建的血友病动物模型,尤其是多种小鼠血友病模型得到了极大的发展,为研究血友病提供了便利。
然而,小鼠与人类之间存在明显的物种差异,并非构建血友病动物模型的最佳选择,深入研究血友病亟需一个与人类生理、病理情况更为相似的动物模型。猪在遗传背景、生理特点及疾病发生发展等方面具有小鼠无法比拟的优势,且猪的凝血系统与人类极为相似,更符合血液病动物模型的需求。本研究通过分析人和猪F9的遗传距离,以及对人和猪FⅨ氨基酸序列、蛋白质二级结构及三级结构的模拟与分析,揭示了人与猪FⅨ的高度同源性。因此,猪是构建血友病乙动物模型的良好选择。此外,本课题组利用CRISPR/Cas9技术结合体细胞核移植技术成功构建了多个猪模型。2015 年Chen 等[19]构建的3 只B 细胞缺陷仔猪;2018 年Zhang 等[12]构建的GGTA1、CMAH 和β4GalNT2 三基因敲除猪;2019年Yao 等[20]构建的听力缺陷猪。以上成果表明了CRISPR/Cas9 技术在构建基因修饰猪方面的可行性和便捷性。本研究利用2 个sgRNA 对巴马小型猪的胎儿成纤维细胞的F9 基因进行打靶。CRISPR/Cas9 表达质粒转染细胞后经过药物筛选,获得55 个单细胞克隆。基因型分析显示其中有25 个单细胞克隆在靶点处发生了基因突变[(包含15个大片段缺失(>100 bp),8个小片段缺失(<100 bp),5个碱基的插入,4 个碱基的突变],敲除效率高达45.5%。本研究结果显示在进行基因敲除时,在靶点处使用2个sgRNA是较为理想的选择。
综上,本研究通过高效的CRISPR/Cas9 打靶载体成功获得了巴马小型猪F9基因敲除细胞系,为接下来构建血友病乙巴马小型猪模型提供了重要的原材料。

