一种快速分离苹果果肉单细胞的方法
邢文曦 王永章 刘成连
摘要:单细胞是生物体的基本单位,提取具有活性的单细胞是研究果实发育的基础。以苹果为材料,研究不同酶液组合和酶解时间对苹果果肉单细胞分离的影响。结果表明,苹果果肉在01%离析酶、暗酶解05 h时,为理想的苹果果肉单细胞分离条件。
关键词:苹果;单细胞;离析酶;酶解浓度;酶解时间
中图分类号: S661101文献标志码:
文章编号:1002-1302(2017)16-0138-02
[HJ14mm]
收稿日期:2016-03-29
基金项目:山东省现代农业产业技术体系项目。
作者简介:邢文曦(1990—),女,山西朔州人,硕士研究生,主要从事果树栽培与生理等研究。E-mail:kaoyanxixi@163com。
通信作者:刘成连,教授,研究方向为果树栽培生理与分子生物学。E-mail:fmdb@qaueducn。
单个活体细胞是生物生命活动的基本单元和进化的基本单位,对单个活体细胞的识别、分选及分析,能够解析生命体系最深层次的异质性和运作机制。同时,因其不依赖细胞的培养和扩增,单细胞技术在生物发育、生物能源、气候变化、疾病诊断、食品安全、农业生态等领域具有广阔的应用前景。分离植物精细胞用于离体培养,可以为通过离体有性繁殖途径进行植物品种改良打下基础;分离保卫细胞原生质体,使研究保卫细胞本身的生理生化特性及其与气孔功能的关系成为可能;分离维管束组织和韧皮部组织细胞,可以进行组织特异表达基因的鉴定。利用棉纤维单细胞研究细胞壁和纤维素的形成过程,能帮助人们更好地提高棉纤维的质量。目前,研究基因表达都是一群细胞的基因表达,这种表达实际上是每个细胞特异表达的平均情况,但是单个细胞的基因表达分析能够提供隐藏在群体细胞中单个细胞发育的新机制[3-4]。细胞膜上有各种离子通道,如钙离子通道、钾离子通道及钠离子通道等,这些通道调节离子进出,利用膜片钳技术可研究单个细胞离子通道的特性等,从而深入地研究生物体信号传导、细胞渗透压、细胞营养及抗逆性等各种生理机制。Li等利用膜片钳等技术,发现了控制钾离子通道的流向转换机制,揭开了使同一离子通道的离子流向发生逆转的关键因素[5]。果实的发育过程就是果肉细胞发育的过程,决定着果实的硬度、甜度、营养物质含量等,与果实贮藏时间长短、病害发生等都有关系,因此研究分离活性果肉单细胞是研究果实发育的基础;但是目前还没有果树类果肉细胞分离的相关报道,本研究以苹果为材料,研究果肉细胞的提取方法。
1材料与方法
11材料
从青岛农业大学教学实习基地,取成熟富士苹果,贮藏于4 ℃备用。
12器材与试剂
荧光显微镜 (LEICA,DM2500,德国)、匀浆机、低速离心机、恒温摇床、磁力搅拌器等。
13试验方法
131单细胞分离
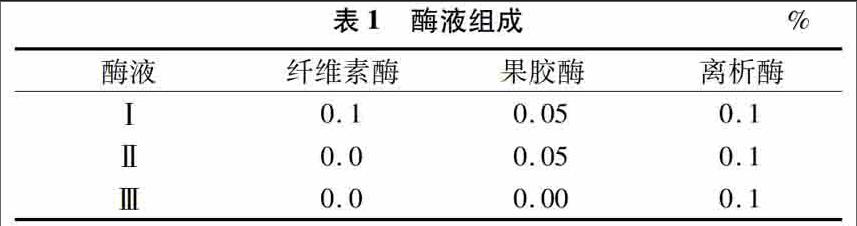
配制细胞和原生质体洗涤溶液(cell and potoplast wash solution,简称CPW):101000 mg/L KNO3,27200 mg/L KH2PO4,246000 mg/L MgSO4·7H2O,1 480000 mg/L CaCl2·2H2O,0160 mg/L KI,0025 mg/L CuSO4·5H2O,0400 mol/L 甘露醇,4 ℃低溫保存备用。纤维素酶、果胶酶、离析酶溶于CPW溶液中,酶液见表1。
将苹果表皮以下的果肉用手术刀切成边长05 cm 的小方块,再徒手切成薄片。将切好的苹果薄片分别置于50 mL的Ⅰ、Ⅱ、Ⅲ酶液中(酶液的组成见表1),于70 r/min摇床中振荡酶解05 、10、20 h(27 ℃,黑暗条件)。静置后,用CPW溶液清洗3次,以洗去酶液,再移到50 mL烧杯中,在磁力搅拌器上搅拌1 h后,在显微镜上检测,比较各个酶液在不同处理时间下获取单细胞的结果。
132采用VBL检测细胞壁完整性
采用黄祥辉等的方法,配制VBL[4,4′-bis(4-anilino-6-hydroxyethyl-amine-S-triazin-2-ylamino)-2,2′-stilbene disulfonic acid]细胞壁染色液。先配制05 mol/L甘露醇,调节pH值为70 (Tris)。再用甘露醇溶液配制VBL,使VBL终浓度为01%。避光,4 ℃保存备用。
染色步骤:(1)吸取1 mL细胞悬浮液到15 mL离心管中,吸取10 μL,滴加于载玻片上,在显微镜下观察。(2)吸取400 μL细胞悬浮液至新的离心管中,加20 μL 上述01% VBL,避光,染色5 min。(3)染色后,用CPW溶液重复漂洗3次,以除去背景中的荧光。(4)漂洗后,悬浮于CPW溶液中,避光,荧光显微镜下观察。VBL的激发波长为345 nm,发射波长为430 nm。
133FDA检测细胞活性
FDA是一种非荧光化合物,渗入活细胞后才释放出荧光素,在蓝色光激发下显示出绿色荧光[8]。
配制5 mL 浓度为5 mg/L的FDA:先配065 mol/L甘露醇,再称取25 mg双醋酸荧光素FDA,溶于1 mL丙酮中,完全溶解之后,加入上述甘露醇溶液4 mL,避光,4 ℃ 保存。取细胞悬浮液05 mL于15 mL离心管中,加入FDA染色液,使其终浓度为001%,室温下静置5 min,荧光显微镜下观察,FDA的最大激发波长为493 nm,发射波长为510 nm。发绿色荧光的为活细胞,不发荧光的为死细胞。
2结果与分析
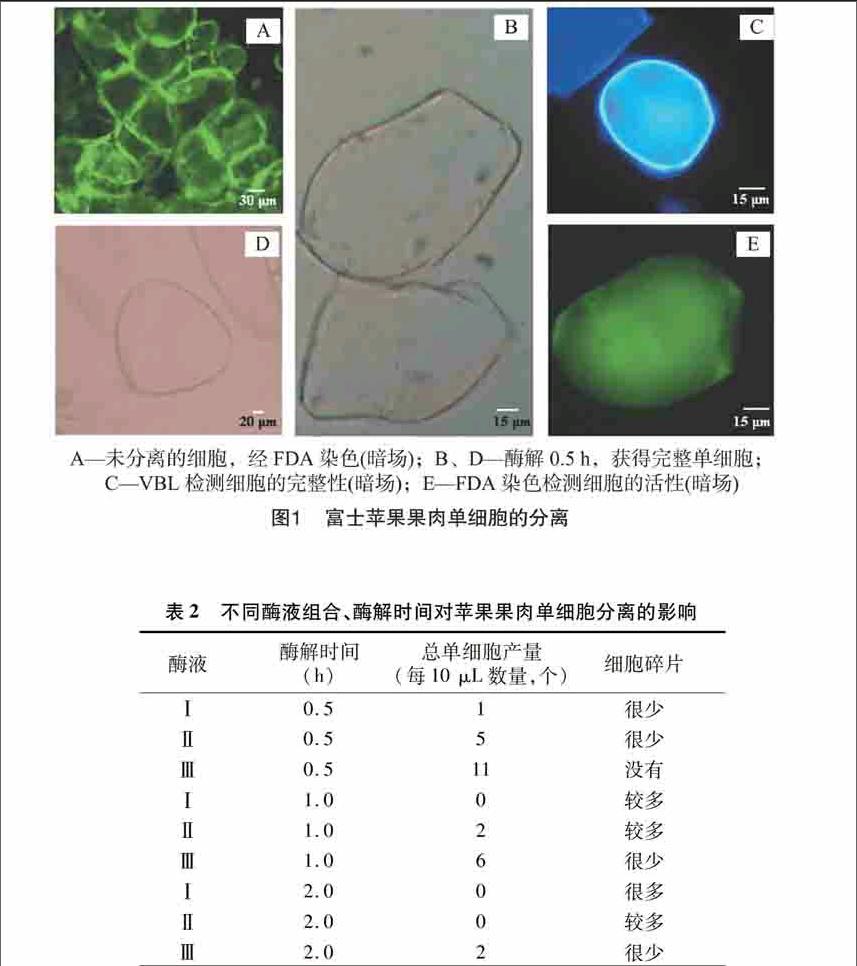
分离苹果果肉单细胞过程中,在没有酶的情况下,不能分离出果肉单细胞,用FDA染色液染色,能够看到堆叠的有活性的细胞群(图1-A)。当酶液中含有01%纤维素酶或 005%果胶酶时,获得单细胞少,有碎片存在,如表2中酶液Ⅰ、酶液Ⅱ;但当酶液中只含有01%离析酶时,处理时间为05 h时,单细胞产量多且完整(图1-B、1-D),当处理时间为10、20 h时,虽有较多的单细胞,但有碎片存在,因此,酶液Ⅲ是分离果肉单细胞的最佳酶液,适宜酶解时间为05 h(表2)。
VBL与植物细胞壁中的纤维素有强烈的亲和力,在紫外光下产生荧光,利用这个特性,常被用于检测细胞的完整性。离析酶分离得到的苹果果肉单细胞经VBL染色后,细胞周围有明显的荧光(图1-C),这说明经离析酶处理果肉可以获得完整的果肉单细胞。FDA常用动植物细胞生活力的鉴定染料,当活细胞具有完整细胞膜时,细胞内的FDA经水解产生的荧光素在胞内积累,在蓝光下产生绿色荧光,而死细胞的细胞膜失去了选择透性,荧光素无法在胞内积累,不产生荧光[8]。分离得到的单细胞经FDA染色5 min后,细胞内充满了荧光物质(图1-E),这表明分离得到的果肉单细胞具有活性。
3结论与讨论
单细胞水平研究越来越受到关注,已被广泛应用于单细胞PCR扩增、基因测序及细胞工程研究等,因此分离单细胞是生理和分子研究的基础。据笔者所知,目前分离植物单细胞以酶解法为主,即采用纤维素酶、果膠酶等破坏植物细胞壁,使细胞相互分离,从而分离出单细胞或者原生质体。张宁等应用酶解法分离马铃薯的叶片单细胞,发现果胶酶是细胞分离的关键酶,但只是统计了细胞的分离率,酶解时间比本研究的酶解时间长,最少为4 h,酶解时间太长会破坏细胞的完整性和活性[9]。目前还有很多研究都直接提取了原生质体,而使细胞壁破裂。陈颖等用纤维素酶酶解拟南芥叶肉细胞,获取了叶肉细胞的原生质体[10]。陈爱萍等用纤维素酶、果胶酶、离析酶提取了红豆草的原生质体[11]。
纤维素酶和果胶酶能够促进细胞壁的降解,在笔者的研究中,为了保护细胞壁,只采用10%离析酶进行酶解,从而获得有完整细胞壁的单细胞。细胞壁的功能,细胞极性的形成,植物激素的定向运输,细胞骨架的极性变化,小泡的定向分布和运输等一系列细胞发育事件都是彼此相连的。植物细胞壁在细胞生长发育中起着至关重要的作用,是细胞外围的一层壁,有保护细胞的作用[12]。除此之外,细胞壁还参与了植物生长、细胞分化、细胞识别、抗病反应等一系列代谢活动。细胞极性是生物体的基本属性,在多细胞生物里同时也控制细胞间的信息交换、模式生成、身份识别。因此获取有细胞壁的单细胞对研究细胞的生理生化具有重要意义,也是在细胞水平研究苹果生长发育的基础。纤维素酶和果胶酶可以分解植物细胞壁,所以在本研究中,为了避免细胞壁的降解,只用了离析酶分离果肉细胞,通过VBL检测,获得了有完整细胞壁的果肉单细胞。Mcatee等把苹果、梨等果实的果肉,一边加热煮沸,一边通过磁力搅拌器搅拌05 h,直至看到果肉单细胞才停止加热,但是获得的单细胞已经失去活性,只能用于检测果肉细胞的大小和形状[14]。而本研究分离得到的果肉细胞经VBL染色,能看到完整的细胞壁,经过FDA染色,单细胞具有明显的活性。酶解处理的原则是利用尽可能低的酶浓度和尽可能短的酶解时间获得大量且有活力的原生质体[15]。本研究只用了01%离析酶,而且酶解时间只有05 h,低于酶解获取原生质体的时间[16-17]。
总之,采用01%离析酶酶解苹果果肉,再搅拌30 min,能得到细胞壁完整且具有活性的果肉单细胞。
参考文献:
Beijnum J R V,Mat R,Karolien C,et al Isolation of endothelial cells from fresh tissues[J] Nature Protocol,2008,3(6):1085-1091
Candace H H,Lissete B,Michael R Cotton fiber:a powerful single-cell model for cell wall and cellulose research[J] Frontiers in Plant Science,2012,3(4):279-286
[3]Narsinh K H,Ning S,Veronica S F,et al Single cell transcriptional profiling reveals heterogeneity of human induced pluripotent stem cells[J] Journal of Clinical Investigation,2011,121(3):1217-1221
[4]Bloch D,Yalovsky S Cell polarity signaling[J] Current Opinion in Plant Biology,2013,16(6):734-742
[5]Li L G,Liu K,Hu Y Single mutations convert an outward K+ channel into an inward K+ channel[J] Proceedings of the National Academy of Sciences of the United States of America,2008,105(8):2871-2876
[6]张宁,李威,顾钊宇,等 ‘富士苹果花粉原生质体分离初探[J] 园艺学报,2015,42(6):1167-1174
[7]黄祥辉,颜季琼 应用荧光增白剂 VBL 研究原生质体细胞壁的再生[J] 植物生理学报,1980,6(2):207-211
[8]张先杰,李铎,孙海晨,等 台盼蓝染色与FDA/PI双染色对检测肝细胞活率的评价[J] 首都医科大学学报,2000,21(3):258-258
[9]张宁,司怀军,王蒂 马铃薯单细胞分离技术的研究[J] 中国马铃薯,2004,18(4):193-197
[10]陈颖,贾艳菊,张翠茹 拟南芥叶肉细胞原生质体分离及影响因素[J] 河北大学学报(自然科学版),2008,28(4):423-426
[11]陳爱萍,罗玉鹏,姜婷娜,等 不同酶液组合及酶解时间对普通红豆草原生质体游离的影响[J] 新疆农业大学学报,2008,31(2):29-32
[12]Caffall K,Mohnen D The structure,function,and biosynthesis of plant cell wall pectic polysaccharides[J] Carbohydrate Research,2009,344(14):1879-1900
[13]Cosgrove D Growth of the plant cell wall[J] Nature Reviews Molecular Cell Biology,2005,6(11):850-861
[14]Mcatee P A,Hallett I C,Johnston J W,et al A rapid method of fruit cell isolation for cell size and shape measurements[J] Plant Methods,2009,5(1):157
[15]Burton R A,Fincher G B Plant cell wall engineering:applications in biofuel production and improved human health[J] Current Opinion in Biotechnology,2014,26(7):79-84
[16]Mazarei M,Alahmad H,Rudis M Protoplast isolation and transient gene expression in switchgrass,Panicum virgatum L[J] Biotechnology Journal,2008,3(3):354-359
[17]Zhai Z,Jung H I,Vatamaniuk O K Isolation of protoplasts from tissues of 14-day-old seedlings of Arabidopsis thaliana[J] Journal of Visualized Experiments,2009,30(30):1149-1159

