拟南芥表皮细胞发育关键调控因子GL2的原核表达及多克隆抗体制备
刘静文 张翔 齐亚飞

摘要:拟南芥HD-ZIP家族转录因子GLABRA2(GL2)是控制植物表皮毛、根毛分化和发育的关键调控因子。为了深入研究GL2调控植物表皮细胞分化发育的分子机制,对GL2蛋白进行了生物信息学分析,选择其保守性较低的C端区域(597~776 aa)作为抗原区,构建了pET28a/GL2原核表达系统。通过异丙基-β-D-硫代半乳糖苷诱导获得了融合蛋白rGL2597~776,分子量约为196 ku。利用纯化得到的融合蛋白免疫家兔,获得了抗GL2的多克隆抗体,并利用抗原亲和纯化了GL2多克隆抗体。GL2多克隆抗体的制备及纯化为进一步通过染色体免疫共沉淀等方法筛选和鉴定其下游作用靶基因奠定了基础。
关键词:表皮毛;根毛;GL2转录因子;抗体制备;原核表达
中图分类号: Q786文献标志码:
文章编号:1002-1302(2017)16-0029-04
收稿日期:2016-04-08
基金项目:国家自然科学基金(编号:31470290);中央高校基本科研业务费(编号:2014YB036、Z109021537)。
作者简介:刘静文(1990—),女,新疆塔城人,硕士研究生,主要从事拟南芥表皮毛分化发育调控机理研究。E-mail:ljw0993@163com。
通讯作者:安丽君,博士,副教授,主要从事植物分子遗传与发育生物学研究。E-mail:lijunan@nwsuafeducn。
植物表皮毛和根毛是由表皮细胞向外延伸形成的特殊结构,它们不仅是研究植物细胞分化发育的优良模式系统,而且在帮助植物抵御生物和非生物逆境胁迫中发挥着重要作用,因而具有重要的科研价值和实用意义[1-2]。植物表皮毛和根毛的发育受机体本身遗传因素以及激素水平、水分、光照等环境因素的共同影响[3]。GL2是最早被发现的控制拟南芥表皮毛和根毛分化发育的关键调控因子之一,是表皮毛细胞正常发育所必需的调控因子之一[4-5]。GL2[编码1个含有 HD-ZIP 结构域的转录因子,其T-DNA插入功能缺失突变体 gl2-3[WTBZ][STBZ]表现为表皮毛严重发育受阻,叶片表面光滑无毛,只在叶片的边缘有极少的单根毛和毛状突起,而根毛数量增多,根毛长度增加[4]。在叶片发育的早期,[GL2基因在整个叶片中表达,而随着叶片的成熟,只在表皮毛细胞及其支持细胞中表达;在根中,在非根毛细胞中特异性表达,参与根毛和非根毛细胞命运的决定[6-7]。
目前,GL2[WTB调控植物表皮细胞分化发育的上游途径已经比较明确,GL1-GL3/EGL3-TTG1转录复合体能够激活基因的表达,并且以剂量依赖的方式调控细胞发育过程[8-9]。但是对于下游的调控路径尚不清楚,GL2作为转录因子可能通过调控下游靶基因的表达来影响细胞的分化发育。GL2特异性的多克隆抗体能够广泛应用于检测GL2蛋白表达量和染色体免疫共沉淀等试验中,在基因组范围内筛选受GL2调节的基因及GL2下游直接作用靶基因,为深入探讨GL2参与的表皮细胞分化发育调控网络奠定基础。
1材料与方法
11试验材料
111供试材料
拟南芥ColumbiaCol-0生态型野生型种子,由笔者所在实验室保存;试验用家兔,由西北农林科技大学动物饲养场提供,选取3只健康成年家兔用于试验。
112载体、菌株和试剂
原核表达载体pET28a及大肠杆菌Top10和BL21()感受态细胞,由笔者所以实验室保存;试验中所用限制性内切酶、Taq DNA聚合酶、T4连接酶、牛小肠碱性磷酸酶、反转录酶等,均购自宝生物工程(大连)有限公司;弗氏完全佐剂与不完全佐剂、蛋白免疫印迹化学发光试剂盒及HRP标记的羊抗兔抗体IgG,购自Bio-Rad公司;His标签蛋白纯化柱填料Ni Sepharose 6 Fast Flow、硝酸纤维素膜(045 μm),均购自GE Healthcare Life Science;6×His抗体,购自Abcam公司。
12试验方法
121表达序列的选取及载体构建
对基因及其推测的氨基酸序列进行分析,选取基因3′端长度为 865 bp 的片段进行PCR扩增,作为抗体制备的目的片段。取2周龄拟南芥野生型全部地上组织,提取总RNA,反转录获得cDNA,以cDNA为模板分别用带有NcoⅠ和XhoⅠ酶切位点的3对引物(GL2F1/R1、GL2F2/R2、GL2F3/R3)对选取的序列进行PCR扩增,得到的扩增片段与pET28a载体进行连接并转化大肠杆菌Top10[JP3]感受态细胞,将鉴定获得的阳性重组质粒进行测序。PCR扩增所用引物序列如表1所示。[JP]
122重组蛋白的表达与纯化
将测序正确的重组质粒转化大肠杆菌BL21(菌株,获得单克隆后将其接种于含有卡那霉素的LB培养基中,37 ℃、220 r/min培养至对数生长期,加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为10 mmol/mL,37 ℃诱导表达4 h;然后离心收集菌体并
进行超声破碎,12 000 r/min离心30 min,利用十二烷基硫酸钠聚丙烯酰胺凝膠电泳(SDS-PAGE)检测上清液及沉淀中蛋白的表达情况和存在形式,以诱导前的菌液为对照组。选择表达量较高的重组蛋白进行免疫印迹试验,对比免疫信号最终确定出最优重组蛋白作为免疫抗原进行进一步纯化[10-11]。对确定的最优重组蛋白进行大量诱导表达,用Ni Sepharose 6 Fast Flow亲和柱纯化融合蛋白,最后以梯度浓度的牛血清白蛋白为对照,进行SDS-PAGE电泳,通过Image Lab软件灰度分析对目的蛋白浓度进行定量[12]。
123多克隆抗体的制备endprint
以纯化获得的rGL2597~776重组蛋白免疫家兔,抗原量为200 μg/只,初次免疫将抗原与弗氏完全佐剂按体积比1 ∶[KG-3]1混合,背部脊柱两侧进行皮下多点注射。第一次免疫后每隔2周加强免疫1次,共免疫4次。加强免疫用弗氏不完全佐剂,抗原量为100 μg/只。最后一次免疫 7 d 后抽取家兔心头血约40 mL,将血液于37 ℃放置1 h后取出再置于4 ℃过夜。收集析出的血清,1 000 r/min离心 10 min 收集上清液即为免疫获得的抗血清[13-14]。
124多克隆抗体的特异性检测
将作为抗原的重组蛋白按1 ∶[KG-3]10 000、1 ∶[KG-3]1 000、1 ∶[KG-3]100稀释后进行SDS-PAGE电泳,将免疫获得的血清按1 ∶[KG-3]1 000的比例作为一抗加入进行免疫印迹杂交,通过化学发光显色系统检测目标位置的杂交信号,根据信号强弱计算抗体效价[15]。
125GL2多克隆抗体的纯化
为了获得纯化的Anti-GL2抗体,降低免疫印迹试验中背景噪点的影响,利用抗原-抗体的特异性对得到的抗血清进行纯化。取约1 mg的抗原进行SDS-PAGE并转膜使其结合于硝酸纤维素膜上;将抗原结合区域的膜经100 mmol/mL酸性甘氨酸/盐酸溶液(pH值为25)洗脱后封闭处理1 h;将处理后的膜装入含有一抗(GL2抗血清)的离心管中,室温孵育2~3 h后转入4 ℃振荡孵育过夜;洗膜后加入甘氨酸溶液,室温孵育10 min,收集孵育体系中的甘氨酸溶液用1 mol/L Tris溶[JP3]液(pH值为80)调节pH值为70,获得的甘氨酸溶液即为纯化的 Anti-GL2抗体。[JP]
2结果与分析
21序列分析及表达序列的选取
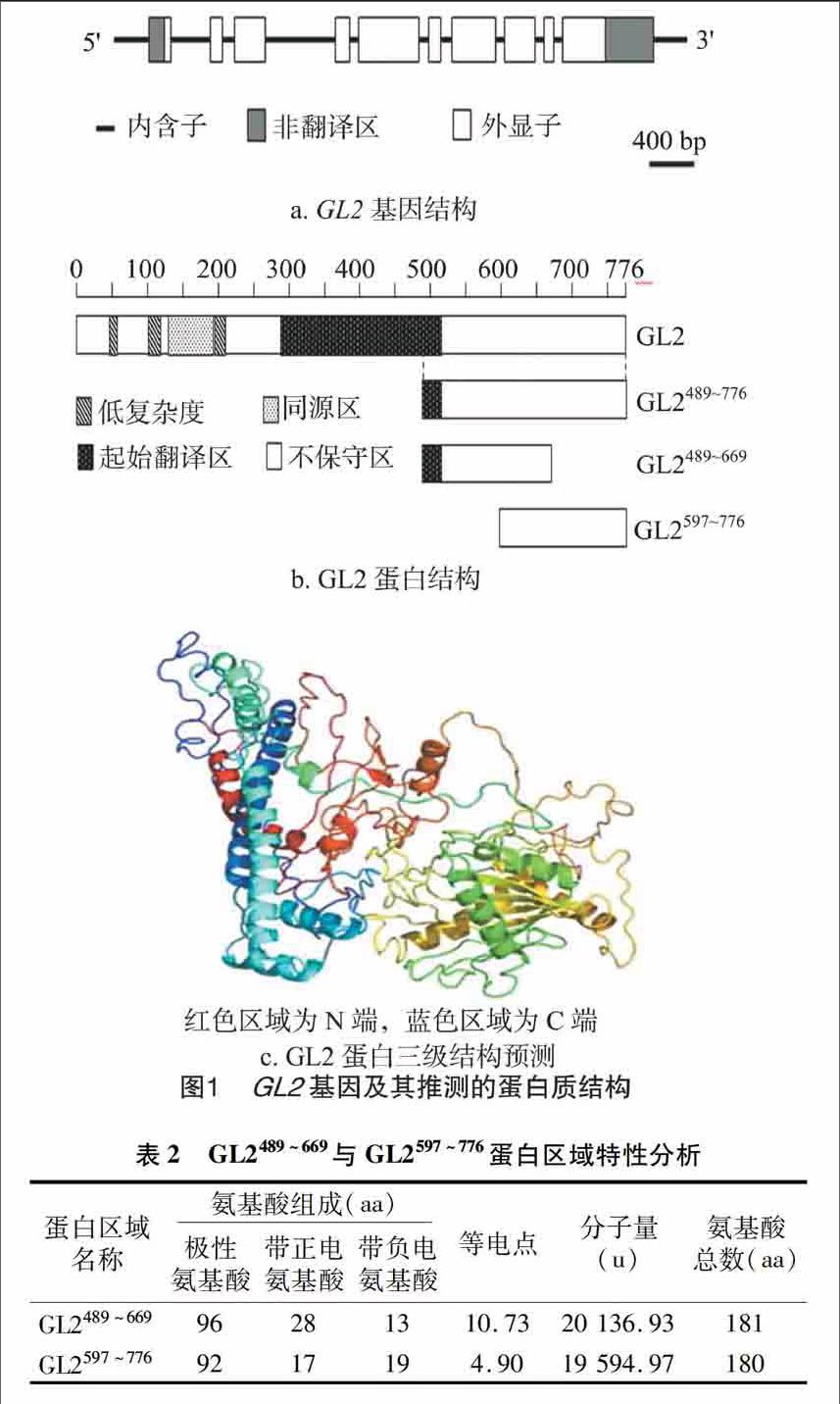
利用拟南芥基因组数据库(wwwarabidopsisorg)获得了基因全长序列及推测的蛋白质序列。由图1-a可知,基因cDNA全长为2 681 bp,开放阅读框为2 331 bp,推测编码1个含有776个氨基酸残基的蛋白质(图1-b)。为了使GL2抗体能有效地检测到抗原,分别在SMART(http://smartembl-heidelbergde)和SWISS-MODEL(http://wwwexpasych/swissmod/SWISS-MODELhtml)上对GL2的结构域和三级结构进行了预测,由图1-b可知,GL2蛋白包含有1个保守的同源区和1个起始翻译区,分别覆盖130~192、280~510 aa区域;在GL2蛋白的N端(1~129 aa)和C端(516~776 aa)保守性较低。由图1-c可知,GL2蛋白的C端亲水程度较高,经过折叠后暴露在外面,而其N端包埋在整个蛋白内部的疏水区域中,所以选取GL2蛋白C端489~776 aa作为原核表达和制备抗体目的蛋白序列。
由表2可知,该蛋白序列两端的氨基酸组成存在明显的差异,489~669 aa区域的氨基酸残基主要由带正电的氨基酸构成,而597~776 aa区域主要由带负电的氨基酸残基构成,所以导致该目的蛋白序列两端的电性相反,N端等电点为1073,C端等电点为490。考虑到这些因素可能影响到后续的表达试验,又进一步将此段蛋白序列分为2个片段连同之前选择的C端序列一起进行表达,并将这些片段分别命名为GL2489~776、GL2489~669、GL2597~776。
22表达序列的PCR扩增及重组质粒pET28a/GL2的构建
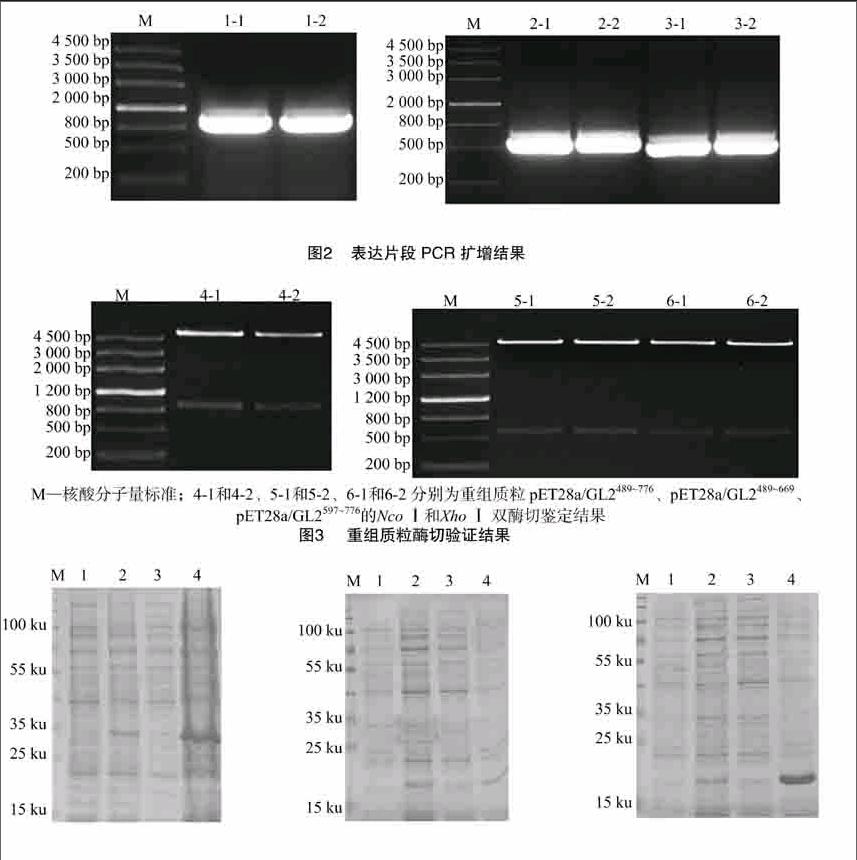
提取2周龄[WTBX][STBX]Col-0[WTBZ][STBZ]背景野生型拟南芥全部地上组织的总RNA并反转录获得cDNA,以cDNA为模板,分别以GL2489~776、GL2489~669、GL2597~776的特异引物GL2F1/R1、GL2F2/R2、GL2F3/R3进行扩增,结果(图2)表明,分别得到长度为864、543、537 bp的表达片段。将PCR扩增获得的DNA片段与原核表达载体pET28a同时进行NcoⅠ和XhoⅠ双酶切,并进行连接,分别构建pET28a/GL2489~776、pET28a/GL2489~669 、pET28a/GL2597~776重组质粒,转化大肠杆菌TOP10感受态细胞并提取质粒进行双酶切,结果(图3)表明,3段表达序列均成功连入pET28a表达载体。[FL)]
23GL2重组蛋白的原核表达、纯化及定量分析
将构建好的重组质粒pET28a/GL2489~776、pET28a/GL2489~669、pET28a/GL2597~776分别转化大肠杆菌BL21感受态细胞,建立重组蛋白的原核表达系统。37 ℃条件下,对重组蛋白进行IPTG诱导使得目的蛋白大量表达。超声破碎菌体后分别取上清和沉淀进行SDS-PAGE检测目的蛋白诱导表达情况及其存在形式,以诱导前和诱导后的菌液为对照。由图4可知,在3个表达体系中,诱导后菌液中均出现了目标蛋白条带,而且其大小与重组蛋白的分子量对应,证明成功诱导得到重组蛋白。对比上清与沉淀的蛋白条带可以判定3种重组蛋白主要以包涵体的形式存在
从SDS-PAGE结果可以看出,重组质粒pET28a/GL2489~669、 pET28a/GL2597~776的表达量较高,所以选用这2个重组质粒进行进一步的筛选。利用诱导表达获得的重组蛋白和6×His抗体进行免疫印迹试验,由图5可知,超声破碎后,rGL2597~776沉淀中的重組蛋白表达量高于rGL2489~669,所以最终选择以rGL2597~776重组蛋白为抗原进行GL2抗体的制备。
重组蛋白rGL2597~776作为免疫抗原需要进一步进行纯化。利用Ni Sepharose 6 Fast Flow亲和柱对rGL2597~776进行亲和层析纯化,最终得到纯度较高的重组蛋白rGL2597~776。以牛血清蛋白浓度梯度为标准对获得的重组蛋白进行定量,通过软件灰度分析计算,最终得到40 mL浓度为09 mg/mL的重组蛋白,重组蛋白总量为36 mg。endprint
24多克隆抗体的制备与免疫检测
以纯化后的重组蛋白rGL2597~776作为抗原对家兔进行4次免疫获得含有GL2多克隆抗体的抗血清,将抗原稀释 10 000、1 000、100倍后与稀释1 000倍的抗血清进行免疫印迹试验。由图6可知,获得的抗血清可以特异地与诱导表达后的抗原结合, 这说明成功得到重组蛋白特异性的多克隆抗
体。利用Image Lab软件进行灰度分析计算,抗血清最低能够检测到的抗原量为86 ng。
25多克隆抗体的纯化
所获得的抗血清除了含有GL2抗体外,可能还包含其他的免疫球蛋白,为了提高GL2多克隆抗体的特异性,依据抗原-抗体特异性结合的原理对获得的抗血清进行纯化,以减少免疫检测试验中背景噪点的影响。首先将抗血清在硝酸纤维素膜上与含大量抗原的溶液进行免疫结合,然后通过调节溶液成分和pH值将特异性结合的抗体洗脱下来,成功获得纯度较高的多克隆抗体(图7
3讨论
拟南芥GL2蛋白相对较大,且含有2个较大的保守结构域同源区和起始翻译区,所以选取部分蛋白序列作为免疫抗原以保证所制备抗体的特异性。在对GL2重组蛋白序列的选择上充分考虑蛋白结构特征与不同结构域的保守性情况,在保证表达蛋白特异性的前提下选取多个表达区段同时进行载体构建和原核表达,避免氨基酸组成差异等因素对重组蛋白表达的影响。本试验通过对比选择了表达量高且免疫性好的重组蛋白rGL2597~776作为抗原。pET28a是常用的原核表达载体,它含有的T7转录系统能够强启动融合基因的表达,并且其多克隆位点两端的6×His标签可以选择与表达蛋白的C端和N端进行融合。融合了的6×His标签一方面可以帮助重组蛋白结合镍柱纯化,另一方面借助Anti-His免疫印迹试验可以有效地验证所表达的重组蛋白的正确性。通过对抗血清中GL2多克隆抗体的亲和纯化,能够有效去除其他非特异性免疫球蛋白,使得获得的多克隆抗体在植物组织蛋白等其他成分復杂的蛋白溶液中的检测更为特异。
利用GL2多克隆抗体可以进行染色质免疫共沉淀以及ChIP-seq等试验,在基因组水平上筛选GL2潜在的下游直接作用靶基因和互作因子,进而探索控制植物表皮毛和根毛发育的基因调控网络,所以,GL2多克隆抗体的制备可以为植物表皮毛和根毛发育调控体系的研究奠定基础。
参考文献:
[ZK(#]Yang C,Ye Z Trichomes as models for studying plant cell differentiation[J] Cellular and Molecular Life Sciences,2013,70(11):1937-1948
Schellmann S,Hülskamp M Epidermal differentiation:trichomes in Arabidopsis as a model system[J] International Journal of Developmental Biology,2005,49(5/6):579-584
[3]Balkunde R,Pesch M,Hülskamp M Trichome patterning in Arabidopsis thaliana from genetic to molecular models[J] Current Topics in Developmental Biology,2010,91(10):299-321
[4]An L,Zhou Z,Yan A,et al Progress on trichome development regulated by phytohormone signaling[J] Plant Signaling & Behavior,2011,6(12):1959-1962
[5]Guan X Y,Li Q J,Shan C M,et al The HD-Zip IV gene [WTBX][STBX]GaHOX1[WTBZ][STBZ] from cotton is a functional homologue of the Arabidopsis [WTBX][STBX]GLABRA2[WTBZ][STBZ][J] Physiologia Plantarum,2008,134(1):174-182
Tominaga-Wada R,Ishida T,Wada T New insights into the mechanism of development of Arabidopsis root hairs and trichomes[J] International Review of Cell and Molecular Biology,2011,286:67-106
[7]Ishida T,Kurata T,Okada K,et al A genetic regulatory network in the Arabidopsis trichome and root hair initiation[J] Annual Review of Plant Biology,2008,59:365-386
[8]Grebe M The patterning of epidermal hairs in Arabidopsis-updated[J] Current Opinion in Plant Biology,2012,15(1):31-37
[9]Morohashi K,Grotewold E A systems approach reveals regulatory circuitry for Arabidopsis trichome initiation by the GL3 and GL1 selectors[J] PLoS Genetics,2009,5(2):e1000396
[10][ZK(#]Yu F,Park S S,Liu X,et al Suppessor of [WTBX][STBX]variegation4[WTBZ][STBZ],a new [WTBX][STBX]var2[WTBZ][STBZ] suppressor locus,encodes a pioneer protein that is required for chloroplast biogenesis[J] Molecular Plant,2011,4(2):229-240
[11]王增,马会勤,张文,等 包涵体蛋白的分离和色谱法体外复性纯化研究进展[J] 中国生物工程杂志,2009,29(7):102-107
[12]单丽伟,唐如春,刘三阳,等 小麦种子过氧化物酶[WTBX][STBX]WP1[WTBZ][STBZ]基因的原核表达、纯化及多克隆抗体制备[J] 生物工程学报,2011,27(1):26-30
[13]李芳,罗军,许会芬,等 西农萨能羊MAT基因的原核表达及多克隆抗体制备[J] 西北农林科技大学学报(自然科学版),2014,42(12):1-6,12
[14]许君,乔帅,常岚,等 苦瓜核糖体失活蛋白MAP30 的原核表达与抗体制备[J] 河南农业大学学报,2009,43(5):552-556
[15]张钰,李亚会,屠唯一,等 拟南芥AtERF1蛋白的原核可溶性表达及多克隆抗体的制备[J] 上海师范大学学报(自然科学版),2013,42(4):378-383endprint

