大鼠骨质疏松模型的建立及其骨髓间充质干细胞内差异lncRNA初步分析
刘易昕,何 强,张大鹏,严 坤,姚年伟,钱卫庆
南京中医药大学附属南京中医院骨伤科,江苏 南京 210000
骨质疏松是全世界范围内的健康难题,其发病与成骨、破骨代谢之间的失衡有关。促进骨形成、探究其相关分子生物学机制,对防治骨质疏松具有重大意义。骨髓间充质干细胞(bone marrow-derived mesenchymal stem cell,BMSC)是一类具有自我更新和多向分化潜能的细胞群,在体内不同环境下可分化为成骨细胞、软骨细胞以及脂肪细胞,其分化去向在全身的骨代谢中起到了重要作用[1],外部因素及其信号处理过程如何调控BMSC分化去向是当前研究的热点。长链非编码RNA(long noncoding RNA,lncRNA)是高度结构化的RNA转录本,长度超过200 个核苷酸,不直接参与蛋白的翻译过程[2]。起初认为lncRNA 不具备生物学功能,近来研究发现lncRNA 可广泛参与基因的表达调控,调节细胞的增殖、分化、凋亡,并与个体的生长发育相关[2]。研究表明,lncRNA 在基因水平对BMSC的调控起重要作用,参与BMSC 分化调控过程中复杂的信号通路,从而间接调控骨质疏松疾病的发生和发展[3-6],但具体调节机制仍不明确。本研究拟通过制备卵巢切除骨质疏松模型,并培养骨质疏松模型大鼠的BMSC,对细胞内lncRNA 进行检测,对比研究相关差异lncRNA 基因的生物学功能及参与的相关信号通路,为后期进一步的验证及功能研究提供基础。
1 材料和方法
1.1 材料
选取雌性SD 大鼠12 只,体重(250±10)g,由南京医科大学实验动物中心提供。所有实验均通过南京市中医院伦理委员会批准同意。12只SD大鼠分为对照组和骨质疏松组,每组6 只。骨质疏松组采用切除卵巢的方法制作模型,对照组仅采用腹部切开不作卵巢切除,均饲养3个月。3个月后每组取3只SD大鼠的BMSC用于基因芯片检测。
1.2 方法
1.2.1 SD大鼠卵巢切除骨质疏松模型建立
根据文献方法制作SD大鼠骨质疏松模型[7],采用10%水合氯醛以1 mL/250 g的剂量腹腔内注射麻醉,待麻醉满意后大鼠腹部剪毛,采用碘伏进行局部皮肤消毒,沿着腹部中线中下部正中作2 cm长切口,将皮肤牵开,切开腹膜,进入腹腔,沿双侧子宫外上角的输卵管找到卵巢,丝线结扎卵巢蒂部,切除大鼠卵巢并取出,缝合腹膜和皮肤切口。对照组SD大鼠仅切开腹部后沿着输卵管显露卵巢,但不作卵巢切除,缝合腹膜及皮肤。
1.2.2 骨密度(bone mineral density,BMD)检测
根据实验设计,在实验开始时和饲养3 个月后分别检测SD 大鼠的骨密度并进行比较。采用10%水合氯醛以1 mL/250 g 剂量腹腔内注射麻醉,待麻醉满意后,将其四肢展开俯卧于双能X 线吸收测量仪(GE 公司,美国)平台上,通过小动物软件测定系统测定各组小鼠全身骨骼的骨密度。
1.2.3 BMSC的分离提取、培养及鉴定
饲养3个月后的SD大鼠,根据文献介绍方法[8],取大鼠右侧股骨干,无菌条件下沿两侧干骺端剪断,暴露骨髓腔,并以1 mL 无菌注射器吸取培养基反复冲洗,直至流出的液体变为清亮并且骨的颜色发白;用移液器将含有小鼠骨髓液的培养基转移至15 mL离心管,轻柔吹打,去除残渣,经离心、重悬后以1×106个/瓶的浓度接种于培养皿内,置于培养箱中,每隔2 d 更换1 次培养液,待细胞融合约80%~90%时进行传代操作。选取第3代BMSC,常规消化并制备细胞悬液,1 000 r/min 室温离心5 min 后PBS缓冲液重悬细胞,并调整浓度5×106个/mL加入流式细胞管,在避光条件下按说明书每管分别加入荧光标记的CD45、CD90抗体,4 ℃避光孵育1 h,对细胞进行1 000 r/min 室温离心5 min 后PBS 洗涤3次,将细胞重悬于加入约1 mL PBS缓冲液,运用流式细胞仪检测并计算阳性细胞的比例,结果显示CD45+细胞比例<1%,而CD90+细胞比例>95%。
1.2.4 基因芯片检测差异lncRNA
根据实验设计,取饲养3 个月后的骨质疏松模型组大鼠3 只和对照组大鼠3 只,培养其BMSC,利用基因芯片技术检测BMSC内差异lncRNA。
在Illumina TruSeq™RNA 样品准备试剂盒使用说明书指导下进行RNA提取及文库的制备,最后进行PCR 富集得到最终的cDNA 文库。利用Trimmomatic(v0.32)进行基因数据质量过滤,保留基因质量在20 以上的碱基。基因差异表达的计量数据为基因表达水平分析中得到的readcount 数据。采用deseq进行分析,采用Quantile的Normalization方法,选取P<0.05、差异倍数>2即|log2FC|>1的基因作为差异表达的基因列出。
1.2.5 GO功能和KEGG信号通路富集度分析
通过GO 分类号和GO 数据库相关分析工具将分类与具体基因联系起来,对基因的功能进行描述,通过分析明确差异基因主要参与的生物功能。对差异表达lncRNA 的共表达靶基因mRNA 做KEGG 信号通路富集分析,判定差异基因主要影响的生物学功能或者信号通路。
1.3 统计学方法
采用SPSS22.0统计学软件包进行数据分析,所有数据以均数±标准差()表示。采用Shapiro-Wilk法检验数据是否服从正态分布,对符合正态分布的计量资料,两组数据比较采用t检验,多组数据比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠骨密度变化
所有12只大鼠均顺利完成手术并饲养3个月。骨质疏松模型组和对照组SD 大鼠术前骨密度差异无统计学意义[(182.33±4.50)mg/cm2vs.(184.17±4.49)mg/cm2,P>0.05];骨质疏松模型组SD 大鼠3 个月后骨密度为较对照组大鼠显著降低[(157.33±6.28)mg/cm2vs.(183.33±4.50)mg/cm2,P<0.05],同时较切除卵巢前显著降低(P<0.05,图1)。

图1 SD大鼠骨密度检测Figure 1 Bone mineral density of SD rats
2.2 大鼠BMSC内lncRNA的差异表达
骨质疏松模型组和对照组SD 大鼠BMSC 内检测出基因片段共计32 759 个,差异有统计学意义(P<0.05)的有8 454个,其中上调3 593个,下调4 861个。检测到的lncRNA基因片段共4 992个,按照|log2FC|>1、P<0.05 的评价标准,骨质疏松模型组和对照组大鼠BMSC 内共116 个lncRNA 差异有统计学意义(P<0.05),占所有lncRNA 基因的2.3%,其中上调35个,下调81个。聚类热图和火山图分析结果提示差异谱结果可靠(图2)。
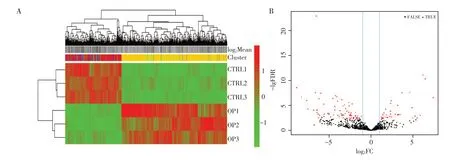
图2 SD大鼠BMSC内的lncRNA表达情况Figure 2 LncRNA expression in BMSC of SD rats
2.3 差异lncRNA高级分析结果
通过高级分析最终筛选出18个lncRNA差异具有统计学意义(P<0.05),其|log2FC|值均在6 以上,其中上调的基因数为3个,占总数的16.7%,下调的基因个数为15个,占总数的83.3%。通过“cis”调控机制来预测差异lncRNA 的靶基因4 532 个,上述|log2FC|值均在6 以上的18 个lncRNA 的预测下游mRNA基因见表1。
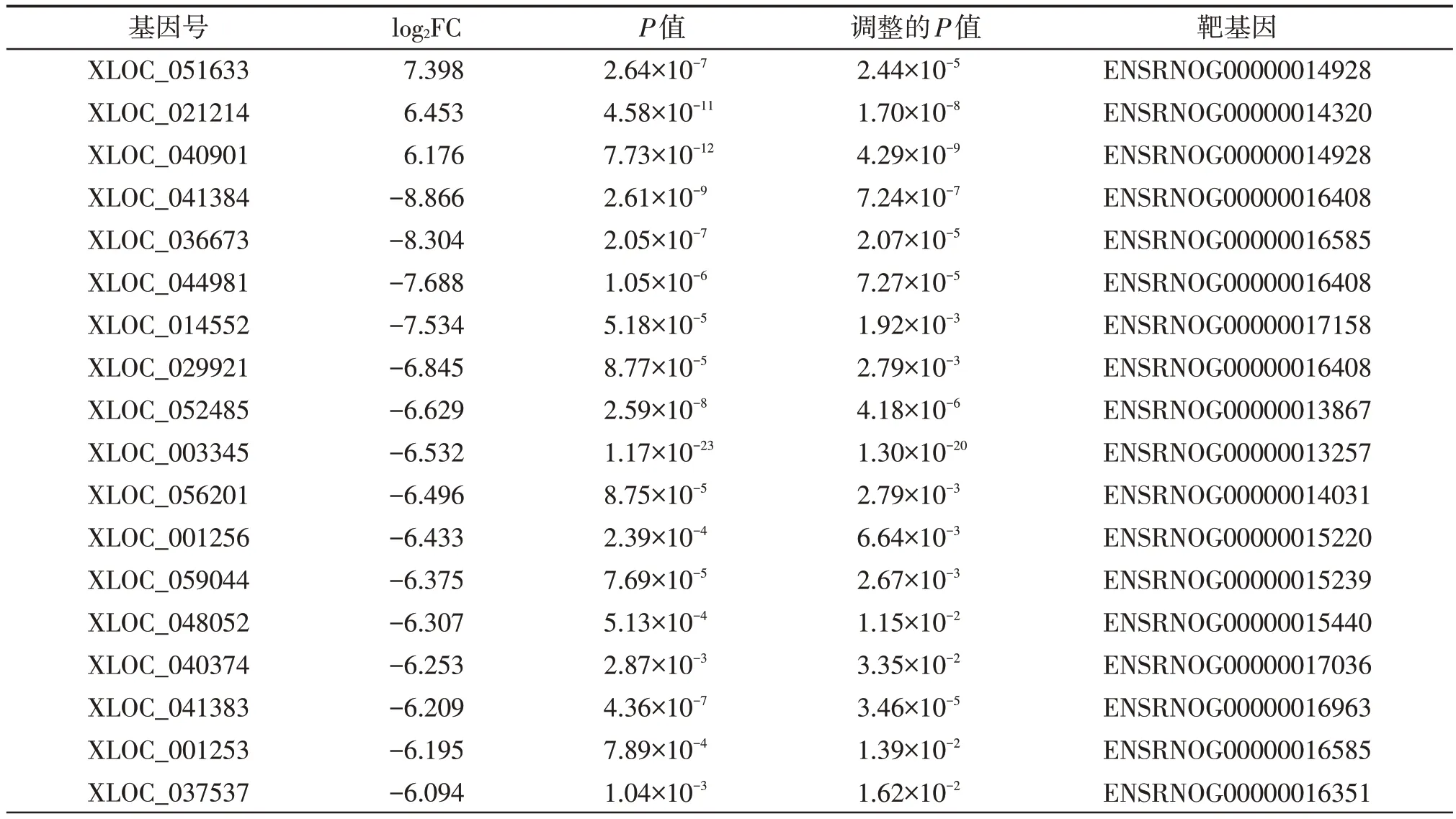
表1 表达显著差异的lncRNA列表及预测的靶向基因Table 1 List of significantly differentially expressed lncRNA and predicted target genes
对基因芯片技术检测到的差异基因、同时又被预测为差异lncRNA 可能调控靶标的编码基因,取交集共计273 个基因进行GO 分析、KEGG 信号通路富集度分析(图3)。根据GO 功能分析,生物学过程(BP)中基因分布前5 位的分别是发育过程(GO:0032502)、细胞生长(GO:0001558),解剖结构的发育(GO:0048856)、刺激反应(GO:0048583)和细胞蛋白代谢过程(GO:0032268)。细胞成分(CC)方面,显著差异lncRNA 主要存在于异染色质、与膜相连的细胞器、核内腔、激活素A复合体内。
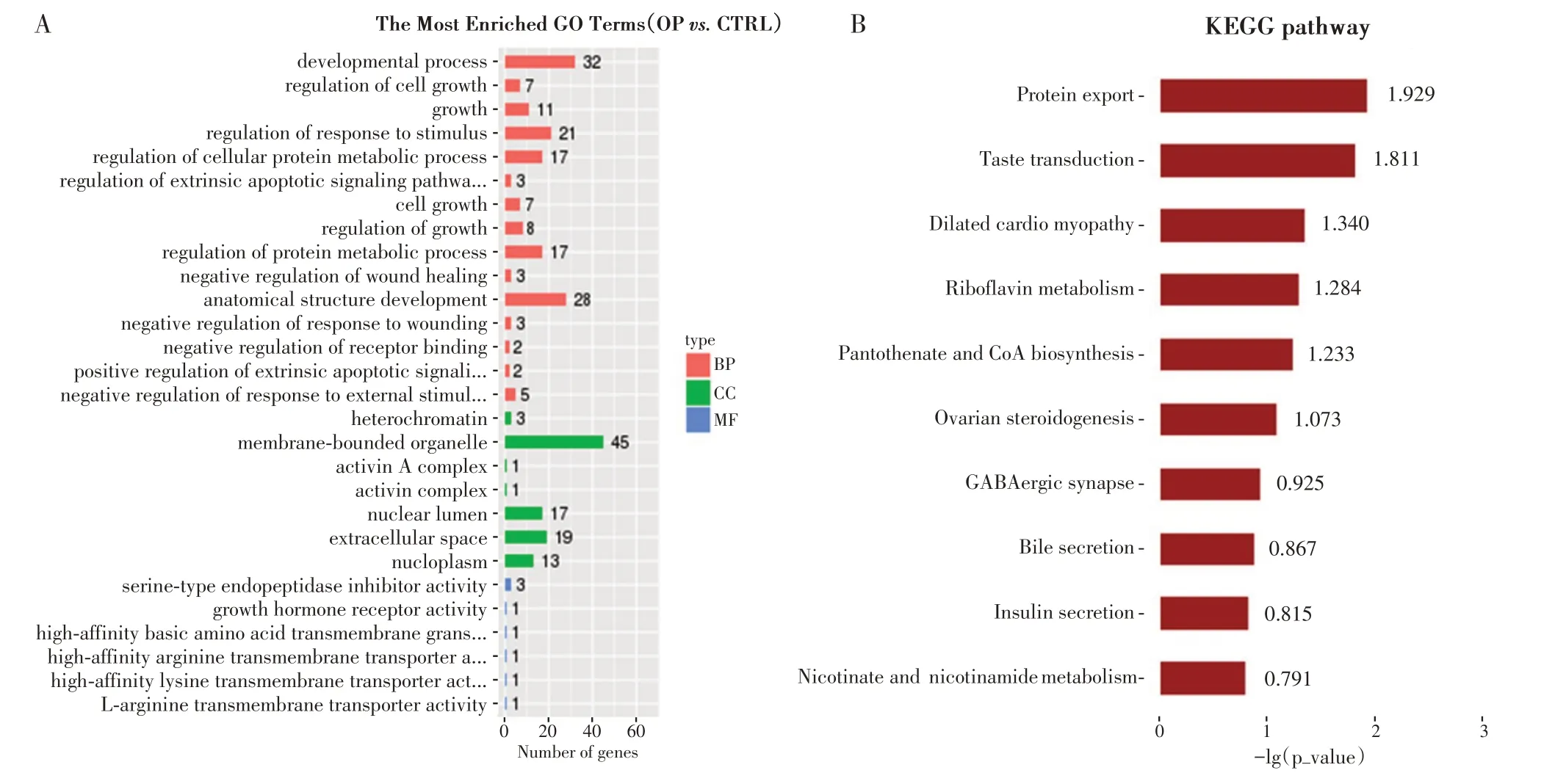
图3 差异lncRNA相关分析Figure 3 Results of differential lncRNA advanced analysis
差异lncRNA 主要富集的KEGG 信号通路,前5 个信号通路分别是:蛋白的转运通路、味觉的传导通路、核黄素的新陈代谢通路、泛酸盐和辅酶A的生物合成通路与扩张型心肌病相关通路,这些通路可能间接调控骨质疏松的病理生理过程。
3 讨论
随着社会老年化人口的增加,骨质疏松的发病率越来越高,其发病可以归因于不平衡的成骨和破骨过程,但是其更详细的发病机制尚不清楚。卵巢切除是制作骨质疏松模型的方法之一[7]。通过对卵巢切除骨质疏松模型与正常大鼠的骨密度结果对比发现,卵巢切除3 个月后,SD 大鼠的骨密度显著降低,进一步说明骨质疏松模型制作成功。
BMSC 是成骨细胞、破骨细胞和脂肪细胞等的前体干细胞,其向不同方向分化对成骨形成和破骨吸收平衡作用至关重要[1]。抑制BMSC成脂、破骨分化,促进其成骨分化,纠正骨代谢失衡是治疗骨质疏松的研究方向之一[9-10]。在骨质疏松的发病过程中,lncRNA 参与了细胞增殖、凋亡和炎症反应的调控,lncRNA在骨质疏松中的具体作用机制尚不明确[11]。
lncRNA 对BMSC 的成骨分化发挥重要作用。通过对人BMSC 的研究发现,下调lncRNA ENST00000502125.2 可导致BMSC 内的碱性磷酸酶染色强度明显增强,染色结节的数也显著增多,表明细胞向成骨性细胞分化[5]。lncRNA H19在BMSC成骨分化过程中表达显著,miR-140-5p表达显著降低,功能分析显示lncRNA H19过度表达可抑制miR-140-5p 表达,加速成骨BMSC 分化,而lncRNA H19缺失则抑制了BMSC 的成骨分化过程,lncRNA H19可调控BMSC 分化过程[3]。同样,lncRNA MEG3 的下调能显著抑制BMSC 的成骨能力,其过表达则能提高BMSC 的成骨能力,其对成骨分化的调节作用可能是通过激活骨形态发生蛋白4(BMP-4)来实现的[6]。
本研究中,在骨质疏松模型大鼠BMSC 内有116个lncRNA的表达差异具有统计学意义,占所有lncRNA 基因的2.3%,其中上调的lncRNA 35 个,下调81个。根据GO功能分析,这些差异lncRNA主要参与细胞生长发育、解剖结构发育的调控、对应激反应的调节、对细胞蛋白代谢过程的调控。差异lncRNA 主要富集的KEGG 信号通路包括蛋白的转运通路、味觉的传导通路、核黄素的新陈代谢通路、泛酸盐和辅酶A的生物合成通路与扩张型心肌病相关通路,这些通路可能间接调控骨质疏松的病理过程,本研究结果可为后续动物体内体外实验、临床试验等进一步探索并验证lncRNA 对骨质疏松发病的影响提供基础。

