RREB1对TGF-β1诱导系膜细胞增殖的影响
赵雅洁,施会敏,何田田,季嘉玲,甘卫华,张爱青
南京医科大学第二附属医院儿肾科,江苏 南京 210003
过敏性紫癜(Henoch-Schonlein purpura,HSP)是儿科常见的风湿免疫性疾病,主要发生机制目前认为是IgA介导的全身性小血管炎,临床表现多样。紫癜性肾炎(Henoch -Schonlein purpura nephritis,HSPN)是过敏性紫癜常见的脏器损害之一,肾脏损伤和HSP患儿的远期预后密切相关[1]。肾小球系膜增生性病变是HSPN 主要的病理表现之一[2]。转化生长因子-β(transforming growth factor-β,TGF-β)是一种多功能细胞因子,目前多用于系膜细胞增殖的体外模型制备。ras反应元件结合蛋白1(ras responsive element binding protein 1,RREB1)是我们采用多肽芯片技术筛选获得,在HSPN 患儿病初血清中差异表达增多的一条多肽对应的前体蛋白,与肾小球滤过率相关,广泛参与了细胞生长和增殖、转录调控和DNA 损伤修复过程[3]。本课题拟在体外观察RREB1表达变化对TGF-β1诱导的系膜细胞增殖的影响,探讨RREB1 在系膜细胞增殖中的作用,进一步探讨HSPN的可能发生机制,为HSPN的诊治提供新的靶点。
1 材料和方法
1.1 材料
大鼠系膜细胞(mesangial cell,MC)购自中国典型培养物保藏中心。胎牛血清、胰酶、DMEM培养基(Gibco 公司,美国),TGF-β1(R&D 公司,美国),TRIzol 试剂(Thermo Fisher 公司,美国),PCR 检测试剂盒(TaKaRa公司,日本),PCR引物由上海锐真生物公司合成,BCA试剂盒(南京凯基生物公司),鼠抗人GAPDH多克隆抗体购于(上海Abway公司),α-SMA抗体(常州Affinity 公司),PCNA、RREB1 抗体(Santa Cruz 公司,美国),PVDF 膜和显影液(Milipore 公司,美国),HRP标记的山羊抗兔二抗(Proteintech公司,美国),CCK-8试剂盒(Cell Counting Kit-8,同仁公司,日本),细胞周期检测试剂盒(Everbright公司,美国)。
1.2 方法
1.2.1 细胞培养
将MC细胞株用含10%胎牛血清的DMEM培养基(含青霉素100 μL/mL,链霉素100 μL/mL)培养,置于37 ℃、5%CO2培养箱中。待培养基中细胞生长至70%~80%时,用1 mL 0.25%胰酶消化后进行传代培养,细胞培养至第3~8 代用于实验。收集对数期MC细胞接种于6孔板内,待细胞贴壁且融合至70%~80%无血清培养基同步化12 h后,再进行细胞转染及干预处理24 h,用TGF-β1(10 ng/mL)[4]干预细胞,按实验分组如下:①空白对照组;②RREB1-siRNA 组;③NC 组(阴性对照siRNA);④TGF-β1 组(10 ng/mL);⑤TGF-β1+RREB1-siRNA组;⑥TGF-β1+NC组。
1.2.2 细胞转染
收集对数生长期MC细胞,用培养液稀释细胞,然后将细胞接种于6孔板中,培养至基本融合为一层,按照Lipofectamine 2000说明书进行转染。先用无血清培养液稀释脂质体、RREB1-siRNA和阴性对照,之后取等体积脂质体和RREB1-siRNA或阴性对照轻柔混合,室温孵育20 min后加入到培养好的细胞中,混匀后置培养箱中培养,6 h 后更换为完全培养基,转染24 h后收集细胞进行验证。
1.2.3 CCK-8法检测细胞增殖活力
收集MC细胞,用培养液稀释细胞,然后将细胞按比例接种于96 孔板中,每孔加入100 μL 细胞悬液,按照实验安排分组预培养细胞后向每孔分别加入10 μL CCK-8 溶液,在37 ℃培养箱中培育1~4 h,用酶标仪测量细胞在450 nm 处的吸光度值。每组设4 个复孔,设置空白调零孔(只加DMEM 溶液和CCK-8溶液),以上实验重复3次。
1.2.4 RT-PCR技术检测目的基因mRNA的表达
细胞按组种板干预24 h 后,将1 mL TRIzol 试剂加入6 孔板内,提取细胞总RNA,20 μL DEPC 水溶解,用Nanodrop 分光光度计检测浓度,根据逆转录试剂盒说明书操作制备cDNA,取适量产物配制10 μL PCR 反应体系,用ABR7600 实时荧光定量PCR仪进行检测。GAPDH为内参,检测α-SMA、PCNA 及RREB1 mRNA 表达。以2-ΔΔCT法计算相对表达量。所用引物序列见表1。
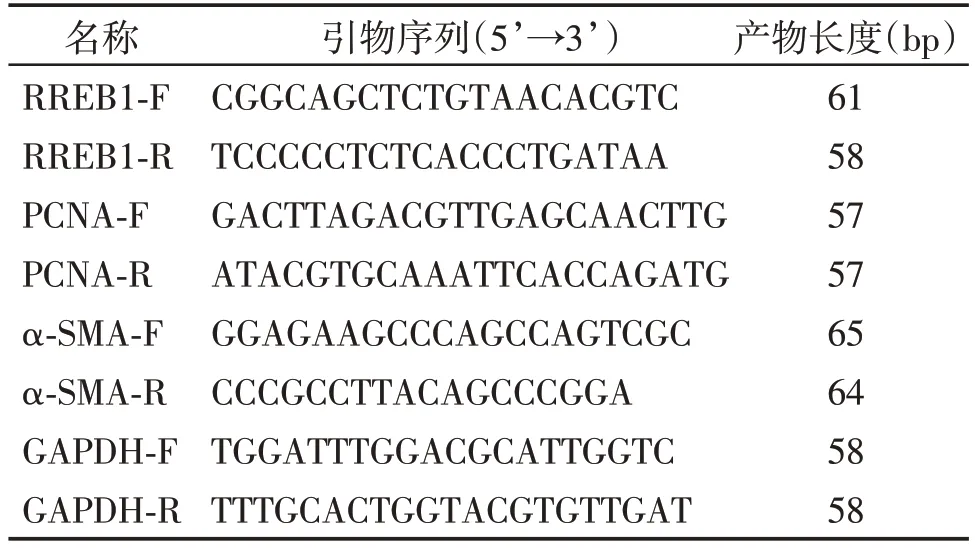
表1 PCR引物序列Table 1 Sequences of PCR primers
1.2.5 Western blot检测细胞蛋白表达量
依照分组干预细胞24 h 后,用预冷的PBS 洗涤细胞2 次,加入细胞裂解液,裂解液中含有RIPA、PMSF 和蛋白酶抑制剂(100 μL+1 μL+1 μL),使用细胞刮刮下细胞并于冰上裂解1 h,集于EP 管中,4 ℃12 000 r/min离心30 min后取上清,BCA法检测蛋白浓度,稀释至最小浓度,并加入1/4 体积5×上样缓冲液,100 ℃金属加热器中变性5 min。用SDSPAGE电泳的方法分离蛋白质,电泳后将蛋白转移至PVDF膜上,室温下5%BSA封闭1 h,加一抗(稀释比例1∶1 000)于室温孵育30 min,再4 ℃孵育过夜。次日室温下复温30 min后用1×TBST洗膜3次后,加二抗(1∶2 000),室温孵育1 h。1×TBST洗膜3次,加显影液后用天能凝胶成像系统进行图像的扫描及记录。1.2.6 流式细胞术检测细胞周期
收集各组细胞,加入75%冰乙醇,吹打均匀,-20 ℃固定过夜,上机前再次离心,加1 mL 冰浴预冷的PBS重悬细胞,配制碘化丙啶染色液,每管加入500 μL 碘化丙啶染色液,缓慢并充分重悬细胞沉淀,室温下避光孵育30 min后流式细胞仪检测细胞周期。
1.3 统计学方法
采用Graph Pad Prism4 统计学软件进行数据分析,计量资料以均数±标准差()表示,组间差异比较采用单因素方差分析(one-way ANOVA),两两比较采用SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 TGF-β1对肾小球系膜细胞α-SMA及RREB1表达的影响
与空白对照组相比,TGF-β1 组系膜细胞α-SMA、RREB1 蛋白表达显著增加,差异有统计学意义(P<0.01,图1)。
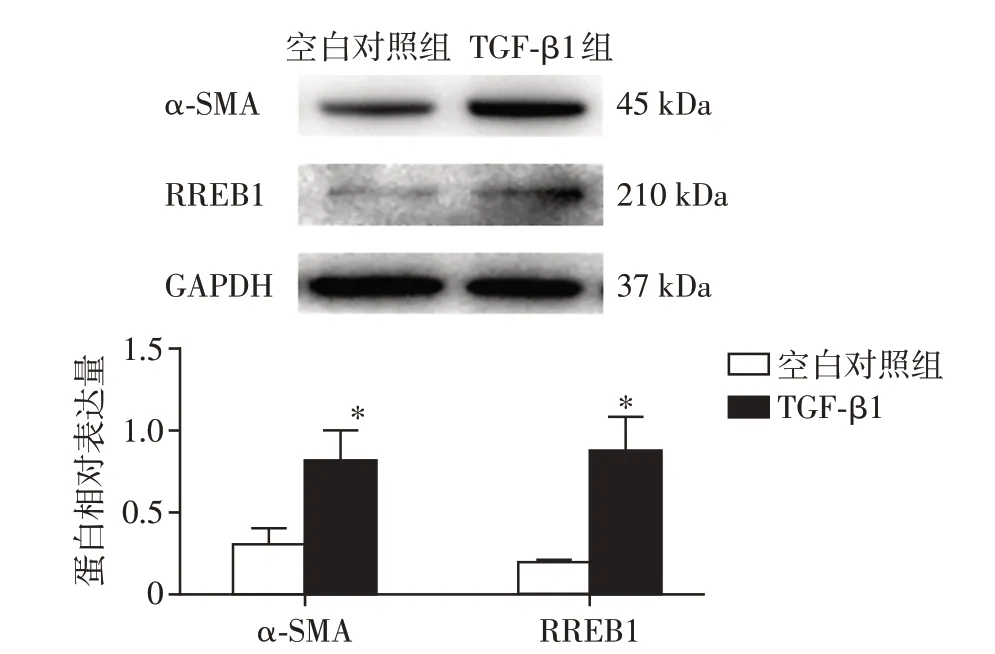
图1 TGF-β1对系膜细胞α-SMA及RREB1表达影响Figure 1 Expression of α-SMA and RREB1 protein levels in TGF-β1-mediated mesangial cell
2.2 RREB1-siRNA对肾小球系膜细胞增殖的影响
CCK-8 法检测细胞增殖活力变化,结果显示:TGF-β1组系膜细胞增殖活力明显高于空白对照组,差异有统计学意义(P<0.01);与TGF-β1 组相比,TGF-β1+RREB1-siRNA 组细胞增殖活力下降,差异有统计学意义(P<0.01,图2)。
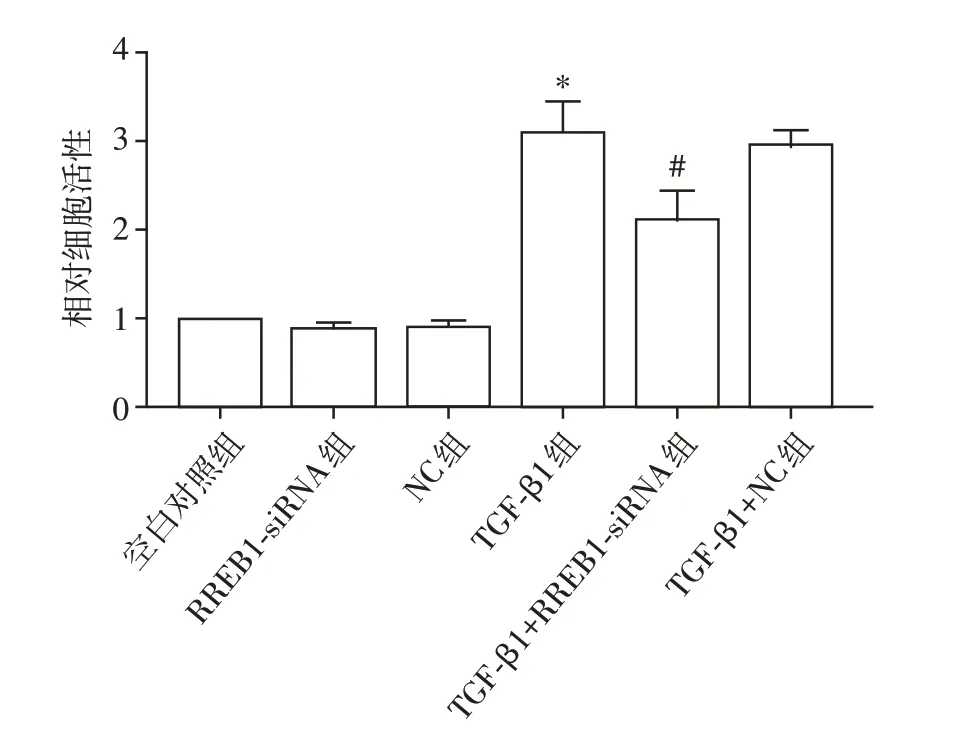
图2 RREB1-siRNA 干扰对TGF-β1 诱导的系膜细胞增殖的影响Figure 2 Effects of RREB1-siRNA interference on TGFβ1-mediated mesangial cell proliferation
2.3 RREB1-siRNA 对肾小球系膜细胞增殖相关基因表达的影响
与对照组比较,TGF-β1组α-SMA、PCNA等增殖相关基因mRNA 表达量明显增加,差异有统计学意义(P<0.01,图3A、B);与TGF-β1组比较,TGF-β1+RREB1-siRNA 组α-SMA、PCNA 等增殖相关基因mRNA 的表达量显著下降,差异有统计学意义(P<0.01)。与对照组比较,TGF-β1 组RREB1 mRNA 表达量增加;与TGF-β1 组比较,TGF-β1+RREB1-siRNA 组RREB1 mRNA 表达量下降,差异有统计学意义(P<0.01,图3C)。
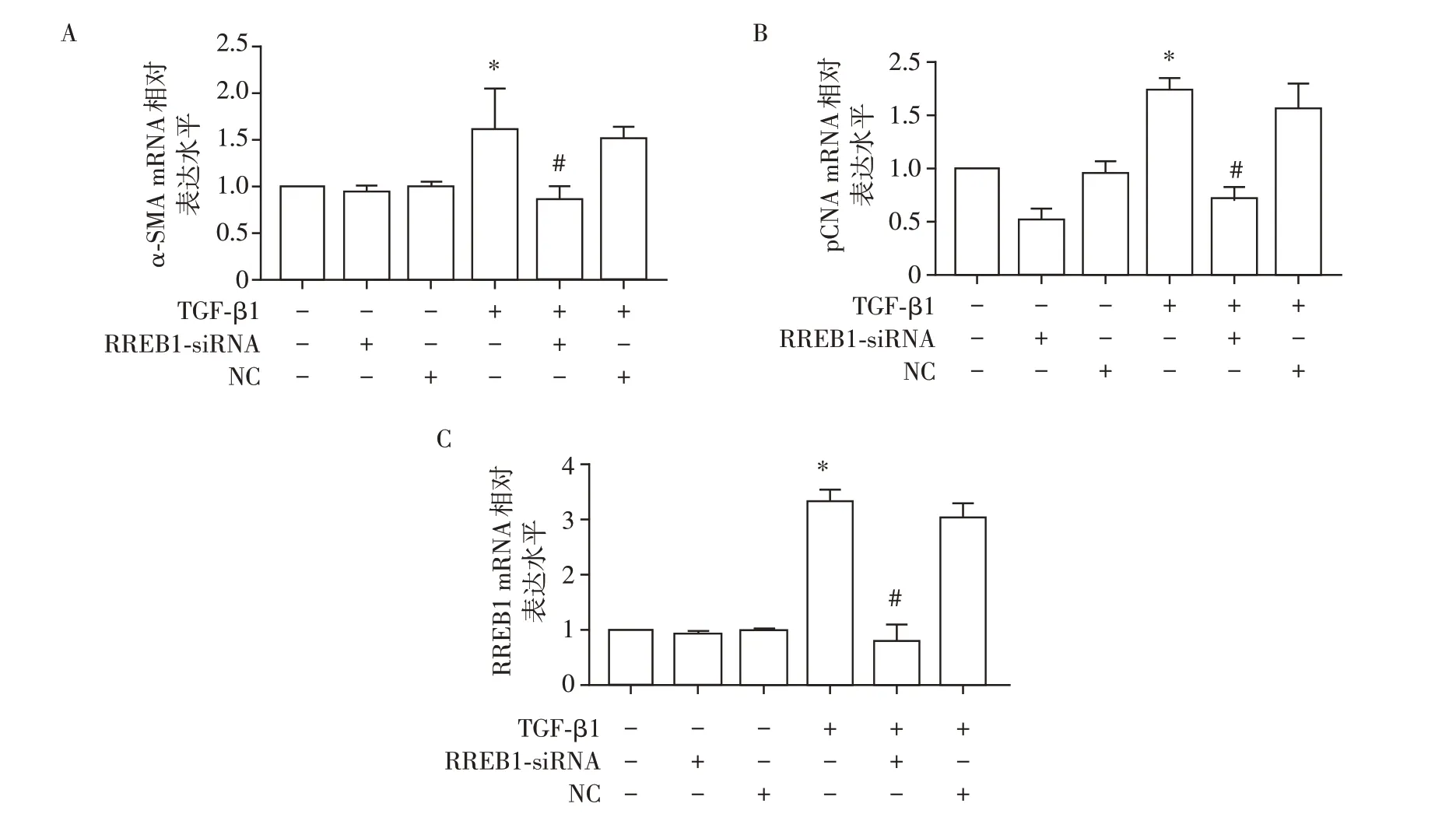
图3 RREB1-siRNA干扰对TGF-β1诱导的系膜细胞增殖相关的影响Figure 3 Effects of RREB1-siRNA interference on proliferated mRNA of TGF-β1-mediated mesangial cells
2.4 RREB1-siRNA 对肾小球系膜细胞增殖相关蛋白表达的影响
与空白对照组相比,TGF-β1 组α-SMA、PCNA、RREB1 蛋白的表达明显升高(P<0.01);与TGF-β1组比较,TGF-β1+RREB1-siRNA 组α-SMA、PCNA、RREB1蛋白的表达量明显下降,差异有统计学意义(P<0.01,图4)。
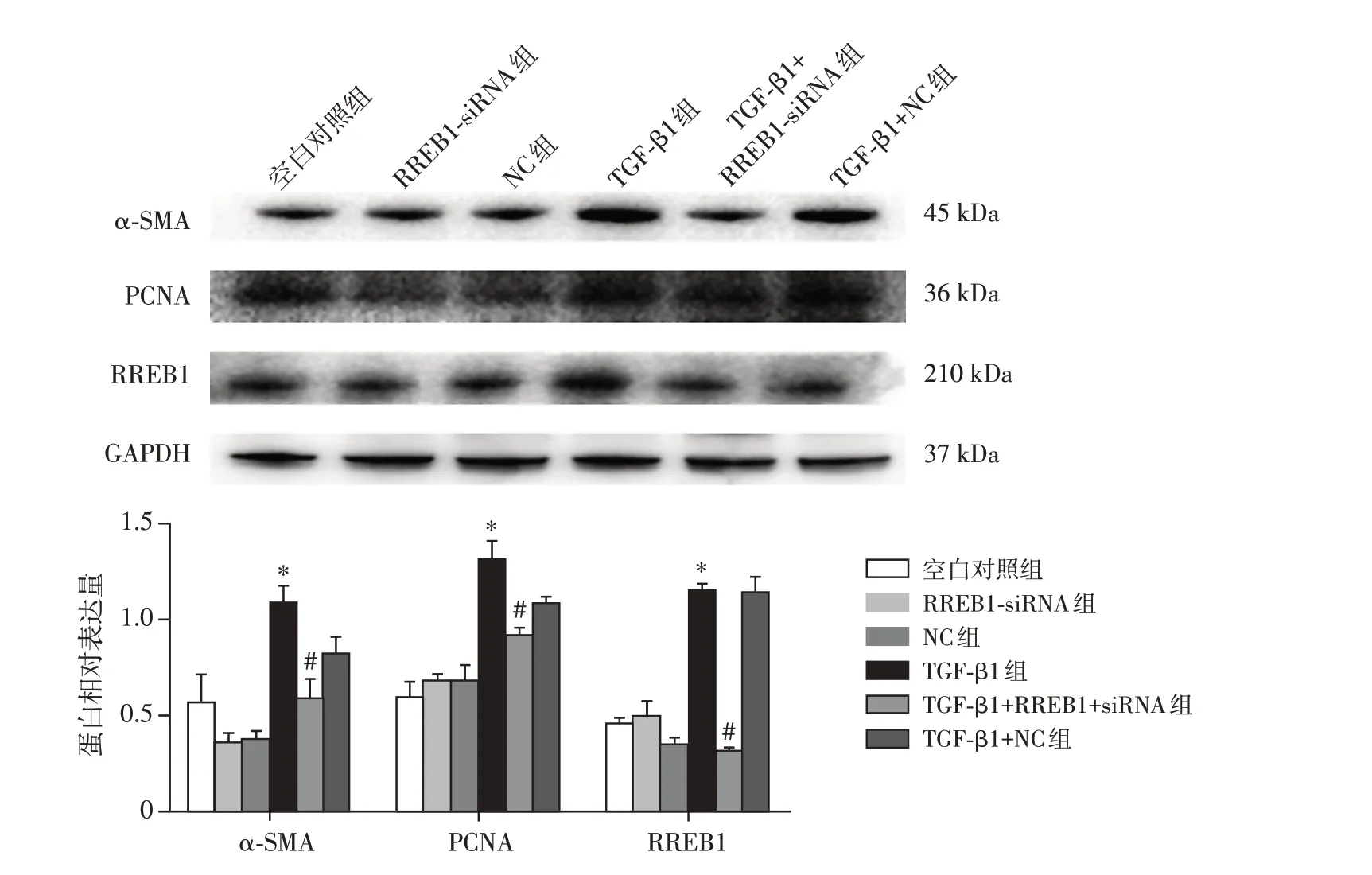
图4 RREB1-siRNA干扰对TGF-β1诱导的系膜细胞增殖相关蛋白表达影响Figure 4 Effects of RREB1-siRNA interference on proliferated proteins of TGF-β1-mediated mesangial cells
2.5 RREB1-siRNA对肾小球系膜细胞周期的影响
与对照组比较,TGF-β1 组G1 期细胞百分率明显降低,G2、S 期细胞百分率明显升高,差异有统计学意义(P<0.05);与TGF-β1 组相比,TGF-β1+RREB1-siRNA 组G1 期细胞百分率明显增多,G2、S期细胞百分率明显降低,差异均有统计学意义(P<0.05,表2)。
表2 RREB1-siRNA干扰对TGF-β1诱导的系膜细胞周期的影响Table 2 Effects of RREB1-siRNA interference on cycle of TGF-β1-mediated mesangial cells(%,,n=6)
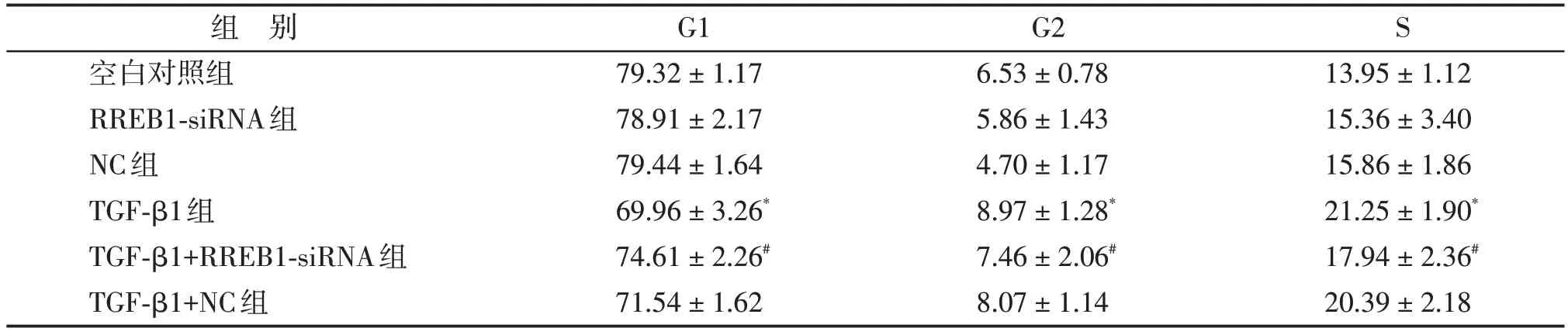
表2 RREB1-siRNA干扰对TGF-β1诱导的系膜细胞周期的影响Table 2 Effects of RREB1-siRNA interference on cycle of TGF-β1-mediated mesangial cells(%,,n=6)
与对照组比较,*P <0.05;与TGF-β1组比较,#P <0.01。
3 讨论
HSPN 是继发于HSP 的肾脏损害,是儿童时期最常见的继发型肾脏病,系膜增生性病变是其主要的病理改变之一。但HSPN肾小球系膜细胞增生的病理生理机制尚未完全阐明。TGF-β1 是一种多功能的细胞因子,能够调节细胞增殖、分化、胚胎发育及凋亡,在促进肾小球病变发生、发展过程中起重要作用[5]。TGF-β1可调节肾小球固有细胞增殖、促进细胞外基质(extracellular matrix,ECM)合成分泌和沉积,是体内外诱导肾小球系膜细胞活化最强有力的细胞因子[6]。目前已经被广泛应用在体外系膜细胞增殖模型的建立中。
PCNA 即增殖细胞核抗原,是反映细胞增殖活性的重要指标,与细胞周期密切相关,存在于正常增殖细胞和肿瘤细胞增殖周期的各个时期,其表达水平随细胞增殖活性增加而升高[7]。在病理增殖情况下肾小球系膜细胞可以合成分泌大量α-SMA,α-SMA可以进一步刺激系膜细胞增殖,促进肾脏纤维化[8]。本研究检测了PCNA 及α-SMA 的表达情况,TGF-β1 干预后的系膜细胞上述两种蛋白表达明显升高,表明TGF-β1可引起系膜细胞病理性增殖。
在前期研究中,我们发现HSPN 患儿存在1 条差异表达的多肽。通过UniProt 数据库分析前体蛋白的相关信息,发现差异表达的多肽PPLVGSSALLSGTALLRPLRPKPPLLLPKPPVTE对应的前体蛋白为RREB1[9]。RREB1是锌指转录因子的一员,能够与靶基因启动子上的ras 反应元件相结合,广泛参与细胞增殖、转录调控及DNA 损伤修复等生物学过程[10],在肿瘤、糖尿病、淋巴瘤及白血病等疾病中均有研究[11]。在胰腺癌患者中RREB1可激活细胞中长链非编码RNA(AGAP2-AS1)的转录,进而调控胰腺癌细胞的增殖和迁移[12]。在直肠癌细胞中,AGAP2-AS1 调控Ras/MAPK 通路进而影响细胞周期与增殖[13]。在肿瘤细胞中RREB1 作为上皮-间质转化(epithelial-mesenchymal transition,EMT)中TGF-β1 激活的Smad 转录因子的关键伴侣,提供Ras 和TGF-β1 途径之间的分子联系,从而协同诱导发育性和纤维化EMT[14]。既往研究表明RREB1 是2 型糖尿病相关终末期肾病的新候选基因,且与肾小球滤过率相关,提示RREB1在肾脏损伤中发挥重要作用[15]。RREB1 还可诱导以及抑制许多基因的转录,有研究表明可诱导P53[16]、抑制P16[17],而这些细胞周期调控关键基因的异常表达均参与了系膜细胞的异常增殖。但尚未有研究证实RREB1 与肾小球系膜细胞增殖之间的相关性。
实验发现在TGF-β1 诱导的大鼠肾小球系膜细胞增殖中,RREB1 的表达明显增加,提示RREB1 在TGF-β1 诱导的系膜细胞增殖中可能发挥作用。为了探讨RREB1是否参与了TGF-β1诱导的系膜细胞增殖,我们使用siRNA 干扰技术,发现RREB1-siRNA干扰后,TGF-β1诱导的系膜细胞增殖受到抑制,增殖相关基因PCNA表达下调,α-SMA表达下调,细胞增殖活力下降,并将细胞周期阻滞于G1 期,提示RREB1 这一ras 反应元件结合蛋白对肾小球系膜细胞的增殖具有重大影响,但其中的具体机制还有待阐明。报道表明RREB1 能被Ras 通路激活[18],而Ras 通路在细胞增殖起主要作用。赵非等[19]发现Ki-RasA-c-Raf-MEK-ERK 这一信号通路独立参与了醛固酮诱导的系膜细胞增殖。miR-34a 也通过PDGFR-β/Ras-MAPK 信号通路调节系膜细胞增殖[20]。本研究中RREB1 干扰后G1 期细胞明显增多,提示RREB1干扰抑制肾小球系膜细胞增殖的机制可能与细胞周期阻滞相关。
综上所述,在TGF-β1 诱导的系膜细胞增殖中RREB1 上调,干扰RREB1 可抑制系膜细胞增殖,阻滞细胞周期,有望成为HSPN 诊治的新靶标,但其中的确切机制并不明确,有待今后进一步研究。

