拮抗菌N-1的分离鉴定及对采后荔枝果实相关酶活性的影响
尤文静,葛春晖,汤 月,成梓瑜,邵远志
(1 海南大学食品科学与工程学院,海口,570228;2 海南大学生命科学学院,海口,570228)
我国热带地区园艺产品中,热带水果以种类多样、口味独特、果实富营养等特点成为带动产业化经济发展的主要模式。荔枝是海南省重要的特色水果,在海南经济社会和农民增收中发挥着重要作用。然而,由于海南水果产区常年气温偏高,雨水充沛湿度大,使得当地热带水果采后病害发生严重,病原菌种类复杂多样,不仅给热带果蔬产业造成巨大的经济损失,也为病害防控带来了更大挑战[1]。据估算,因采后病害带来的经济损失占整个园艺产品采后损失的一半以上[2-3]。
常见的热带水果采后病害防治方法有物理控制、化学杀菌、生物防治三大类。化学杀菌剂的频繁使用造成了病原菌抗性、杀菌剂残留和污染环境等问题,因而有必要发展环境友好、安全有效的生物防治模式[4-5]。目前常见的生防菌主要包括细菌、木霉菌、酵母菌和放线菌,以细菌最为普遍。细菌作为最有优势的生防因子,种类和数量多、作用方式广、繁殖速度快、易分离和培养、易产生次生代谢物[6-7]。其中,芽孢杆菌可分化高抗逆性的芽孢,环境适应能力强,为生物抗菌剂的商品化提供了有利条件。对此,国内外学者集中于芽孢杆菌Bacillussubtilis进行了一些研究[8-9]。一些芽孢杆菌已经被应用于医药、农业和工业等方面的生产实践中[10]。但目前关于芽孢杆菌对于海南热带水果采后病害的综合防治研究相对较少。
本研究从海南省琼海市莲雾果园根系土壤中分离筛选拮抗细菌,并研究其生物学特性;将拮抗菌应用于采后荔枝果实贮藏,测定活体防效和果实抗病相关酶活性,为生防菌应用于热带水果采后病害防治提供参考。
1 材料与方法
1.1 材料、培养基及试剂
从海南省琼海市荔枝种植基地采集七至八成熟、大小一致、健康的“妃子笑”荔枝果实450个;采集琼海市莲雾园内果树10 cm深根围土壤,以及龙眼、荔枝、黄皮等果实叶片,分装于保鲜袋中标记,置于4 ℃保存,用于拮抗菌株的分离。
马铃薯葡萄糖琼脂培养基(PDA),新鲜去皮马铃薯200 g,葡萄糖20 g,琼脂20 g,pH值7,蒸馏水定容至1 000 mL;营养琼脂培养基(NA),牛肉浸膏3 g,细菌学蛋白胨5 g,NaCl 5 g,琼脂20 g,pH值7,蒸馏水定容至1 000 mL;酵母浸出粉胨葡萄糖琼脂培养基(YPDA),酵母浸出粉10 g,蛋白胨10 g,葡萄糖20 g,琼脂20 g,pH值7,蒸馏水定容至1 000 mL。培养基均于121 ℃灭菌20 min后待用,各液体培养基为对应固体培养基配方去掉琼脂。
聚合酶链式反应(PCR)体系试剂、Ezup柱式真菌、细菌基因组DNA抽提试剂盒,上海生工生物工程股份有限公司产;其他试剂均为分析纯,上海麦克林生化科技有限公司产。
1.2 仪器与设备
Nikon ECLIPSE Ci-s/Ci-L显微镜,南京衡桥仪器有限公司产;FYL-YS-280L型恒温箱,北京福意电器有限公司产;BCM-1000生物净化工作台,苏州苏洁净化设备有限公司;ZEALWAYGR60DA高压灭菌器,厦门致微仪器有限公司产;NRY-211恒温培养摇床,上海南荣实验室设备有限公司产;AL-204电子天平,梅特勒-托利多仪器(上海)有限公司产;BIC-300控温控湿培养箱,上海博迅实业有限公司医疗设备厂产;TG16KR台式高速冷冻离心机,长沙东旺实验仪器有限公司产。
1.3 方法
1.3.1 拮抗菌的分离筛选 拮抗菌的分离:采用浓度梯度稀释法和划线法分离纯化得到拮抗菌[11]。将10 g叶片剪成小块并加入无菌水10 mL于无菌研钵中研磨10 min,将匀浆液加入无菌水80 mL混合均匀,制得叶片混合液;取土壤样品10 g,加入无菌水90 mL充分混匀,制得土壤混合液。将叶片混合液和土壤混合液在28 ℃、180 r/min条件下振荡培养2 h,分别稀释培养后样液至10-4、10-5、10-6浓度,取各浓度稀释液100 μL分别涂布于YPDA、NA培养基上,于28 ℃培养48 h,挑取平板上不同形态的菌落划线分离,直至获得单菌落,将分离得到的菌株保存4 ℃冰箱备用。
拮抗菌的筛选:纯化菌株拮抗性初筛采用平板对峙法[12],以实验室保存的7株病原菌作为指示菌,采用K-B法再次进行拮抗能力复筛,比较各菌株的抑菌带半径(mm)和拮抗指数[13],稳定保存拮抗效果最佳的菌株。指示菌分别为变红镰刀菌L-B1(Fusariumincarnatum)、可可毛色二孢菌L-B2(Lasiodiplodiatheobromae)、白地霉XJ-B1(Geotrichumcandidum)、砖红镰刀菌XJ-B2(Fusariumlateritium)、拟茎点霉A-B2(Phomopsissp.)、菜豆间座壳属A-B3(Diaporthephaseolorum)和霜疫霉菌SY(Peronophythoralitchii)。
1.3.2 拮抗菌的鉴定 以《常见细菌系统鉴定手册》的方法[14]确定拮抗菌菌落形态特征,结合革兰氏染色等微生物生理生化特性测定初步鉴定拮抗菌N-1。委托上海生工生物工程股份有限公司测定拮抗菌株的基因序列,将测序结果在GenBank核酸数据库中进行同源性比对。测序引物:926F,AAACTYAAAKGAATTGACGG;1100R,GGGTTGCGCTCGTTG;518R,ATTACCGCGGCTGCTGG。扩增引物:27F,AGTTTGATCMTGGCTCAG;1492R,GGTTACCTTGTTACGACTT。将拮抗菌菌落形态特征、生理生化特性和分子生物学鉴定结果结合鉴定拮抗菌株。
1.3.3 拮抗菌N-1生物学特性研究 N-1种子培养液制备:在NA培养基上活化拮抗菌,培养24 h后接种至灭菌NB培养基中,30 ℃、180 r/min条件下培养24 h,取菌液100 μL以血球计数板计数,用无菌蒸馏水调节菌液浓度至1×108CFU/mL,得到拮抗菌种子培养液备用。
生长曲线测定:将拮抗菌种子液以1%接种量转接到100 mL NB培养基中,30 ℃、180 r/min条件下摇床震荡培养,每隔3 h取菌液3 mL通过紫外可见分光光度计测定其在625 nm波长下的吸光值,绘制拮抗菌生长曲线,以无菌NB培养基为对照,每处理重复3次。
最适生长温度的测定:取N-1种子培养液0.5 mL接种于pH值7.0 50 mL NB培养基中,分别放置于25、28、30、37、40、45、50 ℃,180 r/min条件下摇床培养24 h后,测定菌液的OD625值。以无菌NB培养基为对照,每处理重复3次。
最适生长pH值测定:调节灭菌后的50 mL NB培养基pH值分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0等梯度,分别接种N-1种子培养液0.5 mL,并于30 ℃、180 r/min摇床中培养24 h,测定各个培养液在625 nm波长处的吸光值。以无菌的NB培养基为对照,每处理重复3次。
1.3.4 拮抗菌对贮藏影响试验 采摘七至八成熟、大小一致、无病虫害的“妃子笑”荔枝果实,用自来水清洗,修剪果柄长至5 mm,将果实分成2组,分别用无菌蒸馏水(对照)和拮抗菌悬浮液(1×108CFU/mL)浸泡果实20 min,每处理果实30 个,重复3次,室温下晾干;处理后果实置于25 ℃、相对湿度90%的恒温恒湿环境中贮藏,于不同时间统计腐烂果实数。
果实腐烂情况根据果实表面病斑面积占果实面积的比例进行分级[15]:0级,果实无病斑;1级,果实病斑面积小于果实面积的1/10;2级,果实病斑面积为果实面积的1/10~1/5;3级,果实病斑面积为果实面积的1/5~1/2;4级,果实病斑面积大于果实面积的1/2。2~4级果实为无商品价值果实,计算腐烂率。果实腐烂率(%)=∑(2~4级果实数)/调查总果数×100。
果实褐变情况根据果实褐变面积占果实面积的比例进行分级[16-17]:0级,果实无褐变;1级,果实褐变面积小于果实面积的1/8;2级,褐变面积为果实面积的1/8~1/4;3级,果实褐变面积为果实面积的1/4~1/2;4级,果实褐变面积大于果实面积的1/2。观察果实褐变情况,计算好果率。好果率(%) =∑(0~2级果实数)/调查总果数×100。
1.3.5 果实病程相关酶活性的测定 多酚氧化酶(PPO)活性测定,称取样品2 g,在冰上加入pH值5.5的0.1 mol/L乙酸-乙酸钠缓冲液[含1 mmol/L PEG 6000,4%(W/V)PVP和1%(W/V)TritonX-100]5 mL研磨匀浆并转移至离心管内,在4 ℃,12 000 r/min条件下高速离心20 min,得到粗酶液;参照Sun等[18]的方法并稍加修改。在洁净试管中先后加入pH值5.5 0.05 mol/L 乙酸-乙酸钠缓冲液4 mL、0.05 mol/L领苯二酚溶液1.0 mL和粗酶液100 μL,酶液加入后反应开始并立即计时,在第15 s时首次记录样品在波长420 nm处的吸光值,此后每1 min测定并记录,连续测定6次,以蒸馏水为对照。反应以每分钟吸光值变化0.01为1个酶活力单位(U)。
过氧化物酶(POD)活性测定,酶液提取与PPO相同,参照Sun等[19]的方法稍做修改。在试管中分别依次加入pH值5.5 0.1 mol/L乙酸-乙酸钠缓冲液2.7 mL,25 mmol/L愈创木酚溶液100 μL,粗酶液100 μL,0.5 mol/L过氧化氢溶液100 μL,反应立即启动并计时。在开始计时的第15 s时首次记录样品在波长470 nm处的吸光值,而后每1 min测定并记录,连续测定6次,以蒸馏水为对照。吸光值每分钟变化1即为1个酶活力单位(U)。
苯丙氨酸解氨酶(PAL)的活性测定,粗酶制备,在pH值8.8 0.1 mol/L硼酸缓冲液[含2 mmol/L EDTA,5 mmol/L β-巯基乙醇和4%(W/V)PVP]7 mL中匀浆2 g样品并转移至洁净离心管内,于4 ℃,12 000 r/min条件下离心20 min。参照Zhang等方法[20]测定PAL活性,在测试管中分别先后加入pH值8.8 50 mmol/L硼酸缓冲液3 mL、20 mmol/L L-苯丙氨酸溶液0.5 mL和粗酶液0.5 mL,向对照管中加入pH值8.8 0.1 mol/L硼酸缓冲液0.5 mL代替酶液,混匀的样液在37 ℃下反应1 h后快速加入6 mmol/L盐酸溶液100 μL,反应终止。以紫外分光光度计测定反应液的OD 290值,将吸光值变化0.01记为1个酶活力单位(U)。
1.4 数据处理
采用Excel 2016处理并分析,采用Duncan法进行显著性分析(p<0.05,SPSS 22.0)。
2 结果与分析
2.1 拮抗菌的筛选
从莲雾果园根系土壤和热带水果叶片混样中共分离菌株106株,通过平板对峙法进行拮抗性初筛,得到9株有拮抗作用的生防菌株,经复筛最终获得拮抗效果明显的生防菌株6株。其中,拮抗菌N-1拮抗能力最佳,对7种病原菌抑制效果显著。对砖红镰刀菌XJ-B2的抑菌带半径可以达到8.87 mm,拮抗指数为2.55,对荔枝霜疫霉SY的抑菌带半径为5.17 mm(见表1)。
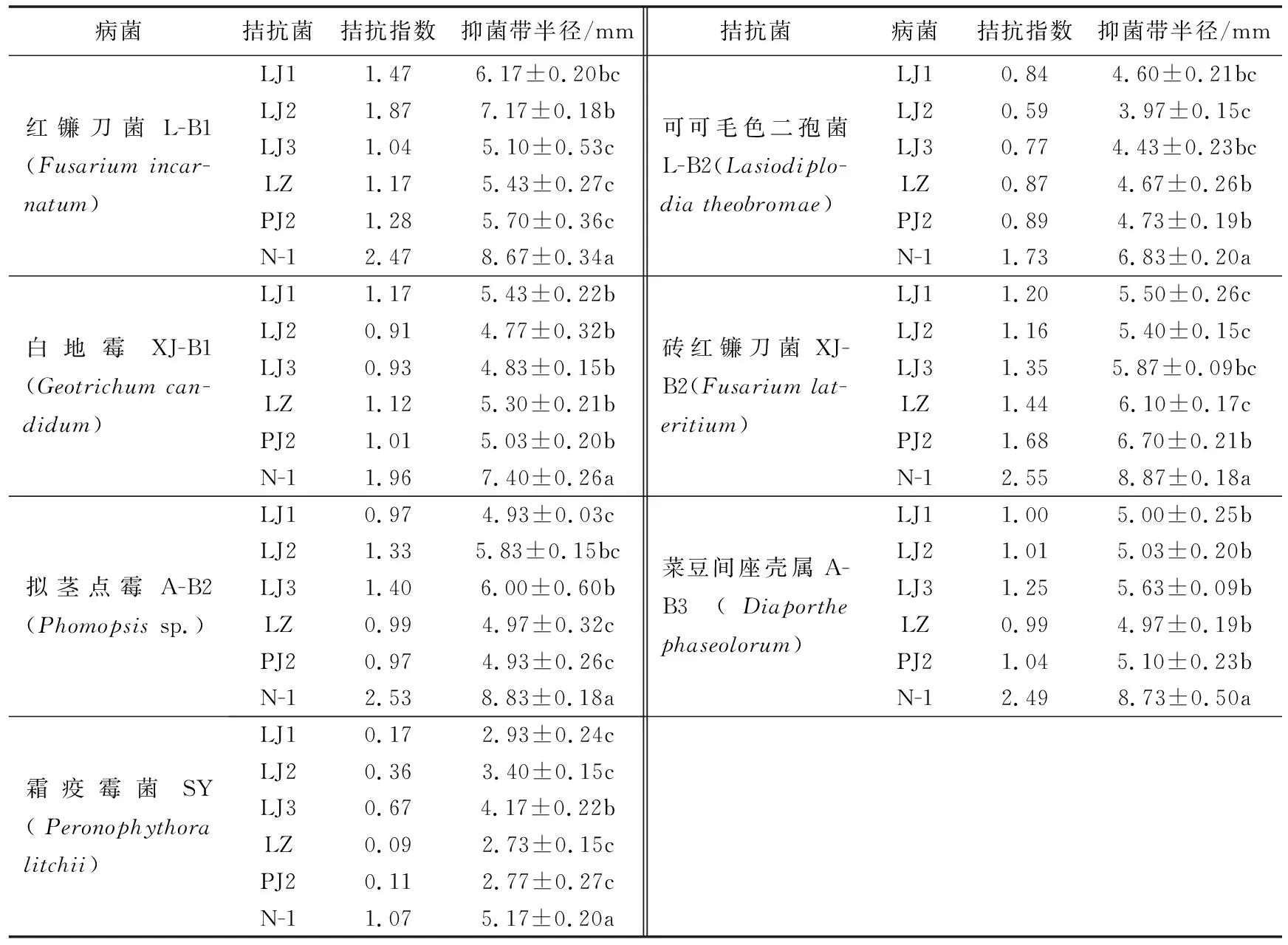
表1 拮抗菌对7种病原菌的平板抑制效果
2.2 拮抗菌的鉴定
2.2.1 形态学特征 拮抗菌N-1在NA培养基上生长24 h后,菌落呈乳白色,易挑起,中心微隆起,边缘褶皱不齐,革兰氏染色结果为阳性,细胞呈杆状并伴随有芽孢(见图1)。拮抗菌N-1在厌氧环境下可以生长,具有水解淀粉、耐盐、利用葡萄糖等碳源和氮源等能力,接触酶和V-P测定呈阳性,符合芽孢杆菌特征(见表2)。结合《常见细菌系统鉴定手册》,可初步鉴定此菌株为芽孢杆菌属(Bacillussp.)。
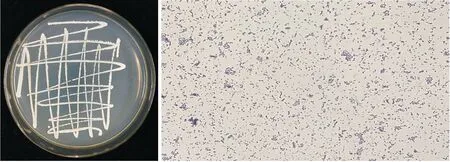
图1 拮抗菌N-1的菌落和细胞形态
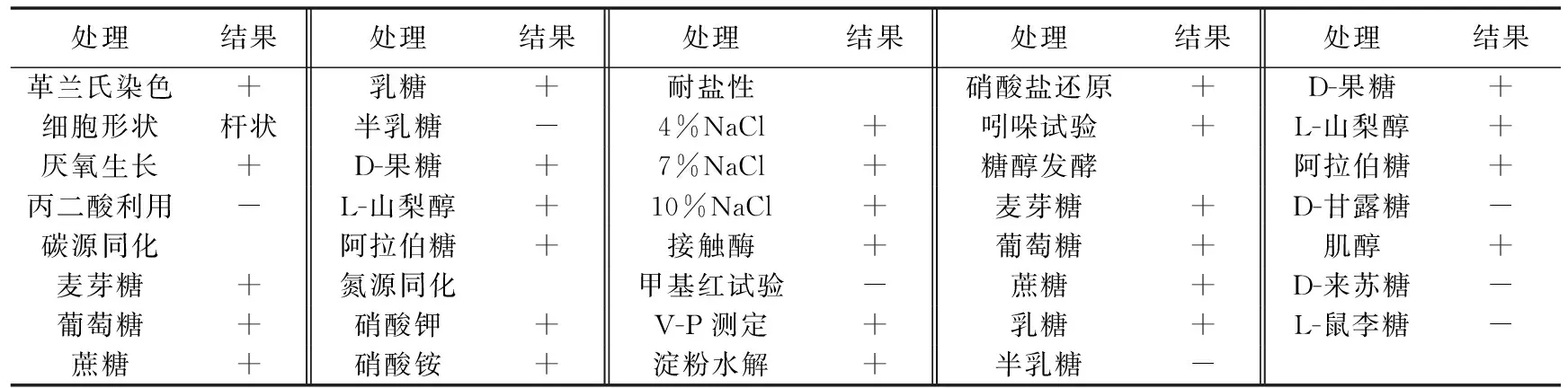
表2 拮抗菌N-1的生理生化特征
2.2.2 分子生物学鉴定 菌株N-1的16S rDNA扩增结果见图2,经扩增、测序得到1段长约1 481 bp的核苷酸序列片段。将此结果在GenBank数据库中进行同源性比对,结果表明,菌株N-1与Bacillussiamensis(MN176482.1)的16S rDNA序列高度同源,同源性可达100%;结合菌株的形态学和生理生化特征,将菌株N-1鉴定为暹罗芽孢杆菌B.siamensis。
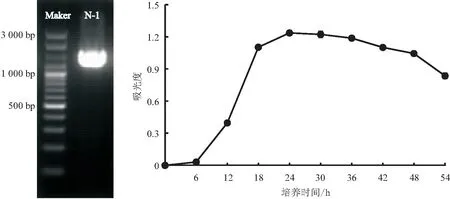
图2 拮抗菌N-1的16S rDNA电泳和生长曲线
2.3 拮抗细菌的生物学特性
2.3.1 生长曲线 从图2可以看出,拮抗菌株N-1接种到NB培养液后,24 h内呈对数生长,并在培养24~36 h内维持稳定生长;培养27 h时,拮抗菌培养液在625 nm波长处的吸光度达到最大;培养36 h后,菌株的吸光度开始下降,菌株生长开始进入衰亡期。说明该拮抗菌生长速度较快,接种后24~36 h生长状态稳定,27 h产生的菌量最多,生长旺盛。
2.3.2 温度和pH值的影响 从图3可以看出,温度对拮抗菌N-1的生长具有明显的影响,接种于NB中培养24 h,不同温度条件下菌株N-1生长状态不同。随温度逐渐增高,菌株N-1的生长繁殖速率呈现先上升后下降的趋势,起初N-1的吸光值逐渐升高,并在30 ℃达到吸光度峰值;随后逐渐下降,温度为50 ℃时,拮抗菌的吸光值低于0.1,生长极缓慢。说明拮抗菌N-1的最适生长环境温度约为30 ℃,过高或过低的温度会对拮抗菌的生长产生不利影响。
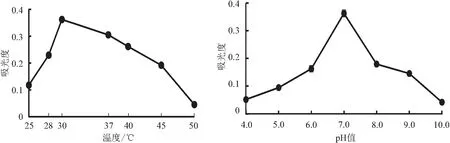
图3 温度和培养基pH值对拮抗菌N-1生长的影响
培养基pH值显著影响拮抗菌N-1的生长繁殖状态。当pH值为4.0、5.0和10.0时,N-1生长缓慢,吸光值仅在0.1左右或更低。pH值 6.0~9.0是N-1适宜的生长环境,其中pH值7.0最适宜,此时吸光值最高,约是pH值4.0的7倍左右。说明适宜的酸碱环境对拮抗菌株N-1的生长是必需的,N-1适宜在中性条件下生长。
2.4 对果实贮藏的影响
从表3看出,贮藏12 d,对照的果实腐烂率逐渐升高至94.44%,而N-1处理的果实腐烂率仅18.89%,差异极显著(p<0.001)。此外,拮抗菌N-1对果实的褐变具有明显的抑制作用,两个处理的好果率差异显著,贮藏第8天,拮抗菌N-1处理的好果率仍保持100%,而对照仅有45.56%;贮藏第10天,拮抗菌N-1处理的果实逐渐褐变,好果率降为63.33%,而此时对照好果率仅为17.78%;贮藏12 d时,对照好果率降为0,而拮抗菌N-1处理好果率仍保持44.44%。说明拮抗菌N-1可有效地抑制荔枝果实采后贮藏期病害和褐变发生。
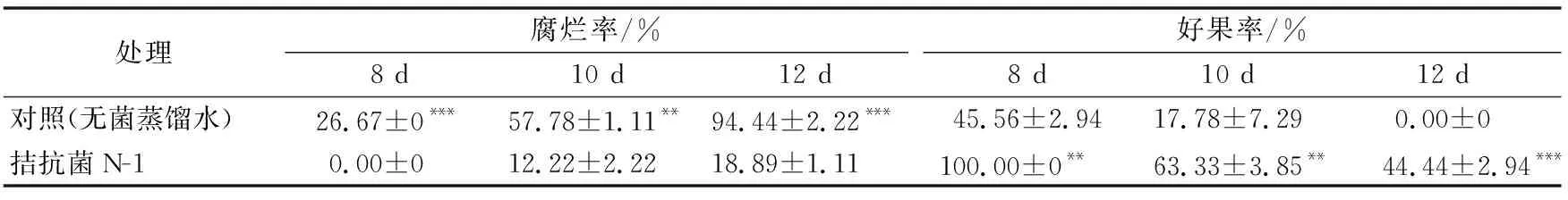
表3 拮抗菌N-1处理对“妃子笑”荔枝果实25 ℃下贮藏腐烂率和好果率的影响
2.5 对果实相关酶活性的影响
从图4看出,拮抗菌N-1处理后,荔枝果实多酚氧化酶(PPO)活性总体呈先上升后下降的变化趋势,对照的PPO活性始终高于拮抗菌N-1处理。贮藏前期,荔枝果实的PPO活性逐渐上升,并在贮藏第4天到达峰值,而后逐渐下降;此时对照的PPO活性最高,达到9.72 U/g·min·FW,而拮抗菌N-1处理仅有6.94 U/g·min·FW;拮抗菌N-1处理的PPO活性在贮藏中后期均低于对照。说明拮抗菌N-1处理可以在采后贮藏期有效抑制PPO对荔枝果实的不利影响。
在采后贮藏期间,两个处理荔枝果实POD活性总体均呈先升后降的动态趋势,拮抗菌N-1处理的POD活性与对照差异显著。贮藏初期,对照与拮抗菌N-1处理的POD活力均逐渐升高,且拮抗菌N-1处理POD活性高于对照;贮藏第8天,POD活性达到高峰,拮抗菌N-1处理是对照的1.69倍,差异极显著(p<0.01)。贮藏后期,对照的酶活性急剧下降,贮藏第12天,拮抗菌N-1处理仍能维持6.99 U/g·min·FW的POD活性,而对照的POD活性不足2 U/g·min·FW。说明拮抗菌N-1处理有助于维持荔枝果实高水平的POD活性。
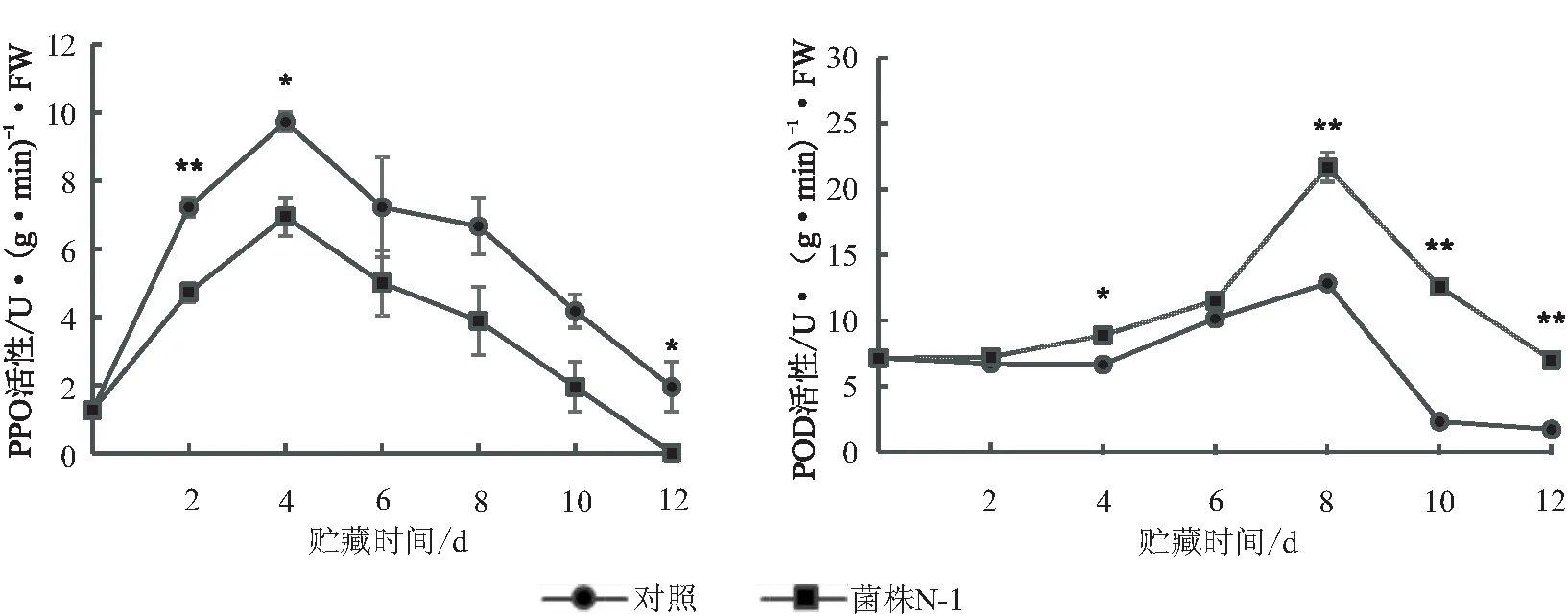
注:*、**分别表示p<0.05、p<0.01水平上差异显著(t.test,SPSS 22.0)。图5同。
从图5看出,两个处理荔枝果实苯丙氨酸解氨酶(PAL)活性总体呈下降趋势。在贮藏前期,对照与拮抗菌N-1处理的PAL活性无显著性差异;贮藏第6天起,对照的PAL活性显著低于拮抗菌N-1处理;在贮藏末期,对照的PAL活性急剧下降,而拮抗菌N-1处理的PAL活性仍能维持在19.48 U/ g·min·FW,是对照的2.75倍(p<0.01)。说明拮抗菌N-1处理能够显著提高并维持荔枝果实的PAL高水平。
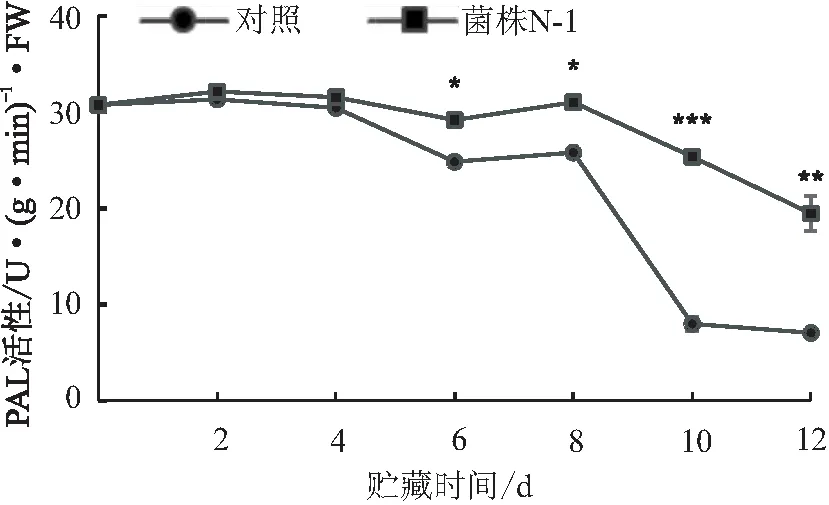
注:***表示p<0.001水平上差异显著(t.test,SPSS 22.0)。
3 结论与讨论
海南省气候湿润,常年高温多雨季,这为热带水果采后致病菌的生长繁殖提供了适宜条件,对热带水果贮运非常不利。杧果、荔枝、番木瓜、莲雾、龙眼、杨桃、香蕉、火龙果等都是海南的主要经济作物,其采后病菌复杂多样。目前,杧果、番木瓜常见病原菌有胶孢炭疽菌Colletotrichumgloeosporioides,荔枝常见病原菌有霜疫霉(Peronophythora),莲雾果实常见病原菌有小孢拟盘多毛孢Pestalotiopsismicrospora[21-24]。面对热带地区水果采后病害高发的现状,由于化学杀菌剂可能导致病原菌的抗性增加、化学物质残留和环境污染等问题,使用化学杀菌剂不再是可行的办法。因此,环境友好型的生物防治被认为是控制热带水果采后病害主要致病菌的合适选择。Abdallah等[25]的研究结果表明,从野生茄科茎组织中分离出的多种芽孢杆菌可有效控制番茄青枯病。Damasceno等[26]发现贝莱斯芽孢杆菌Bacillusvelezensis对病菌感染具有优异的抑制作用。本研究筛选获得拮抗能力最佳的菌株N-1,通过形态学和分子生物学方法鉴定为暹罗芽孢杆菌Bacillussiamensis,该菌最适在30 ℃,pH值7.0的条件生长。
许多研究表明,芽孢杆菌能够作用于多种果蔬,发挥抑制病原菌生长、降低发病率的作用。李培中等[27]从豆腐乳中分离到1株枯草芽孢杆菌CF-2,它对水蜜桃采后病害交链孢霉、桃褐腐菌、复端孢霉与丝核菌具有较好抑制效果,在贮藏试验中有效提升水蜜桃好果率。此外,Valdivia等[28]分离并鉴定了1株新型萎缩芽孢杆菌,能够显著降低采后贮藏期番荔枝和牛油果炭疽病病原菌的侵染。这可能与拮抗菌生长过程中分泌的某些抗菌代谢物质有关。国内外学者也进行了相应机理的探究,解淀粉芽孢杆菌SR1可以分泌脂肽等物质,对茄格孢菌和尖孢镰刀菌等一系列植物病原真菌具有较强的抗菌活性[29]。在本研究中,经拮抗菌N-1浸泡处理,荔枝果实采后腐烂率显著降低,好果率保持稳定。同时,拮抗菌处理的果实抗病相关酶PPO、POD、PAL活性变化明显。拮抗菌处理的荔枝果实PPO活性显著低于对照,拮抗菌的参与有效减少了贮藏期PPO对果实的不良影响;拮抗菌处理的POD和PAL活性显著高于对照,表明拮抗菌提升了酶活性,更好地参与抗病进程。
综上所述,暹罗芽孢杆菌(B.siamensis)能够作用于热带水果采后多种病原菌,具有较强的拮抗能力,其拮抗广谱性有待进一步研究。暹罗芽孢杆菌能够显著抑制采后贮藏期荔枝果实腐烂情况的发生,提升好果率;同时诱导果实抗病相关酶POD、PAL活性提高,有效降低PPO对采后果实贮藏的不利影响,从而可延长采后荔枝果实贮藏期,这为热带水果采后病害生物防治及防治机理的研究提供了参考。

