超高效液相色谱—三重四级杆质谱联用法同时定量荔枝果实组织中IAA和ABA
徐 婧,王 丹,陈庆欣,张艳青,王 俊,赵明磊,2,李建国,2
(1 华南农业大学园艺学院,广州,510642;2 广东省荔枝工程技术研究中心,广州,510642)
植物内源激素是植物自身代谢产生的、能够从产生部位移动到作用部位,并调节植物生长发育的具有生理活性的有机物质[1],其在植物体中的含量极低,一般为组织鲜重的10-9~10-7[2],性质不稳定[3];但在植物生长发育中发挥着重要作用,它几乎参与了植物从种子休眠、萌发到植物营养生长、生殖生长,以及成熟和衰老的整个生命过程[4]。植物细胞的生理活动由多种激素共同参与,存在着错综复杂的交互作用[5],一般研究植物激素与植物生长发育之间关系最直接的方法是确定植物内源激素含量变化与表型变化的关系,因此,开发建立快速有效精确定量植物内源激素的方法一直是该研究领域热点。
荔枝LitchichinensisSonn.是我国亚热带地区大宗果树,经济价值颇高,产量低而不稳定是限制其产业健康发展的瓶颈问题。花芽分化和果实发育均与其内源激素含量和变化动态有密切关系[6-8]。
目前,荔枝内源激素定量方法主要有酶联免疫法和高效液相色谱法[9-10],其定量结果往往差异大、重复性差。液相色谱质谱联用(LC-MS)技术是将色谱的高分离能力与质谱的高选择性、高灵敏度[11]相结合定量微量物质的一种技术,该技术能够直接得到待测物质结构与相对分子量,克服了传统色谱技术在植物激素定性和定量分析方面的不足,是目前公认的高效快速高精确测定植物内源激素的方法[12]。目前,鲜见采用LC-MS技术测定荔枝器官或组织内源激素的报道。本研究以荔枝果实为材料,首次建立了超高效液相色谱—三重四级杆质谱联用仪(UPLC-MS/MS)同时测定果实中吲哚-3-乙酸(IAA)和脱落酸(ABA)的检测方法,为相关研究提供参考。
1 材料与方法
1.1 材料
对广东省深圳市西丽果场果园“怀枝”荔枝,选取长势相似、挂果量相当的3株供试,每株为1个重复。各时期分别在每株东南西北等方位结果母枝取果实5个,花后25 d幼果用于方法研究,采前1个月果实分为果皮、果肉、种子(见图1),用于方法验证;用冰盒带回实验室,液氮速冻并放于-80 ℃冰箱备用。

图1 “怀枝”荔枝果实样品
1.2 仪器与试剂
超高效液相色谱—三重四级杆质谱联用仪(Waters Acquity UPLC XEVO TQD-MS/MS),沃特世公司产;Thermo Scientific Sorvall LYNX高速落地离心机,赛默飞公司产;振荡器,Eppendorf公司产;超声仪,Scientz公司产。
标准品:IAA、ABA,上海源叶生物科技有限公司产;13C6-IAA,Cambridge Isotope Laboratories(剑桥标准品生产商产);D6-ABA,Toronto Research Chemicals(多伦多化学研究公司产)。0.22 μm微孔滤膜,津腾实验设备有限公司产;甲酸、乙腈、甲醇、质谱纯,FISHER公司产;丙酮、乙酸乙酯、异丙醇、二氯甲烷、三氯甲烷、乙醚、石油醚,分析纯,天津市富宇精细化工有限公司产。
1.3 标准溶液的配置
分别准确称取IAA、ABA、13C6-IAA、D6-ABA标准品1 mg于5 mL玻璃瓶中,用纯甲醇定容,配制成1 ng/mL储备液,密封储存于-20 ℃冰箱中,用时稀释成一系列质量浓度的标准溶液。
1.4 色谱和质谱条件
色谱条件:Waters公司BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),流动相A为0.1%(V∶V)甲酸水溶液,流动相B为0.1%(V∶V)甲酸乙腈溶液,梯度洗脱程序:0 min,85%A+15%B;2.5 min,10%A+90%B;0.25~3 min,10%A+90%B;3~5 min,85%A+15%B;流速0.4 mL/min。
质谱条件:电喷雾离子源(ESI),毛细管电压为2.80 kV,源温110 ℃,脱溶剂气温度400 ℃,脱溶剂气流速800 L/h,锥孔气流50 L/h,扫描方式为多重反应监测(MRM)模式,质谱参数见表1。

表1 吲哚-3-乙酸(IAA)和脱落酸(ABA)及其内标的质谱参数
1.5 待测样品前处理方法
待测样品前处理为内源激素定量过程中最重要的步骤,耗时最长,占整个检测定量时间的80%[13]。主要参考邓文红等[14-15]和李金克等[16]方法,以花后25 d幼果为材料,分别测定不同抗氧化剂,即2,6-二叔丁基对甲酚BHT、维生素C;提取剂,即异丙醇∶水∶浓盐酸(体积比2∶1∶0.002)、80%甲醇、80%丙酮;除色剂,即石油醚、三氯甲烷;萃取剂,即二氯甲烷、乙醚、乙酸乙酯;pH值,即在加除色剂石油醚前调节pH值至8、在加萃取剂乙酸乙酯前调节pH值至3;及不同提取方式,即Eppendorf振荡器4 ℃ 850 r/min常规振荡30 min、低温Scientz超声仪功率30 W频率40 kHz超声提取10 min对目标物IAA和ABA保留行为及富集效果的影响,筛选出适合荔枝果实样品前处理流程。
即取荔枝果实鲜样液氮研磨至粉状,称取0.5 g至离心管,加入提取液3 mL,100 ng内标,低温震荡30 min;4 ℃,10 000 r/min,离心10 min;取上清液,弃下层,氮吹仪浓缩至水相,加入1 mol/L NaOH调节pH值至8~9,加入石油醚2 mL,低温震荡10 min;4 ℃,6 000 r/min,离心5 min;弃醚相,留水相,加入石油醚2 mL,低温震荡10 min;4 ℃,6 000 r/min,离心5 min;弃醚相,留水相,加入甲酸调节pH值至2~3,再加入乙酸乙酯2 mL;4 ℃,6 000 r/min,离心5 min;将上层乙酸乙酯移至新离心管,加入乙酸乙酯2 mL,低温震荡10 min;4 ℃,6 000 r/min,离心5 min;合并两次乙酸乙酯,氮吹仪吹干,80%甲醇溶解,过0.22 μm微孔滤膜,上机测样。
1.6 方法的准确度及精密度实验
配置0~500 ng/mL系列标准溶液,分别加入等量的相应内标标准溶液,使其内标浓度为100 ng/mL,按照上述色质谱条件依次分析各标准溶液,以标准品峰面积和内标峰面积的比为纵坐标,标准品浓度和内标浓度比为横坐标作图,绘制标准曲线计算各内源激素的回归方程。对5 ng/mL IAA、ABA混合标准溶液进行测定,按S/N=3和S/N=10来确定方法的检出限(LOD)和定量限(LOQ);以怀枝荔枝果皮做方法准确度试验,重复3次,计算相对标准偏差。
2 结果与分析
2.1 IAA和ABA的UPLC-MS/MS的总离子色谱图
测定4种混合标样(500 ng/mL)在设定的色谱—质谱条件(1.4)下的保留情况,其中横座标是出峰时间,纵座标是峰高,4种标准品的色谱峰几乎均为宝塔状,峰型尖锐、平滑。IAA及其同位素内标物出峰时间为1.64 min,ABA及其同位素内标物出峰时间为1.82 min(见图2)。说明4种标准品在本实验设定的色谱和质谱条件下能有稳定出峰时间及峰型。
2.2 前处理萃取方法选择
目前的萃取方法一般有液液萃取、有机溶剂萃取、固相萃取、液固萃取等,我们选取液液萃取外标法、分散液液微萃取外标法、液液萃取内标法进行比较试验。
试验结果可以看出,液液萃取外标法虽然操作简单、用时短,但是裂峰杂峰多,无法检测到目标物。分散液液微萃取外标法虽然有机试剂使用少,比较环保,但是操作复杂繁琐且只能检测到ABA(见表2)。液液萃取内标法操作简单,分别在1.64 min和1.82 min有IAA和ABA特征峰出现(见图3),且峰型平滑尖锐、无杂峰,响应值分别为5.68 e4和8.60 e4,较其他两个方法高;且该方法无需做回收率试验,节省操作时间,唯一的缺点是有机试剂使用量大。由此可以确定液液萃取内标法对ABA和IAA的富集效果较好。

图2 吲哚-3-乙酸(IAA)和脱落酸(ABA)标准品及其内标物总离子色谱

图3 经过液液萃取前处理的荔枝果实吲哚-3-乙酸(IAA)和脱落酸(ABA)总离子色谱

表2 荔枝果实吲哚-3-乙酸(IAA)和脱落酸(ABA)的3种萃取方法比较
2.3 前处理条件优化
为了筛选适合荔枝果实样品前处理流程,比较了不同抗氧化剂、提取剂、除色剂、萃取剂、pH值调节和提取方式对IAA和ABA出峰面积的影响。添加抗氧化剂2,6-二叔丁基对甲酚BHT和维生素C处理的ABA出峰面积无显著性差异,但添加抗氧化剂处理的IAA出峰面积显著低于对照(无抗氧化剂),故提取时无需添加抗氧化剂。使用80%丙酮作为提取剂,IAA和ABA均有较高提取率;使用石油醚作为除色剂,少量多次萃取能除去一定的色素,且IAA和ABA均有较高响应,因此石油醚可以替代高毒、高污染的三氯甲烷。乙酸乙酯作为萃取剂对IAA的萃取率显著高于二氯甲烷和乙醚;二氯甲烷对ABA的萃取率最高,综合比较,选择乙酸乙酯作为萃取剂为宜。通过控制pH值,两种内源激素的峰面积与不调节pH值处理时有显著性差异,表明控制pH值能明显减少两种内源激素的损失。常规振荡提取IAA和ABA峰面积均显著高于超声振荡提取(见图4—图6)。因此,前处理条件优化为提取剂、除色剂和萃取剂分别使用80%丙酮、石油醚和乙酸乙酯,并且在加除色剂石油醚前调节pH值至8,在加萃取剂乙酸乙酯前调节pH值至3,常规Eppendorf振荡器4 ℃ 850 r/min振荡30 min提取。
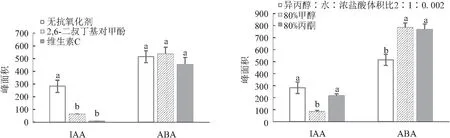
注:不同小写字母表示处理间在0.05水平差异显著(LSD法多重比较,n=3)。图5和图6同。
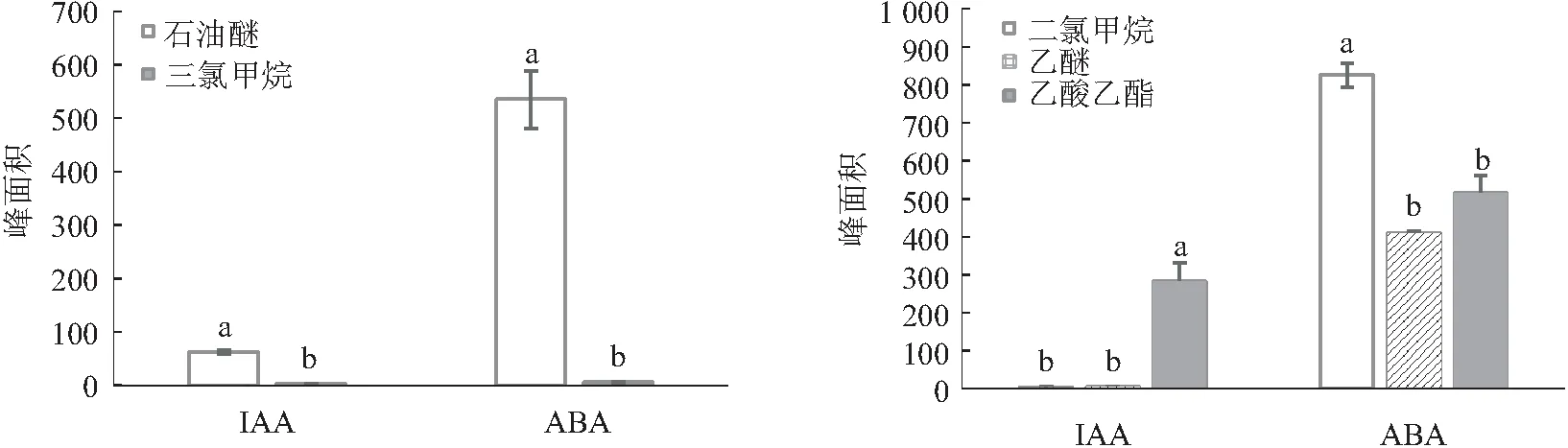
图5 不同除色剂和萃取剂对荔枝果实吲哚-3-乙酸(IAA)和脱落酸(ABA)出峰面积的影响
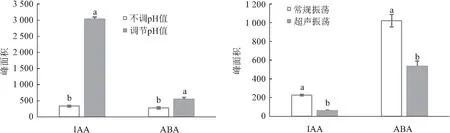
图6 调节pH值和不同提取方式对荔枝果实吲哚-3-乙酸(IAA)和脱落酸(ABA)出峰面积的影响
2.4 方法准确度及精密度考察
试验结果看出,IAA线性范围0~500 ng/mL,线性回归方程为y=2.065 8x-0.119 4,相关系数r为0.998 9,相对标准偏差为3.75%,检出限为0.283 pg/μL(S/N=3),定量限为0.339 pg/μL(S/N=10);ABA线性范围也是0~500 ng/mL,线性回归方程为y= 0.667 1x-0.034,相关系数r为0.999 5,相对标准偏差为1.38%,检出限为0.102 pg/μL(S/N=3),定量限为0.943 pg/μL(S/N=10)。两者相对标准偏差(RSD,n=3)均小于4%(见图7),表明该方法有良好的准确度和精密度。

图7 吲哚-3-乙酸(IAA)和脱落酸(ABA)的标准曲线
以荔枝花后25 d幼果为材料,进行处理前加标回收率试验,每组添加水平重复3次。低中高3种添加水平(IAA的添加水平为50、200、400 ng/g,ABA的添加水平为100、1 000、2 000)的加标回收率结果显示,IAA平均加标回收率为84.1%,ABA平均加标回收率为78.33%。
2.5 方法验证
采用建立的UPLC—MS/MS方法,分析测定了25 d幼果及果实快速膨大期间(采前约1个月)果皮、果肉和种子中的IAA和ABA含量,内标回收率达到52.82%~83.15%。发现幼果IAA含量为207.55 ng/g,ABA含量为1 173.83 ng/g,与周碧燕等[9]采用酶联免疫方法测得的幼果数据差别较大(IAA为26 000~70 000 ng/g,ABA为1 600~5 500 ng/g)。果实快速膨大期果肉中IAA含量极低,只有6.31 ng/g,显著低于果皮和种子中IAA含量;但ABA含量极高,为1 543.77 ng/g,显著高于果皮和种子。果皮和种子IAA和ABA含量差异均不显著(见表3),而周碧燕等[9]测定的采前1个月果皮和种子IAA含量差异小,ABA含量差异大。
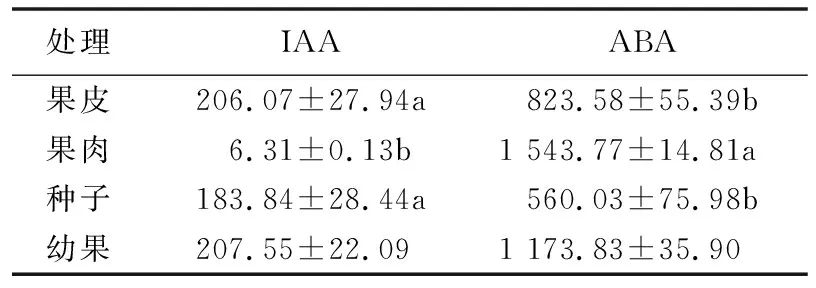
表3 “怀枝”荔枝幼果及果皮、果肉和种子中吲哚-3-乙酸(IAA)和脱落酸(ABA)含量比较
3 结论与讨论
定量测定荔枝果实内源激素主要采用酶联免疫、高压液相色谱或气相色谱等方法,测定结果存在很大差异。周碧燕等[9]采用酶联免疫方法测得谢花后80 d内正常发育的“无核荔”果实IAA约为4 400~70 000 ng/g,ABA约为2 600~16 000 ng/g;但李伟才等[10]采用高效液相方法测得谢花后70 d内正常发育的“无核荔”果实IAA为 5~70 ng/g,ABA为2 000~9 000 ng/g。说明这两种方法测定结果差异巨大,测定结果准确性差。液质联用法(LC-MS)因具有灵敏度高、选择性强、速度快且无需复杂衍生前处理,以及能同时定量多种激素等优势,目前已成为植物内源激素检测主流方法[17]。在荔枝内源激素的定量检测中,检测仪器、定量方法和前处理技术都是决定精确检测荔枝样品中IAA和ABA含量的重要因素。本研究中优化采用内标法,可以校正基质效应,以及折算前处理的损失,定量的可靠性比外标法高。内标法对内标物的选择要求很高,一般会选择其同位素做内标物。本研究IAA内标选择13C6-IAA,其相比于其他氘标记的同位素IAA更加稳定,在经过质谱碎裂后不会出现同位素丢失现象[18],Barkawi等[19]以13C6-IAA作为内标精确定量了拟南芥中IAA的含量。
材料前处理是最关键的一步,荔枝含有丰富的糖、酚类,在空气中极易氧化褐变,其性质就决定了荔枝内源激素样品提取的难度。在荔枝样品前处理方法探索中,使用液液萃取作为纯化和富集的主要技术,这不仅简化步骤,而且节约成本。采用邓文红等[16]提取定量分析油蒿叶片4种内源激素的前处理方法,结果显示两种激素均出现峰形不完整、裂峰、杂峰等情况,无法定量。说明不同植物样品通过相同提取液所得的初提取液基质不一样,经过同样的纯化步骤可能无法保证样品纯度,再者不同植物样品内源激素含量差异大,因此,同样的方法无法在不同植物样品得到满意结果。
IAA和ABA都是酸性内源激素,其pKa值分别为4.75和4.8,除色纯化步骤可以根据两种内源激素的pKa值,将提取液pH值调整到8~9,使两者均以离子形态存于水中而减少被石油醚萃取损失;而当用乙酸乙酯萃取时,又调pH值到2~3,使两者以分子形式存在,尽可能被乙酸乙酯萃取,因此可以通过调节溶液的pH值来改变内源激素IAA和ABA两种物质在提取液中的存在状态,从而提高回收率且减少损失。吴耕西等[20]测定苹果叶片中IAA和ABA也是采用这种方式,达到了纯化和富集目的。
通过一系列的条件优化,最后建立同时分析测定荔枝果实中IAA和ABA两种内源激素的方法。即样品经预冷的80%丙酮常规振荡浸提,石油醚纯化(纯化前调pH值至8~9),乙酸乙酯萃取(加萃取剂前调pH值至2~3),氮吹仪浓缩,80%甲醇复溶,反相C18柱分离,流动相为0.1% 甲酸水和0.1%甲酸乙腈,梯度洗脱,添加同位素13C6-IAA和D6-ABA做内标,内标法定量。结果显示,两种激素及其内标物峰形较好,保留时间稳定。IAA检出限为0.283 pg/μL,定量限为0.339 pg/μL,平均加标回收率达到84.17%;ABA检出限为0.102 pg/μL,定量限为0.943 pg/μL,平均加标回收率达到78.33%。对实际样品中IAA和ABA进行测定,结果显示其相对标准偏差分别为3.75%和1.38%,说明该方法精确、快速、试验重现性好,适用于荔枝各组织中内源激素含量的检测。

