贮藏期柚粒化过程中果实总细胞壁物质积累和维管束超微结构的变化
卢艳清,林燕金,卢新坤
(福建省农业科学院 果树研究所,福州 350000)
柑橘类果实粒化是世界柑橘产业中存在的一类生理失调病害,主要表现为汁胞硬度增加,食用品质降低。许多柑橘类果实均存在汁胞粒化现象,例如,橙(CitrussinensisL. Osbeck)、橘(CitrusreticulataBlanco)、葡萄柚(CitrusparadisiMacf.)[1]。据报道,脐橙果实粒化率超过80%[2],宽皮柑橘果实粒化率达到62.5%[3]。
在柑橘类果实粒化过程中汁胞生理代谢的变化得到广泛关注。现已证明柑橘类果实粒化汁胞中木质素、纤维素、半纤维素和果胶含量提高[4-5],汁胞粒化的实质是次生细胞壁的加厚[6-7]。目前发现了一些与汁胞粒化相关的酶。‘琯溪蜜柚’(CitrusgrandisL. Osbeck)汁胞苯丙氨酸解氨酶(PAL)、肉桂醇脱氢酶(CAD)和过氧化物酶(POD)活性提高伴随着汁胞木质素含量和粒化指数的升高[8]。HRB(柑橘三倍体株系)果实汁胞细胞壁木质化,细胞壁明显加厚,而汁胞过氧化物酶(POD)活性和肉桂酸-4-羟化酶(C4H)基因转录水平均显著提高[9]。PAL[10]、CAD[11]、POD[12]和C4H[13]均是木质素合成途径中的酶。另外,‘琯溪蜜柚’汁胞果胶甲酯酶(PE)、多聚半乳糖醛酸酶(PG)和纤维素酶(Cx)活性低,伴随着细胞壁物质(原果胶、纤维素、半纤维素)含量的提高[14]。PE[15]、PG[16]和Cx[17]均为细胞壁降解酶类。从而可见,粒化汁胞中细胞壁物质代谢途径受到明显影响,从而引起细胞壁物质含量的变化。最近,从甜橙中发现几个能够调控汁胞木质素积累的MYB转录因子。甜橙CsMYB330(转录激活子)和CsMYB308(转录抑制子)能够与4-香豆酸∶辅酶A连接酶基因(Cs4CL1)启动子的AC 元件结合,调控Cs4CL1 的表达[18]。之后发现CsMYB85与CsMYB330 启动子结合,调控CsMYB330 的表达;CsMYB85过量表达时汁胞Cs4CL1表达量和木质素含量均显著提高[19]。以上研究揭示了粒化汁胞中细胞壁物质含量提高的原因。
然而除汁胞外,柑橘类果实粒化过程中果皮的生理代谢也产生变化。‘温州蜜柑’(CitrusunshiuMarc.)果皮超氧化物歧化酶和过氧化氢酶活性低引发果实粒化[20]。另外,在粒化的‘黄果柑’(CitrusreticulataBlanco ×CitrussinensisL. Osbeck)果皮中发现果胶、可溶性果胶、纤维素、木质素含量提高[21]。表明果皮生理代谢的变化与汁胞粒化相关。
柑橘类果实主要包括果实维管束、果皮、囊衣和汁胞几个部分。每个汁胞都通过或长或短的柔软丝柄着生于果实维管束,而维管束在囊衣和果皮中均有分布。基于柑橘类果实的结构特征和已有报道,在果实粒化进程中协同观测不同果实组织间生理代谢的改变可能更有利于粒化机理的揭示。目前,在果实粒化过程中果实维管束和囊衣是否也出现明显的生理代谢变化,以及汁胞和汁胞以外的果实组织各自生理代谢产生明显变化的时间顺序尚不明晰。
本试验以室温贮藏的成熟‘琯溪蜜柚’为材料,将果实分为6个部分:背面维管束、侧面维管束、果皮、囊衣、背面维管束汁胞和侧面维管束汁胞。主要通过测定背面维管束汁胞、侧面维管束汁胞、囊衣和果皮总细胞壁物质含量,以及观察果实背面维管束和侧面维管束超微结构的变化趋势,揭示柚汁胞粒化过程中不同果实组织是否均存在细胞壁物质积累现象及其积累顺序,为深入揭示柑橘类果实汁胞粒化机理奠定基础。
1 材料和方法
1.1 试验材料
‘琯溪蜜柚’成熟期果实于2016年10月30日取自福建省平和县小溪镇商品果园,选择10株树势较为一致的树,从树冠外围中部取15个果实,共150个。果实放置于实验室内,自然温度条件下(无控温处理)贮藏60 d。设3个生物学重复,每个重复50个果实。在每个取样时期从每个重复选取3个果实,共取9个果实。将每个果实每个囊瓣的背面维管束汁胞和侧面维管束汁胞分别取下,之后将每个生物学重复的两类汁胞分别混合均匀。将每个果实的每个囊瓣外围的囊衣取下,之后将每个生物学重复的囊衣切成小块混合均匀。同样,将每个生物学重复的果皮切成小块后混合均匀。在60 d贮藏期内,每隔5 d取背面维管束汁胞和侧面维管束汁胞(图1),用于测定可溶性固形物含量。将贮藏0、10、20、30、40、50和60 d果实的背面维管束汁胞、侧面维管束汁胞、囊衣和果皮保存于-80 ℃冰箱,用于测定总细胞壁物质含量。将0、10、20、40和60 d果实背面维管束和侧面维管束切成2~3 mm长的小段,立即浸于3.5%戊二醛固定液[戊二醛溶于0.2%的磷酸缓冲液(pH 7.2)]中,4 ℃固定2 d,用于制作透射电子显微镜超薄切片。
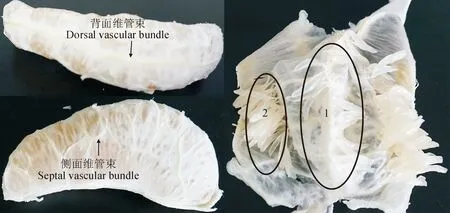
1标示为背面维管束汁胞,2标示为侧面维管束汁胞[10]图1 琯溪蜜柚果实2类汁胞的分类The region marked by 1 indicates juice sacs isolated from the dorsal vascular bundles, the region marked by 2 indicates juice sacs isolated from the septal vascular bundles[10]Fig.1 Illustration of two types of juice sacs of ‘Guanxi’ pummelo fruit
1.2 总细胞壁物质含量的测定
总细胞壁物质含量的测定参照Ookawa等[11]的方法。称取液氮研磨的果实样品3 g置10 mL离心管,加80%乙醇6 mL,80 ℃水浴浸提30 min,在15 000 g、4 ℃条件下离心10 min,弃上清液。向沉淀中加6 mL 80%乙醇,重复浸提2次。之后向沉淀中加80%甲醇6 mL,室温放置30 min,相同条件下离心弃上清液,沉淀重复浸提2次。最后向沉淀中加正己烷6 mL,室温放置30 min,相同条件下离心弃上清液,沉淀重复浸提2次。从而去除样品的糖、脂质、色素物质。在80 ℃条件下将沉淀烘至恒重,记录沉淀总重量(W1)。
称取烘干的沉淀20 mg(W2)置2 mL离心管,加15 U·mL-1的α-淀粉酶(芽孢杆菌)溶液1 mL,在85 ℃条件下放置30 min,以使淀粉降解,在15 000 g、4 ℃条件下离心10 min,弃上清液。加1.5 mL去离子水清洗沉淀,重复清洗1次。在80 ℃条件下将沉淀烘至恒重,记录沉淀重量(W3)。总细胞壁物质含量(mg·g-1)=W3×(W1/W2)/样品鲜重。
1.3 可溶性固形物含量的测定
用手持测糖仪测定汁胞可溶性固形物含量。
1.4 透射电子显微镜超薄切片的制作和观察
用0.2%磷酸缓冲液洗戊二醛溶液固定的样品15 min,重复冲洗2次。样品转至含1%锇酸和1.5%亚铁氰化钾溶液,4 ℃后固定1.5 h。用0.2%磷酸缓冲液冲洗样品15 min,重复冲洗4次。样品放于乙醇和丙酮梯度溶液脱水:50%乙醇15 min,70%乙醇过夜,90%乙醇15 min,90%乙醇和丙酮(V/V,1∶1)混合溶液15 min,90%丙酮溶液15 min,无水丙酮15 min。脱水样品放于无水丙酮和环氧树脂618(V/V, 1∶1)混合物中渗透1.5 h,之后在35 ℃ 条件下,放于纯环氧树脂618中3 h。最后用纯环氧树脂618包埋样品:35 ℃聚合12 h,45 ℃保持12 h,60 ℃保持2~3 h。用超薄切片机(Leica EMUC7,韦茨拉尔,德国)切取厚度为90 nm的切片。切片用2%乙酸双氧铀染色20 min,柠檬酸铅染色3 min。应用透射电子显微镜(Hitachi HT7700,东京,日本)观察细胞超微结构(80 kV条件下)。
2 结果与分析
2.1 柚果实不同组织总细胞壁物质含量的变化趋势
在整个贮藏期内背面维管束汁胞总细胞壁物质含量无显著变化。然而从贮藏40至60 d,侧面维管束汁胞总细胞壁物质含量显著升高。囊衣和果皮总细胞壁物质含量的变化趋势相同,均从贮藏20至60 d显著提高(图2)。
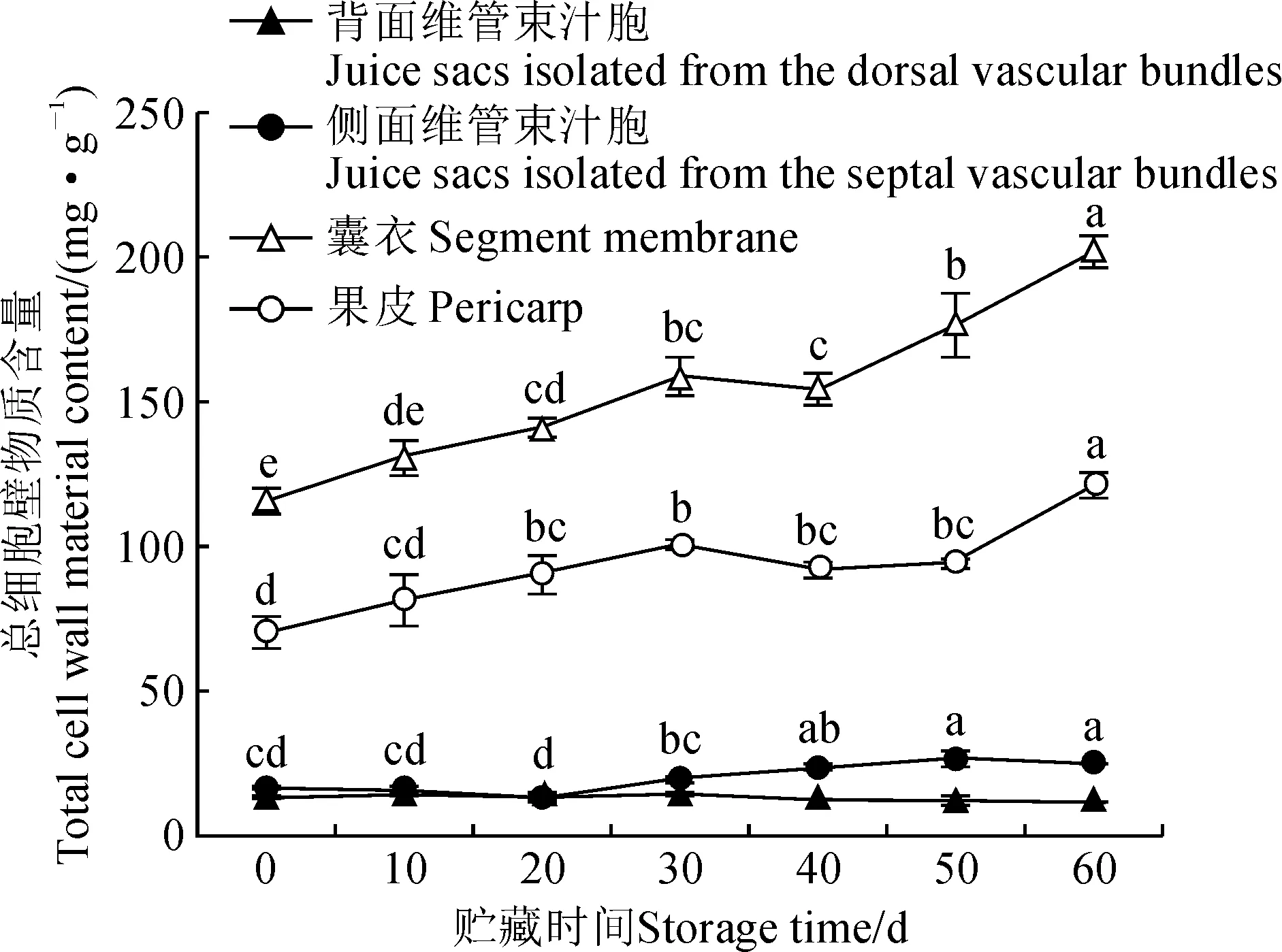
小写字母表示不同贮藏时期之间的差异(P<0.05)图2 贮藏期琯溪蜜柚果实组织总细胞壁物质含量The normal letters represent the differences among stages (P <0.05)Fig.2 Total cell wall material contents of fruit segments of ‘Guanxi’ pummelo fruits during storage
通过对每个贮藏阶段不同组织间总细胞壁物质含量的比较发现,至贮藏30 d时,两类汁胞总细胞壁物质含量无显著差异,然而在贮藏40和60 d时,侧面维管束汁胞总细胞壁物质含量显著高于背面维管束(贮藏50 d时显著差异暂时消失);在整个贮藏期内,尽管果皮总细胞壁物质含量始终显著高于两类汁胞,但始终显著低于囊衣。
2.2 柚果实汁胞可溶性固形物含量的变化趋势
图3显示,在贮藏期内背面维管束汁胞可溶性固形物含量始终无显著变化,而侧面维管束汁胞可溶性固形物含量从贮藏40至60 d持续显著降低。至贮藏35 d时,背面维管束汁胞可溶性固形物含量显著低于侧面维管束汁胞(20 d除外),但之后与侧面维管束汁胞间无明显差异。
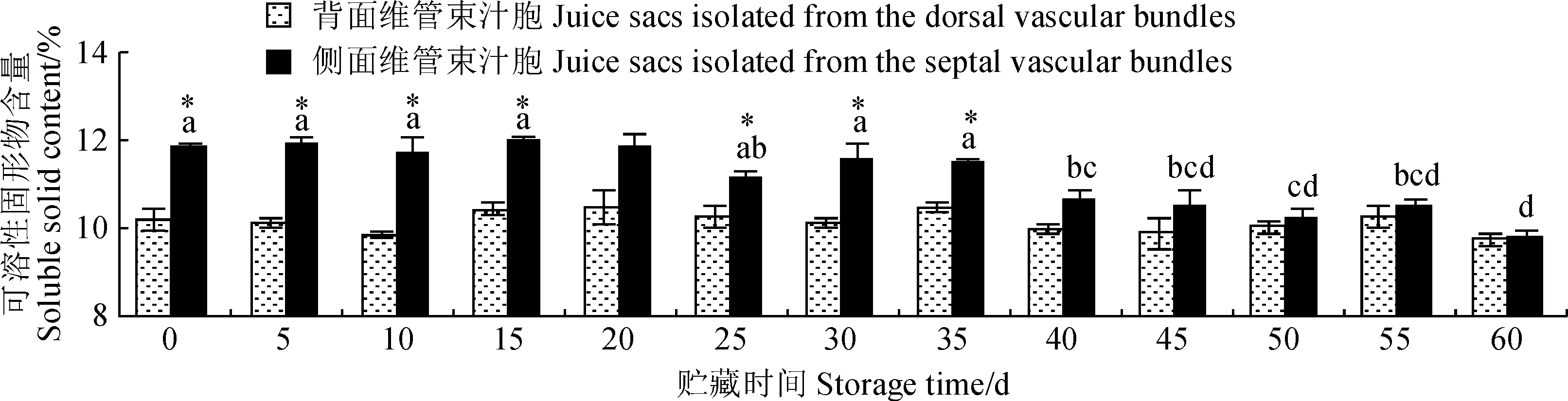
小写字母表示不同贮藏时期之间的差异显著(P <0.05),*表示同一时期两类汁胞之间的差异显著(P <0.05)图3 贮藏期琯溪蜜柚果实背面维管束汁胞和侧面维管束汁胞可溶性固形物含量The normal letters represent the differences among stages (P<0.05). Asterisks represent the significant differences between the two types of juice sacs at each stage (P<0.05)Fig.3 Soluble solid contents of juice sacs isolated from the dorsal and the septal vascular bundles of ‘Guanxi’ pummelo fruits during storage
2.3 柚果实背面维管束和侧面维管束超微结构变化
2.3.1 柚果实维管束筛管-伴胞复合体、韧皮部薄壁细胞和导管的分布柚果实背面维管束的导管位于中部,筛管-伴胞复合体和韧皮部薄壁细胞分布在导管两侧(图4,A);侧面维管束三类细胞分布模式与背面维管束相同(图4,B)。不同的是背面维管束导管明显大于侧面维管束。

Se-Cc. 筛管-伴胞复合体;P. 韧皮部薄壁细胞区域;V. 导管区域图4 琯溪蜜柚果实背面维管束(A)和侧面维管束(B)的筛管-伴胞复合体、韧皮部薄壁细胞和导管的分布Se-Cc. Sieve tube-companion cell complexes; P. Phloem parenchyma cells; V. VesselsFig.4 Distribution pattern of the sieve tube-companion cell complexes, phloem parenchyma cells, and vessels in the dorsal (A) and the septal (B) vascular bundles of ‘Guanxi’ pummelo fruits
2.3.2 柚果实维管束筛管和伴胞的次生细胞壁加厚过程在贮藏始期,柚果实背面维管束和侧面维管束筛管和伴胞的结构特征类似。伴胞的细胞质浓缩,沿细胞壁分布。筛管和伴胞内部空间分布着浓密的细胞壁物质,筛管细胞壁内侧次生细胞壁沉积,形成蘑菇状突起(图5)。贮藏10 d,柚果实两类维管束筛管内部空间细胞壁物质减少,但次生细胞壁明显加厚;伴胞细胞壁内侧也观察到明显的次生细胞壁,但内部空间仍分布着大量的细胞壁物质(图6)。贮藏20 d,在两类维管束筛管-伴胞区域出现不规则形状的黑色聚集物,主要分布在细胞壁部位(图7,a、d、c、f)。同时观察到筛管次生细胞壁沿着初生细胞壁延展,且趋于合拢(图7,a、d),但染色深度比贮藏10 d时明显变浅(图7,b、e)。此期两类维管束伴胞结构特征与贮藏10 d时类似(图7,c、f)。贮藏40 d,背面维管束筛管-伴胞区域的不规则形状黑色聚集物已消失,但在侧面维管束筛管-伴胞区域仍可观察到此类物质,且其外形比贮藏20 d时增长,不仅分布在细胞壁区域,也延展至细胞内部空间(图8,a、c)。同时观察到背面维管束筛管和伴胞次生细胞壁染色深度重于侧面维管束(图8,b、f)。由于两类维管束筛管次生细胞壁的沉积和扩展,导致纹孔的形成,纹孔室由纹孔膜(图8,d、h)隔开。
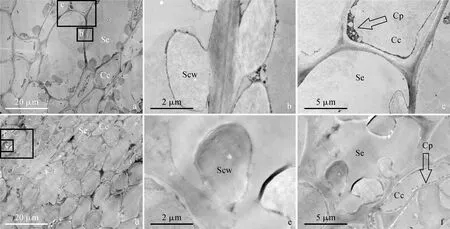
a. 背面维管束筛管和伴胞;b、c. 图a中矩形框标注部位的放大图;d. 侧面维管束筛管和伴胞;e、f. 图d矩形框标注部位的放大图;Se. 筛管;Cc. 伴胞;Scw. 次生细胞壁;Cp. 细胞质图5 贮藏0 d时琯溪蜜柚果实背面维管束(a-c)和侧面维管束(d-f)的筛管和伴胞a. Sieve tube and companion cells of the dorsal vascular bundle; b and c. Magnified micrographs of the regions marked by rectangles in a; d. Sieve tube and companion cells of the septal vascular bundle; e and f. Magnified micrographs of the regions marked by rectangles in d; Se. Sieve tube cell; Cc. Companion cell; Scw. Secondary cell wall; Cp. CytoplasmFig.5 Sieve tube and companion cells of the dorsal (a-c) and the septal (d-f) vascular bundles of ‘Guanxi’ pummelo fruits at 0 day of storage
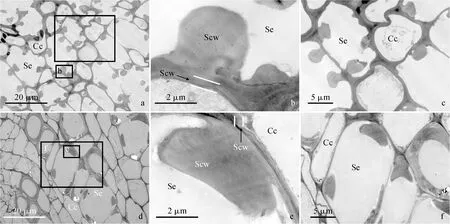
a. 背面维管束筛管和伴胞;b、c. 图a矩形框标注区域的放大图;d. 侧面维管束筛管和伴胞;e、f. 图d矩形框标注区域的放大图;Se. 筛管;Cc. 伴胞;Scw. 次生细胞壁图6 贮藏10 d时琯溪蜜柚果实背面维管束(a-c)和侧面维管束(d-f)的筛管和伴胞a. Sieve tube and companion cells of the dorsal vascular bundle; b and c. Magnified micrographs of the regions marked by rectangles in a; d. Sieve tube and companion cells of the septal vascular bundle; e and f. Magnified micrographs of the regions marked by rectangles in d; Se. Sieve tube cell; Cc. Companion cell; Scw. Secondary cell wallFig.6 Sieve tube and companion cells of the dorsal (a-c) and the septal (d-f) vascular bundles of ‘Guanxi’ pummelo fruits at 10 days of storage

a. 背面维管束筛管和伴胞;b、c. 图a矩形框标注区域的放大图;d. 侧面维管束筛管和伴胞;e、f. 图d矩形框标注区域的放大图;Se. 筛管;Cc. 伴胞;Scw. 次生细胞壁;Uscw. 即将封闭的次生细胞壁;St. 不规则形状黑色聚集物图7 贮藏20 d时琯溪蜜柚果实背面维管束(a-c)和侧面维管(d-f)束的筛管和伴胞a. Sieve tube and companion cells of the dorsal vascular bundle; b and c. Magnified micrographs of the regions marked by rectangles in a; d. Sieve tube and companion cells of the septal vascular bundle; e and f. Magnified micrographs of the regions marked by rectangles in d; Se. Sieve tube cell; Cc. Companion cell; Scw. Secondary cell wall; Uscw. Primary cell wall is almost fully covered by secondary cell wall; St. Black aggregation with irregular shapeFig.7 Sieve tube and companion cells of the dorsal (a-c) and the septal (d-f) vascular bundles of ‘Guanxi’ pummelo fruits at 20 days of storage

a. 背面维管束筛管和伴胞;b. 图a矩形框标注区域的放大图;c. 背面维管束中次生细胞壁早期加厚的筛管;d. 筛管次生细胞壁的加厚引起纹孔的形成(图c矩形框标注区域的放大图);e. 侧面维管束筛管和伴胞;f. 图e矩形框标注区域的放大图;g. 侧面维管束中次生细胞壁早期加厚的筛管;h. 筛管次生细胞壁加厚引起纹孔的形成(图g矩形框标注区域的放大图);Se. 筛管;Cc. 伴胞;Scw. 次生细胞壁;St. 不规则形状黑色聚集物;1. 纹孔室;2. 纹孔膜图8 贮藏40 d时琯溪蜜柚果实背面维管束(a-d)和侧面维管束(e-h)的筛管和伴胞a. Sieve tube and companion cells of the dorsal vascular bundle; b. Magnified micrograph of the region marked by rectangle in a; c. Earlier secondary thickened sieve tube cells of the dorsal vascular bundle; d. Secondary cell wall thickening leads to pit formation in sieve tube cell (magnified micrograph of the region marked by rectangle in c); e. Sieve tube and companion cells of the septal vascular bundle; f. Magnified micrograph of the region marked by rectangle in e; g. Earlier secondary thickened sieve tube cells of the septal vascular bundle; h. Secondary cell wall thickening leads to pit formation in sieve tube cell (magnified micrograph of the region marked by rectangle in g); Se. Sieve tube cell; Cc. Companion cell; Scw. Secondary cell wall; St. Black aggregation with irregular shape; 1. Pit chamber; 2. Pit membraneFig.8 Sieve tube and companion cells of the dorsal (a-d) and the septal (e-h) vascular bundles of ‘Guanxi’ pummelo fruits at 40 days of storage
贮藏期结束时,侧面维管束筛管-伴胞区域的不规则形状黑色聚集物消失(图9,e)。两类维管束筛管次生细胞壁明显加厚(图9,b、d、f、h)。与贮藏40 d相比,纹孔膜表面沉积了更多的细胞壁物质(图9,d、h)。两类维管束伴胞内部空间仍然分布着细胞壁物质(图9,a、e)。

a. 背面维管束筛管和伴胞;b. 图a矩形框标注区域的放大图;c. 背面维管束中次生细胞壁早期加厚的筛管;d. 筛管次生细胞壁加厚引起纹孔的形成(图c矩形框标注区域的放大图);e. 侧面维管束筛管和伴胞;f. 图e矩形框标注区域的放大图;g. 侧面维管束中次生细胞壁早期加厚的筛管;h. 筛管次生细胞壁加厚引起纹孔的形成(图g矩形框标注区域的放大图);Se. 筛管; Cc. 伴胞;Scw. 次生细胞壁;1. 纹孔室;2. 纹孔膜图9 贮藏60 d时琯溪蜜柚果实背面维管束(a-d)和侧面维管束(e-h)的筛管和伴胞a. Sieve tube and companion cells of the dorsal vascular bundle; b. Magnified micrograph of the region marked by rectangle in a; c. Earlier secondary thickened sieve tube cells of the dorsal vascular bundle; d. Secondary cell wall thickening leads to pit formation in sieve tube cell (magnified micrograph of the region marked by rectangle in c); e. Sieve tube and companion cells of the septal vascular bundle; f. Magnified micrograph of the region marked by rectangle in e; g. Earlier secondary thickened sieve tube cells of the septal vascular bundles; h. Secondary cell wall thickening leads to pit formation in sieve tube cell (magnified micrograph of the region marked by rectangle in g); Se. Sieve tube cell; Cc. Companion cell; Scw. Secondary cell wall; 1. Pit chamber; 2. Pit membraneFig.9 Sieve tube and companion cells of the dorsal (a-d) and the septal (e-h) vascular bundles of ‘Guanxi’ pummelo fruits at 60 days of storage
2.3.3 柚果实维管束韧皮部薄壁细胞次生细胞壁的加厚过程贮藏始期,两类维管束韧皮部薄壁细胞均出现质壁分离现象(图10,a、c)。不仅细胞内部空间分布着细胞壁物质(背面维管束主要是成片的絮状物,侧面维管束除了絮状物外,还分散着纤维丝),而且在细胞壁内侧已有次生细胞壁的沉积(图10,b、d)。贮藏10 d,两类维管束韧皮部薄壁细胞均呈现多类结构特征。背面维管束韧皮部薄壁细胞在质壁分离的同时,出现囊泡和线粒体,同时有大量细胞壁物质分散在细胞壁内部空间(图11,a、b)。另有细胞囊泡增多,细胞溃散(图11,c、d)。最后囊泡和细胞器消失殆尽,细胞内积累大量的细胞壁物质(图11,e、f)。侧面维管束韧皮部薄壁细胞的囊泡和线粒体紧贴细胞壁分布,中央分布着一个大液泡(图11,g、h)。另有细胞质壁分离,细胞质膜局部断裂,中央液泡消失,出现一些小囊泡和线粒体(图11,i、j)。最后细胞溃散,仅剩少量囊泡,细胞壁物质均匀地分布在细胞内部空间(图11,k、l)。两类维管束韧皮部薄壁细胞次生细胞壁均明显加厚。贮藏20 d,两类维管束韧皮部薄壁细胞仍然呈现多类结构特征。背面维管束韧皮部薄壁细胞质壁分离,由于中央大液泡的存在,细胞质紧邻细胞质膜内侧分布(图12,a、b)。另有细胞的中央液泡变多、变小,线粒体增多;液泡、线粒体和高尔基体和细胞壁物质分散在细胞质中(图12,c、d)。细胞质溃散后,细胞壁物质聚集并向细胞壁沉积(图12,e、f)。但这些细胞的胞间连丝仍然存在(图12,b、c、f)。侧面维管束韧皮部细胞的细胞质逐渐降解,但线粒体和高尔基体尚存,同时大量细胞壁物质积累在细胞内部空间(图12,g、h)。另外发现有的细胞细胞质消失殆尽,残存的细胞器沿细胞壁分布,细胞内部空间的细胞壁物质向细胞壁沉积(图12,i、j)。贮藏40 d,背面维管束韧皮部薄壁细胞的细胞质几乎全部消失,细胞内部空间的细胞壁物质仍然向细胞壁沉积(图13,a、b)。然而,有的侧面维管束韧皮部薄壁细胞仍然分布着大液泡和线粒体(图13,c、d),尽管有的细胞内部空间几乎仅剩细胞壁物质(图13,e、f)。

a. 背面维管束韧皮部薄壁细胞;b. 图a矩形框标注区域的放大图;c. 侧面维管束韧皮部薄壁细胞;d. 图c矩形框标注区域的放大图;Scw. 次生细胞壁;Cwm. 细胞壁物质;Mf. 微纤丝;Pl.质壁分离图10 贮藏0 d时琯溪蜜柚果实背面维管束(a-b)和侧面维管束(c-d)的韧皮部薄壁细胞a. Phloem parenchyma cells of the dorsal vascular bundle; b. Magnified micrograph of the region marked by rectangle in a; c. Phloem parenchyma cells of the septal vascular bundle; d. Magnified micrograph of the region marked by rectangle in c; Scw. Secondary cell wall; Cwm. Cell wall material; Mf. Microfibril; Pl. PlasmolysisFig.10 Phloem parenchyma cells of the dorsal (a-b) and the septal (c-d) vascular bundles of ‘Guanxi’ pummelo fruits at 0 day of storage

a、c、e. 三类典型的背面维管束韧皮部薄壁细胞;b、d、f.质壁分离现象和细胞质逐渐降解(图a、c、e 矩形框标注区域的放大图);g、i、k. 三类典型的侧面维管束韧皮部薄壁细胞;h、j、l. 细胞质和中央液泡逐渐消失(图g、i、k矩形框标注区域的放大图);M. 线粒体;Cv. 液泡;V. 囊泡;P. 过氧化物酶体;Scw. 次生细胞壁图11 贮藏10 d时琯溪蜜柚果实背面维管束(a-f)和侧面维管束(g-l)的韧皮部薄壁细胞a, c and e. Three typical types of phloem parenchyma cells of the dorsal vascular bundle; b, d and f. Note the plasmolysis of plasma membrane and the increasing degradation of cytoplasm (magnified micrographs of the regions marked by rectangles in a, c, and e); g, i and k. Three typical types of phloem parenchyma cells of the septal vascular bundle; h, j and l. The cytoplasm and central vacuole gradually disappeared (magnified micrographs of the regions marked by rectangles in g, i and k); M. Mitochondrion; Cv. Vacuole; V. Vesicle; P. Peroxisome; Scw. Secondary cell wallFig.11 Phloem parenchyma cells of the dorsal (a-f) and the septal (g-l) vascular bundles of ‘Guanxi’ pummelo fruit at 10 days of storage
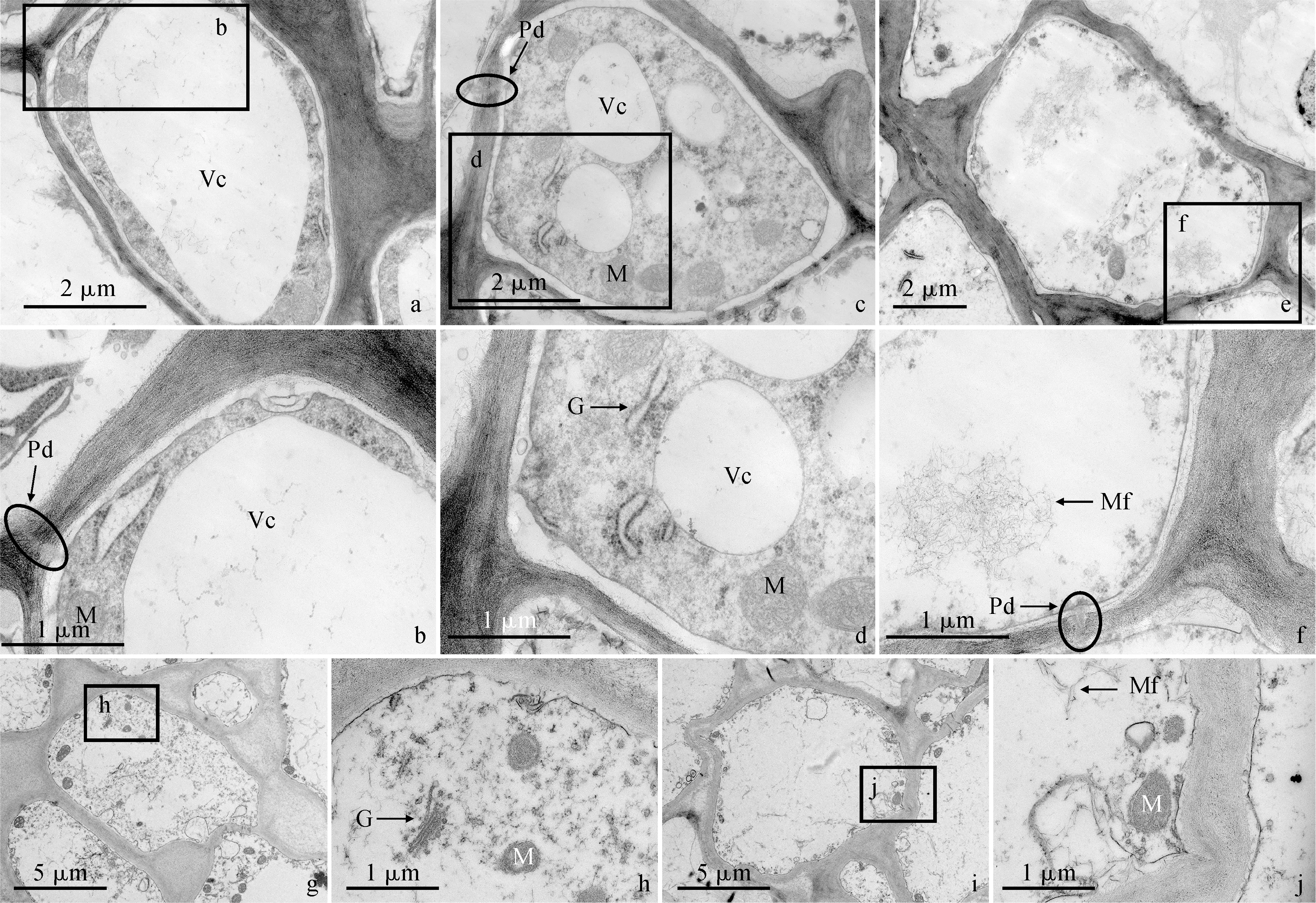
a、c、e. 三类典型的背面维管束韧皮部细胞;b、d、f. 液泡和线粒体数量增加,高尔基体出现,细胞质降解(图a、c、e矩形框标注区域的放大图);g、i. 两类典型的侧面维管束韧皮部细胞;h、j. 关注线粒体数量的增加,高尔基的出现,细胞质的降解(图g、i矩形框标注区域的放大图);M. 线粒体;Cv. 液泡;G. 高尔基体;Pd. 胞间连丝;Mf.微纤丝图12 贮藏20 d时琯溪蜜柚果实背面维管束(a-f)和侧面维管束(g-j)的韧皮部薄壁细胞a, c and e. Three typical types of phloem parenchyma cells of the dorsal vascular bundle; b, d and f. Note the increases in the number of vacuoles and mitochondria, the occurrence of Golgi apparatus, and the degradation of cytoplasm (magnified micrographs of the regions marked by rectangles in a, c, and e); g and i. Two typical types of phloem parenchyma cells of the septal vascular bundle; h and j. Note the increase in the number of mitochondria, the occurrence of Golgi apparatus, and the degradation of cytoplasm (magnified micrographs of the regions marked by rectangles in g and i); M. Mitochondrion; Cv. Vacuole; G. Golgi apparatus; Pd. Plasmodesma; Mf. MicrofibrilFig.12 Phloem parenchyma cells of the dorsal (a-f) and the septal (g-j) vascular bundles of ‘Guanxi’ pummelo fruits at 20 days of storage

a. 背面维管束韧皮部薄壁细胞;b. 图a矩形框标注区域的放大图;c、e. 两类典型的侧面维管束韧皮部薄壁细胞;d. 细胞内部空间分布着大量线粒体(图c矩形框标注区域的放大图);f. 图e矩形框标注区域的放大图;V. 囊泡;M. 线粒体;Cwm. 细胞壁物质;Mf. 微纤丝图13 贮藏40 d时琯溪蜜柚果实背面维管束(a-b)和侧面维管束(c-f)的韧皮部薄壁细胞a. Phloem parenchyma cells of the dorsal vascular bundle; b. Magnified micrograph of the region marked by rectangle in a; c and e. Two typical types of phloem parenchyma cells of the septal vascular bundle; d. Many mitochondria distribute in the intracellular space (magnified micrograph of the region marked by rectangle in c; f. Magnified micrograph of the region marked by rectangle in e; V. Vesicle; M. Mitochondrion; Cwm. Cell wall material; Mf. MicrofibrilFig.13 Phloem parenchyma cells of the dorsal (a-b) and the septal (c-f) vascular bundles of ‘Guanxi’ pummelo fruits at 40 days of storage
贮藏期结束时,两类韧皮部薄壁细胞均只剩残余的细胞质(图14,a、c),细胞内部空间的细胞壁物质仍向细胞壁沉积(图14,b、d)。
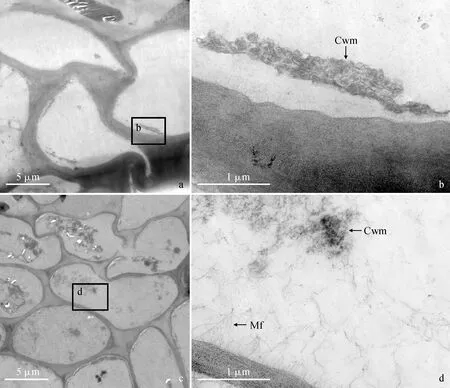
a. 背面维管束韧皮部薄壁细胞;b. 图a矩形框标注区域的放大图;c. 侧面维管束韧皮部薄壁细胞;d. 图c矩形框标注区域的放大图;Cwm. 细胞壁物质;Mf. 微纤丝图14 贮藏60 d时琯溪蜜柚果实背面维管束(a-b)和侧面维管束(c-d)的韧皮部薄壁细胞a. Phloem parenchyma cells of the dorsal vascular bundle; b. Magnified micrograph of the region marked by rectangle in a; c. Phloem parenchyma cells of the septal vascular bundle; d. Magnified micrograph of the region marked by rectangle in c; Cwm. Cell wall material; Mf. MicrofibrilsFig.14 Phloem parenchyma cells of the dorsal (a-b) and the septal (c-d) vascular bundles of ‘Guanxi’ pummelo fruits at 60 days of storage
综合分析背面维管束和侧面维管束韧皮部薄壁细胞超微结构的变化趋势,发现两类维管束韧皮部细胞的次生细胞壁加厚过程呈现一个共同的特征:中央大液泡开始变成多个小液泡的同时,引起细胞质壁分离;之后线粒体增多,高尔基体出现,细胞壁物质也随之增多;最后细胞质降解,细胞内部空间几乎仅剩细胞壁物质,次生细胞壁逐渐加厚,以致无法与初生细胞壁区分。
3 讨 论
本研究结果显示,汁胞粒化过程中果皮总细胞壁物质含量显著提高,这与熊博等[21]的研究结果较为一致。另外,在果实粒化过程中,不仅果实背面维管束和侧面维管束的筛管-伴胞复合体和韧皮部薄壁细胞次生细胞壁明显加厚,而且囊衣同样存在细胞壁物质积累现象。通过比较琯溪蜜柚果实不同组织细胞壁物质开始显著积累的时间发现,首先是果实维管束细胞木质化(贮藏10 d时次生细胞壁明显加厚),其次是囊衣和果皮总细胞壁物质含量显著提高(贮藏20 d),最后是汁胞总细胞壁物质显著积累(贮藏40 d侧面维管束汁胞总细胞壁物质含量显著提高,但整个贮藏期内背面维管束汁胞总细胞壁物质含量始终无显著变化)。果实维管束从果柄部位开始遍布整个果实[22-23],承担着物质运输的作用[24-26]。离体果实的维管束是吸收和散失水分的重要途径[27]。贮藏期内果实水分散失不可避免,这可能引起果实细胞对水分亏缺逆境的响应。据报道,植物能以木质素、纤维素、胼胝质、角质和软木质在细胞壁沉积的方式应对环境的变化[28]。本研究结果说明在柚果实贮藏期内果实维管束、囊衣和果皮生理代谢的变化早于汁胞;揭示汁胞以外的果实组织生理代谢变化的原因可能有助于果实粒化机理的研究和粒化防控措施的制定。本试验结果显示,在柚果实粒化过程中两类果实维管束的筛管-伴胞复合体结构特征的变化趋势无明显差异,但韧皮部薄壁细胞间结构特征的变化不完全相同。两类果实维管束韧皮部薄壁细胞共同的结构特征是:在贮藏10 至20 d时两类维管束韧皮部薄壁细胞内线粒体和囊泡数量增多,贮藏20 d时细胞内出现高尔基体,贮藏60 d时细胞溃散死亡。两类果实维管束结构特征间的差异主要表现为:贮藏40 d时背面维管束韧皮部薄壁细胞内线粒体和囊泡消失殆尽,而此期在侧面维管束韧皮部薄壁细胞内仍然可观察到很多线粒体。在拟南芥木质部次生细胞壁沉积过程中伴随着高尔基体数量的增加[29]。肉桂醇羟化酶[30]、半纤维素合成酶[31]、半纤维素侧链修饰酶[32]和纤维素合成酶组装调控蛋白[33]均分布于植物高尔基体;另外有的细胞壁物质,例如:木葡聚糖、多聚半乳糖醛酸和鼠李半乳糖醛酸也定位在高尔基体[34]。这些报道均证明高尔基体是植物细胞壁物质合成的重要场所。在茵芋(Skimmiajaponica)叶片和茎愈伤组织的原生质体细胞壁再生过程中,伴随着线粒体数量的增多[35]。悬铃木(Platanus×acerifolia)的木质部导管附近的薄壁细胞在合成细胞壁物质的同时,细胞内也出现大量的线粒体[36]。这些报道与本试验结果都说明线粒体可能与细胞壁物质积累相关。特别是本试验发现在柚果实维管束韧皮部薄壁细胞内不仅线粒体出现时间早于高尔基体,而且粒化更重的侧面维管束汁胞的着生位置是线粒体数量增加时间更长的果实侧面维管束。这表明线粒体可能参与柚果实细胞壁物质积累的调控。植物线粒体是活性氧(ROS)的重要合成部位[37]。ROS中的过氧化氢(H2O2)与植物细胞壁物质积累相关,例如:在拟南芥(Arabidopsisthaliana)维管组织中发现,H2O2作为一个信号物质能够转录激活木质素的合成途径[38];H2O2与盐逆境下拟南芥植株纤维素含量呈正相关[39]。据报道,琯溪蜜柚老龄树果实粒化率高于适龄树,老龄树果实汁胞H2O2含量高于适龄树[40]。至于线粒体是否是柑橘类果实粒化过程中的重要调控因子及其调控机理(是否由ROS介导),尚待试验证实。
从贮藏40 d至贮藏期结束,柚果实侧面维管束汁胞可溶性固形物含量持续显著降低,而总细胞壁物质含量持续显著提高。可溶性固形物中的主要成分是糖。糖是木质素[41]、纤维素[42]、半纤维素[43]和果胶[43]合成的碳架来源。对椪柑(CitrusreticulataBlanco)的正常汁胞和粒化汁胞的转录组分析发现,糖和柠檬酸降解途径及细胞壁物质合成途径的相关基因表达量显著提高,而糖和柠檬酸合成途径及细胞壁物质降解途径的相关基因表达量显著降低,证明在汁胞的粒化过程伴随着糖和酸的消耗[44]。结合本试验柚果实汁胞可溶性固形物和总细胞壁物质含量的动态变化趋势,推测细胞壁物质合成途径与细胞壁物质前体物质的代谢途径产生明显变化的时期相近,然而两类途径之间的联系尚待进一步研究。

