子宫内膜浆液性乳头状癌的MRI表现
钟穗兴,丁莹莹,艾丛慧,金雁,谭静,王洪波,张荟美,李苗苗,张娅
子宫内膜癌(endometrial carcinoma,EC)是一种多发于中老年女性的生殖系统恶性肿瘤,根据发病机制分为Ⅰ型(激素依赖型)和Ⅱ型(非激素依赖型),Ⅰ型即子宫内膜样腺癌(endometrioid adenocarcinoma,EAC),占EC的大部分,而Ⅱ型以浆液性乳头状癌(uterine papillary serous carcinoma,UPSC)为主,发病率不足10%[1-2]。虽然UPSC发病率低,但病死率高达40%,5年生存率也只有18%~27%,其临床特征、生物学行为、治疗方法及预后与EAC存在明显差异[3],因此治疗前明确EC的类型对临床具有重要意义。诊断性刮宫和组织活检是目前EC常用的术前诊断方法,但当UPSC以腺样结构为主时,容易将其误判为EAC[4]。MRI是诊断EC的主要影像学方法,目前关于UPSC的MRI研究极少,本研究旨在总结分析UPSC的MRI表现。
材料与方法
1.病例资料
搜集并回顾性分析2012年10月~2018年12月我院经手术病理证实、术前均行MRI检查的19例UPSC和同期随机的38例EAC患者的临床、病理及影像资料。两型患者大部分已绝经,UPSC患者绝经比例为78.95%(15/19),EAC为55.26%(21/38),且临床症状类似,主要以绝经后阴道不规则流血或阴道不规则流血、月经淋漓不尽就诊。
2.检查方法
MRI检查采用Philips Ingenia 3.0T磁共振扫描仪,所有患者检查前肌注山莨菪碱以减轻胃肠道蠕动。扫描时患者取仰卧位,使用体部表面相控阵线圈。扫描序列包括盆腔矢状面、冠状面T2WI(TR 2526 ms/TE 100 ms)、宫体高分辨轴面T2WI(TR 2236 ms,TE 90 ms,矩阵332 mm×317 mm,视野200 mm×200 mm,层厚3 mm,层间距0.3 mm)及对应的DWI (TR 4189 ms,TE 87 ms,视野250 mm×250 mm,层厚3 mm,层间距0.3 mm,b值为0、1000 s/mm2)、盆腔横轴面T1WI(TR 560 ms/TE 8 ms)及T1增强扫描(TR 6.10 ms,TE 1.90 ms)。增强扫描对比剂为钆喷酸葡胺(商品名:马根维显注射液,广州康臣药业有限公司),剂量0.20 mL/kg体重。
3.图像分析
子宫内膜癌的FIGO分期采用2009年修订后一直延用至今的FIGO分期版本。由2位具有5年以上工作经验的妇科肿瘤影像诊断医师在PACS影像诊断工作站分析常规MRI图像,在Philips自带后处理工作站Philips IntelliSpace Portal分析DWI图像,两者意见不同时经协商达成一致。图像观察内容包括肿瘤形态、最大径、肌层浸润深度、MR平扫、增强及DWI信号强度特征、盆腔淋巴结及卵巢转移情况等。病灶强化方式定义如下:动脉期强化程度高于静脉期记为早期强化,静脉期强化程度等于或高于动脉期记为进行性强化;病灶强化程度定义如下:以梨状肌及正常子宫肌层增强信号为参照,增强信号低于梨状肌记为轻度强化,高于梨状肌但低于正常子宫肌层记为中度强化,等于或高于正常子宫肌层记为明显强化。在ADC图上病灶最大层面手动勾画感兴趣区(region of interest,ROI),避开囊变坏死、出血等区域,并记录ADC值,测量3次取平均值作为记录值。
4.统计学分析
采用SPSS 17.0软件进行统计学分析。符合正态分布且方差齐性的计量资料的组间比较采用t检验,否则采用Wilcoxon秩和检验;独立的二分类资料的组间比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
UPSC患者的平均年龄[(59.0±8.1)岁]大于EAC患者[(51.8±8.8)岁],差异有统计学意义(P=0.004)。UPSC与EAC患者的分化程度差异无统计学意义(P=0.181)。UPSC患者以FIGO Ⅲ、Ⅳ期为主(63.16%,12/19),EAC患者以Ⅰ、Ⅱ为主(92.11%,35/38),差异有统计学意义(P<0.001,表1)。
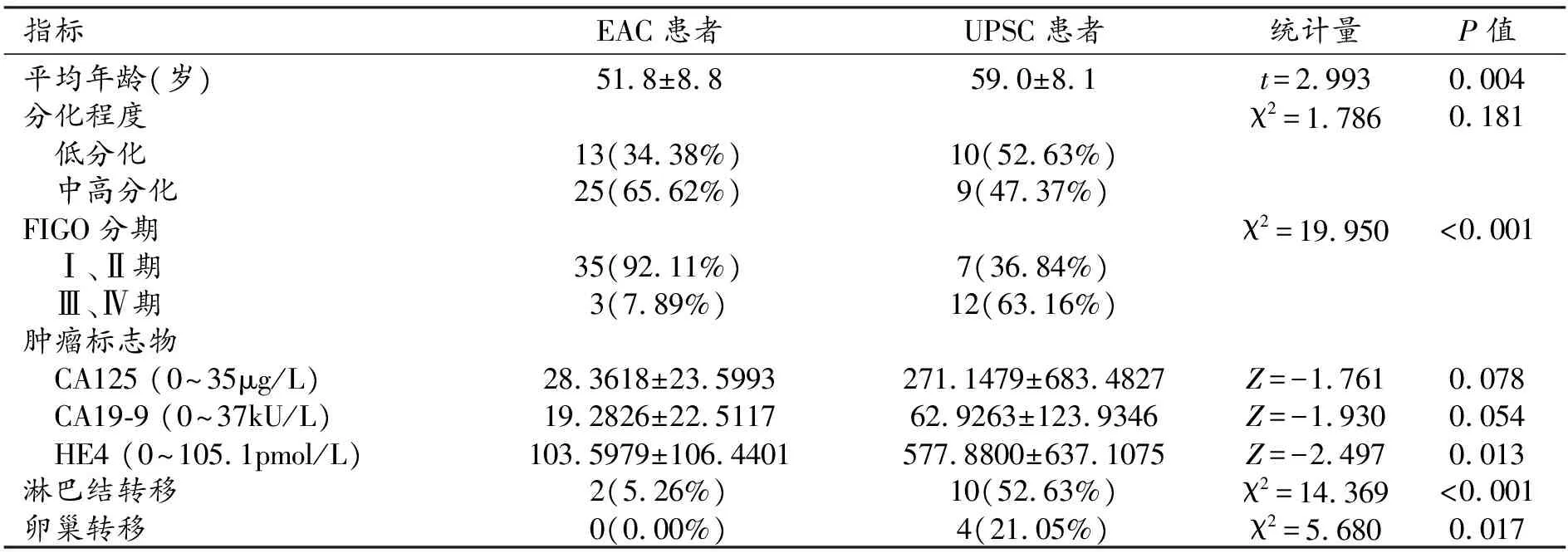
表1 UPSC和EAC患者的一般临床病理情况比较 (n,%)
病理免疫组化结果:UPSC病灶中,14.29%(2/14)ER表达阳性,14.29%(2/14)PR表达阳性,82.35%(14/17)P53表达阳性,71.43%(5/7)P16表达阳性,81.82%(9/11)Ki-67表达阳性;以上指标对应的EAC表达阳性率分别为50.00%(4/8)、50.00%(4/8)、0.00%(0/9)、33.33%(1/3)、40.00%(4/10)。
MRI表现:UPSC及EAC的病灶最大径均值分别为5.10、3.20 cm,且均以肿块型为主,肿块型比例分别为89.47%(17/19)、65.79%(25/38),两者差异均无统计学意义(P=0.204、0.056)。在T2WI上,UPSC(84.21%,16/19)信号(图1)较EAC(图2)更不均匀(55.26%,21/38),差异有统计学意义(P=0.004);UPSC病灶内出现囊变坏死(分别为42.11%和5.26%)、出血(分别为21.05%和0)的比例更高,差异均有统计学意义(P=0.002、0.017);且UPSC中31.58%(6/19)的病灶内可见特异性小梁样短T2信号影。UPSC病灶的平均ADC值为(0.68±0.15)×10-3mm2/s,EAC为(0.84±0.15)×10-3mm2/s,差异有统计学意义(P<0.001)。

图1 UPSC患者,58岁,FIGO ⅢC1期。a) 矢状面T2WI示子宫腔内巨大肿块,呈不均匀稍高信号,其内见多发囊变坏死区域及小梁状低信号影(黄箭),肿块后方为转移灶,其内伴出血,可见液-液平面(红箭); b) 轴面T2WI示右侧卵巢(红箭)及右侧髂内血管旁淋巴结(白箭)转移; c) 冠状面T2WI示左侧卵巢(红箭)转移; d) DWI图像上肿块呈不均匀高信号; e) ADC图上病灶呈低信号,ADC值最低处约0.59×10-3mm2/s; f) 增强扫描动脉期示肿块呈明显不均匀强化; g) 增强扫描静脉期(对比动脉期)示肿块呈进行性强化,肌层浸润深度>1/2子宫肌层(黄线代表肌层浸润深度,平行于黄线的红线代表肌层厚度)。
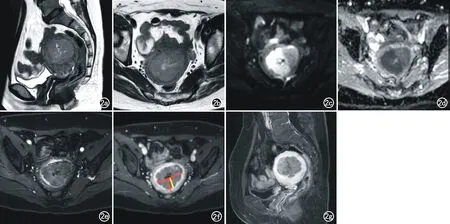
图2 EAC患者,57岁,FIGO ⅠB期。a) 矢状面T2WI示子宫内膜弥漫不均匀增厚形成肿块,病灶呈稍高信号,中央见裂隙状高信号的宫腔结构; b) 轴面T2WI示肌层部分低信号结合带消失; c) DWI图像示病灶呈高信号; d) ADC图示病灶呈低信号,ADC值最低处约0.86×10-3mm2/s; e) 轴面增强扫描动脉期示病灶呈中度不均匀强化; f) 轴面增强扫描静脉期示肌层浸润深度>1/2子宫肌层(黄线代表肌层浸润深度,平行于黄线的红线代表肌层厚度); g) 矢状面增强扫描静脉期(对比动脉期)示病灶呈早期强化。
增强后UPSC和EAC均以中度-明显强化为主,差异无统计学意义(P=0.442)。UPSC以进行性强化为主(84.21%,16/19),而EAC以早期强化为主(78.95%,30/38),差异有统计学意义(P<0.001);57.89%(11/19)的UPSC肌层浸润深度≥1/2肌层,而EAC相应为31.58%(12/38),差异有统计学意义(P=0.041);UPSC中52.63%出现淋巴结转移(10/19),21.05%出现卵巢转移(4/19),而EAC的淋巴结转移率为5.26%(2/38),无卵巢转移,差异均有统计学意义(P<0.001、0.017,表2)。

表2 UPSC和EAC患者的MRI征象比较 (n,%)
讨 论
UPSC是Ⅱ型子宫内膜癌的一个主要类型,相较于EAC,其为非激素依赖性的,且具有侵袭性强、术后复发率高、预后更差的高度恶性生物学特征[3]。UPSC与EAC的治疗方式不完全相同,UPSC需行全面分期手术和早期使用化疗、放疗;而且当UPSC以腺样结构为主时,术前诊断性刮宫容易将其误判为EAC,因此治疗前准确鉴别两者显得尤为重要[4-7]。MRI是诊断子宫内膜癌的主要影像学方法,若能通过MRI鉴别两者,将给临床治疗带来帮助。
本研究结果显示UPSC患者的平均年龄为59.0岁,大于EAC患者(51.8岁),与文献报道的UPSC患者发病年龄较EAC患者大10岁左右一致[8]。目前子宫内膜癌尚无敏感性及特异性均较高的肿瘤标志物[9],少量研究认为CA125、CA19-9及HE4对子宫内膜癌诊断、分期和治疗疗效评估的价值较高,但至今没有检索到其可以鉴别不同病理组织类型子宫内膜癌的相关文献报道[10]。有研究表明HE4水平与肿瘤的发展具有一定正相关性[10,11],本研究发现UPSC的HE4水平显著高于EAC(P<0.05),这可能与本研究中UPSC患者的深肌层浸润比例高、病理分化程度差、临床分期晚及淋巴结转移比例高等有关。本组89.47%(17/19)的UPSC病灶为肿块型,这可能是因为UPSC病变是在局部萎缩内膜上发生的内膜上皮内瘤变,与内膜增生无关,故肿块型多见;而EAC是在内膜复杂非典型增生的基础上癌变、起病,故肿块型与弥漫型均可见[12]。UPSC与EAC病灶在T2WI上均表现为稍高信号,但UPSC信号较EAC更不均匀,UPSC病灶中更容易出现囊变坏死、出血等情况,出血可能与早期脉管系统侵犯有关,这可能也是UPSC更易发生淋巴结、血行转移的原因之一[12]。本组31.58%(6/19)的UPSC病灶内可见小梁状短T2信号影,其在T1WI上也呈低信号,增强扫描呈轻度强化,这可能与UPSC乳头状生长的组织病理结构及乳头状结构中的纤维轴心成分有关[7]。
本研究结果显示UPSC的ADC值较EAC低,分别为(0.68±0.15)×10-3mm2/s和(0.84±0.15)×10-3mm2/s,差异有统计学意义,与相关研究结果一致[13,14],这与UPSC细胞核更大、核浆比更高,细胞密度更大,并存在大量核分裂象,致使细胞内、外间隙均减小,导致水分子扩散受限更明显有关[7,15]。尽管如此,由于真实肿瘤组织的微环境极为复杂,水分子的扩散运动并不符合传统DWI假定的高斯分布,因此有学者利用基于非高斯分布的扩散峰度成像(diffusion kurtosis imaging,DKI)来鉴别UPSC与EAC,结果显示其定量参数同样能有效鉴别两者[16],故今后应前瞻性对比DWI与DKI在鉴别诊断两型子宫内膜癌中的价值。在MRI增强图像上,UPSC病灶的强化程度高于EAC,且UPSC病灶以进行性强化为主,EAC病灶以早期强化为主;此结果与葛传彪等[12]的UPSC以“明显强化-上升”型为主、多数子宫内膜样腺癌呈早期强化等研究结果一致[17,18],这可能与UPSC的血管内皮生长因子等血管生成因子的表达和血管密度高、血管管径大、血管通透性差等有关[19,20]。
本研究结果显示UPSC的深肌层浸润比例高于EAC(分别为57.89%和31.58%),UPSC以Ⅲ、Ⅳ期为主(63.16%),EAC以Ⅰ、Ⅱ期为主(92.11%),病理分化程度上UPSC以低分化为主(52.63%),而EAC以中高分化为主(65.62%),以上均表明UPSC具有高度恶性的生物学特征[21],这也可能是本组病例中UPSC的淋巴结、卵巢转移比例高于EAC的原因之一。
对于UPSC的鉴别诊断,主要需与癌肉瘤及子宫内膜间质肉瘤相鉴别:①癌肉瘤,强化程度较高,多与子宫肌层强化程度类似,瘤体内可见多发流空血管影,微囊变及坏死成分丰富,导致ADC值较高,而UPSC强化程度多低于子宫肌层,瘤体内无流空血管影[22];②子宫内膜间质肉瘤,肿瘤呈向心性均匀强化,瘤体突破子宫肌层,可见子宫破口或通道征,且瘤体内可见多发蜂窝状血管影,而UPSC强化多不均匀,瘤体位于子宫内,且无蜂窝状血管影[23]。
综上所述,相对于EAC,UPSC具有患者发病年龄偏大,肌层浸润程度深,病灶内易囊变坏死及出血,并可见轻度强化的特异性小梁状短T2信号结构,DWI上扩散受限更明显,增强呈进行性强化等特征性的MRI表现;因此当子宫内膜病变出现上述表现时,应考虑到UPSC的可能。

