基于乳腺X线图像影像组学列线图对乳腺癌腋窝淋巴结转移的预测价值
张玉姣, 宋德领, 王燕飞, 马永青, 杨飞, 朱月香, 崔书君
近年来,乳腺癌的发病年龄逐渐趋于年轻化,30岁以下的女性约有15%发生乳腺癌,其发病率在女性恶性肿瘤中排名第一。尽管全球乳腺癌患者的死亡率在下降,但是中国的死亡率却在逐渐上升[1,2]。临床研究表明[2],大多数局部晚期乳腺癌患者并非死于原发肿瘤,而是肿瘤转移性疾病,而腋窝淋巴结(Axillary lymph node,ALN)阳性的乳腺癌患者的5年生存率为84%,低于ALN阴性患者的98%[3],因此,术前鉴别乳腺癌ALN状态对于肿瘤的分期、治疗和预后具有重要临床意义。
在过去的几年中,根治性乳腺切除术联合ALN清扫术是乳腺癌的标准治疗方法。有研究显示超过70%的早期乳腺癌患者并没有发生ALN转移[4],在这种情况下,任何类型的腋窝部位手术都被认为是过度治疗[5]。前哨淋巴结(Sentinel lymph node,SLN)活检目前已经代替ALN清扫术用于排除乳腺癌淋巴结转移阴性患者和避免ALN清扫术后的并发症的发生[5];但美国外科医生肿瘤学会(American college of surgeons oncology group,ACOSOG)Z0011 研究表明[6],对于1或2个SLN转移的乳腺癌患者,单行SLN活检和行SLN活检联合ALN清扫术的总生存率相等,研究结果支持将具有1或2个SLN转移患者纳入到低风险组,这无疑导致了SLN活检在肿瘤分期中的准确度下降;且SLN活检是一种侵入性手术,伴有明显的并发症,如上肢水肿、肩部功能障碍、局部神经损伤和淋巴水肿等[7];另外,5%~10%的ALN假阴性率也不容忽视[8]。Gentilini等[9]开始质疑SLN活检在术前评估ALN状态中的作用,提出在ALN阴性的低风险乳腺癌患者中应避免使用SLN活检,该研究对于提高ALN阴型患者的生活质量具有重要临床意义。Bevilacqua等[4]发现乳腺癌患者的肿瘤类型、血管侵犯程度、雌激素受体和孕激素受体等临床病理因素与ALN转移具有显著相关性,然而这些病理因素均是通过术中或病理活检等有创性检查获得,对术前指导是否采取ALN清扫术意义不大。以上研究进一步说明了术前无创检测ALN状态方法的重要意义,需要为提高患者生活质量提供一种更具有针对性的医学途径。本研究对乳腺X线图像的影像组学特征进行分析,旨在探讨其能否对乳腺癌患者的ALN状态进行精准预测,在临床中发挥相应作用。
材料与方法
1.病例资料
搜集2016年7月-2020年10月河北北方学院附属第一医院行乳腺X线摄影的原发性乳腺癌患者。病例纳入标准:①经病理证实为原发性乳腺癌;②接受淋巴结活检;③术前一周内接受乳腺X线摄影。病例排除标准:①既往有手术或接受过其他治疗方案;②合并其他部位恶性肿瘤者;③图像质量不佳未能完成测量者。最终188例患者纳入本研究,包括172例浸润性导管癌,4例浸润性小叶癌,2例乳头状癌。患者年龄38~73岁,平均(54.3±6.9)岁,依据ALN转移结果按照7:3的比例将患者分为训练组和验证组,其中训练组130例(转移组患者58例,非转移组72例),验证组58例(转移组27例,非转移组31例)。
2.检查方法
乳腺X线摄影检查采用美国GE Healthcare乳腺X线成像(Senographe DS)系统进行图像摄影,拍摄乳腺头尾位(CC)和内外侧斜位(MLO)。摄影参数:选择Auto-time曝光模式,管电压25~30 kV,管电流75~90 mAs,摄影距离40~50 cm,图像大小25 cm×32 cm。由一位具有7年乳腺诊断经验的主治医师测量记录患者的肿瘤特征,包括肿瘤大小(最大直径)、位置、形态、边缘特征。
3.图像分割和特征提取
将患者的CC位图像以BMP格式从PACS系统内导出,采用盲法原则将图像导入开源MaZda分析软件(The Technical University of Lodz,Institute of Electronics,http: //www.eletel.p.lodz.pl/mazda/)内,由两位分别具有5年和7年乳腺诊断经验的主治医师分别对肿瘤病灶区域进行勾画,勾画范围尽量包括整个肿瘤区域(图1、2),对于有争议的区域参考MLO位图像或MRI图像进行商议后共同决定,每个ROI分别测两次取平均值。
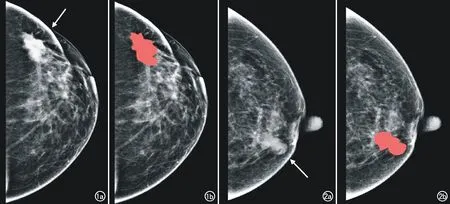
图1 左侧浸润性导管癌患者,女,47岁。a)原始乳腺X线图示左乳内上象限高密度影(箭); b) 利用MaZda软件勾画ROI示意图。 图2 左侧浸润性导管癌患者,女,56岁。a) 原始乳腺X线图示左乳内下象限中等密度影(箭); b) 利用MaZda软件勾画ROI示意图。
MaZda软件生成共生成灰度直方图(Histogram)、灰度共生矩阵(Gray-level cooccurrence matrix,GLCM)、游程长度矩阵(Grey level run length matrix,GLRLM)、绝对梯度(Absolute gradient)、自回归模型(Autoregressive model parameters)和小波特征(Wavelet parameters)等317个影像组学特征,其中小波特征是基于Histogram、GLCM和GLRLM特征变换后的特征。
4.数据预处理、影像组学标签的构建与评估
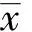
5.统计学分析
采用R3.6.2统计分析软件进行统计学分析。采用组内相关系数(intraclass correlation coefficients,ICC)评价两位医师测量 ROI参数的一致性,ICC为 0.75~1.00表示一致性较好。计量资料以均数(中位数,四分位数间距)表示,计数资料以频数表示。采用独立样本t检验比较两组患者年龄和影像组学分数的差异,采用χ2检验比较两组患者肿瘤大小、组织学分级、位置、雌激素受体、孕激素受体、形态、边缘的差异。将具有统计学意义的指标进行单因素Logistic回归分析,与影像组学分值构建联合预测模型并绘制影像组学列线图,利用rms软件包进行1000次重复抽样后对列线图的预测精准度进行标定并绘制校正曲线,采用ROC曲线对列线图的诊断效能进行评价,运用devtools软件包绘制临床决策曲线图,分析列线图在不同阈值下的净收益状况以确定其临床应用价值。以P<0.05 为差异有统计学意义。
结 果
1.两组患者的一般资料及两位医师测量参数的一致性
训练组和验证组患者的临床资料见表1,转移组与非转移组患者的影像组学分数、肿瘤大小差异具有统计学意义(P<0.05),其余指标差异均不具有统计学意义(P>0.05)。
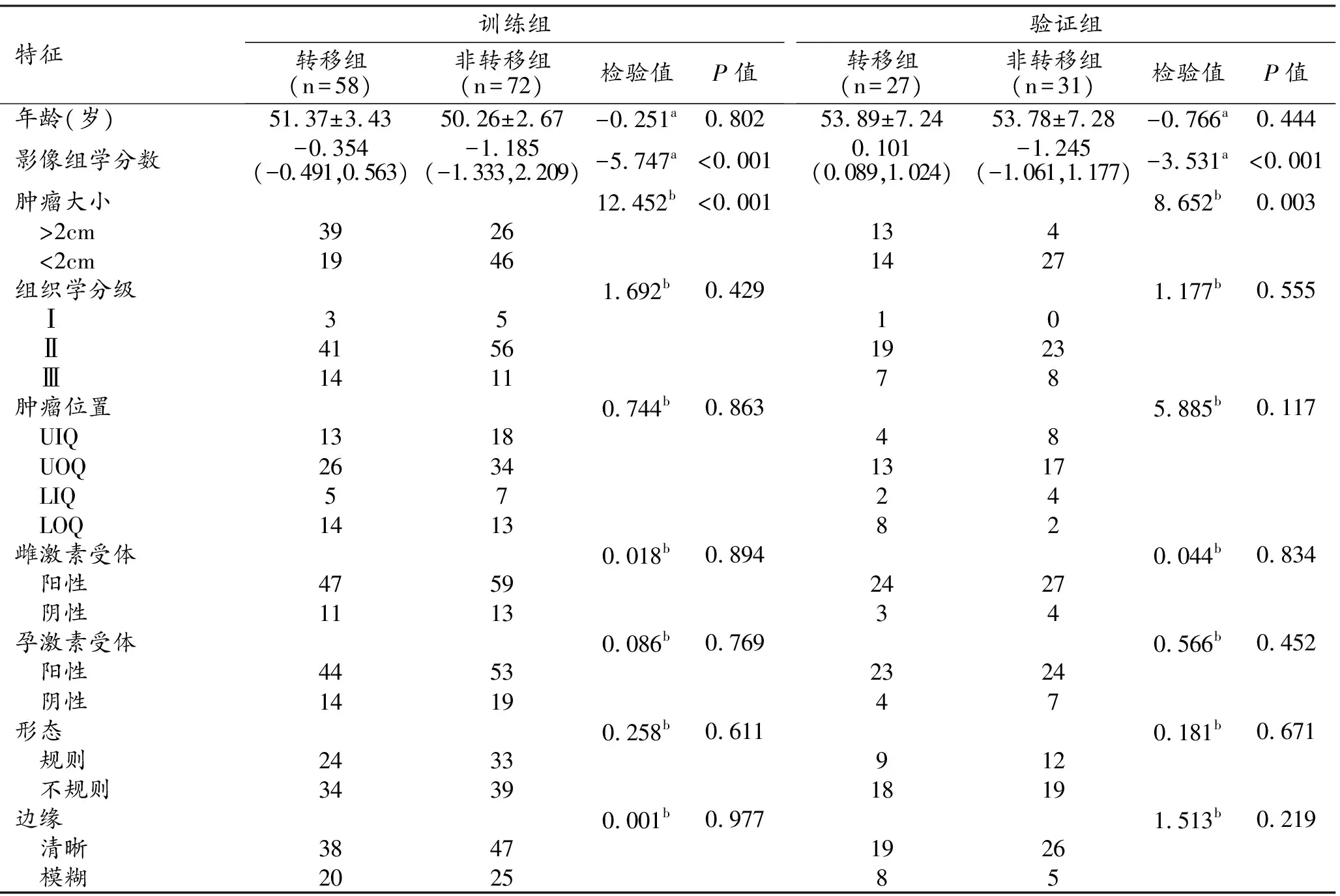
表1 训练组和验证组患者的一般临床资料比较 (例)
两位医师在乳腺X线图像内提取的影像组学特征参数一致性较高,ICC值为0.767~0.916。
2.预测模型的建立与验证
两位医师从Mazda软件中共提取出317个影像组学特征,使用方差分析法进行初筛后剩余258个参数,然后利用LASSO算法进行进一步筛选,最终在λ=0.0356处筛选出14个特征构建影像组学标签(图3、表2),结果显示训练组和验证组标签的AUC分别为0.760和0.742(表3)。

图3 LASSO算法筛选影像组学特征。a) LASSO回归的特征选择,通过调节不同的超参数(λ)使得模型的二项式偏差达到最小,从而达到筛选最优特征的目的。左侧垂直虚线表示取最佳λ值时log(λ)对应的最小偏差值,对应的log(λ)= -2.998,右侧虚线代表最佳λ值所对应的函数值,图片顶端的为纳入的特征数;b)使用10倍交叉验证法筛选特征的特征系数收敛图,在图中垂直线对应筛选出具有非零系数的特征,共选出14个最佳特征。 图4 预测乳腺癌ALN转移的影像组学列线图,在影像组学分值、肿瘤大小的坐标轴进行定位,绘制垂直于第一条分值的直线,计算各条直线所对应的分值总和,在总分值坐标轴进行定位,绘制垂直于ALN转移概率横轴的直线,所对应的概率即为乳腺癌患者发生ALN转移的概率。
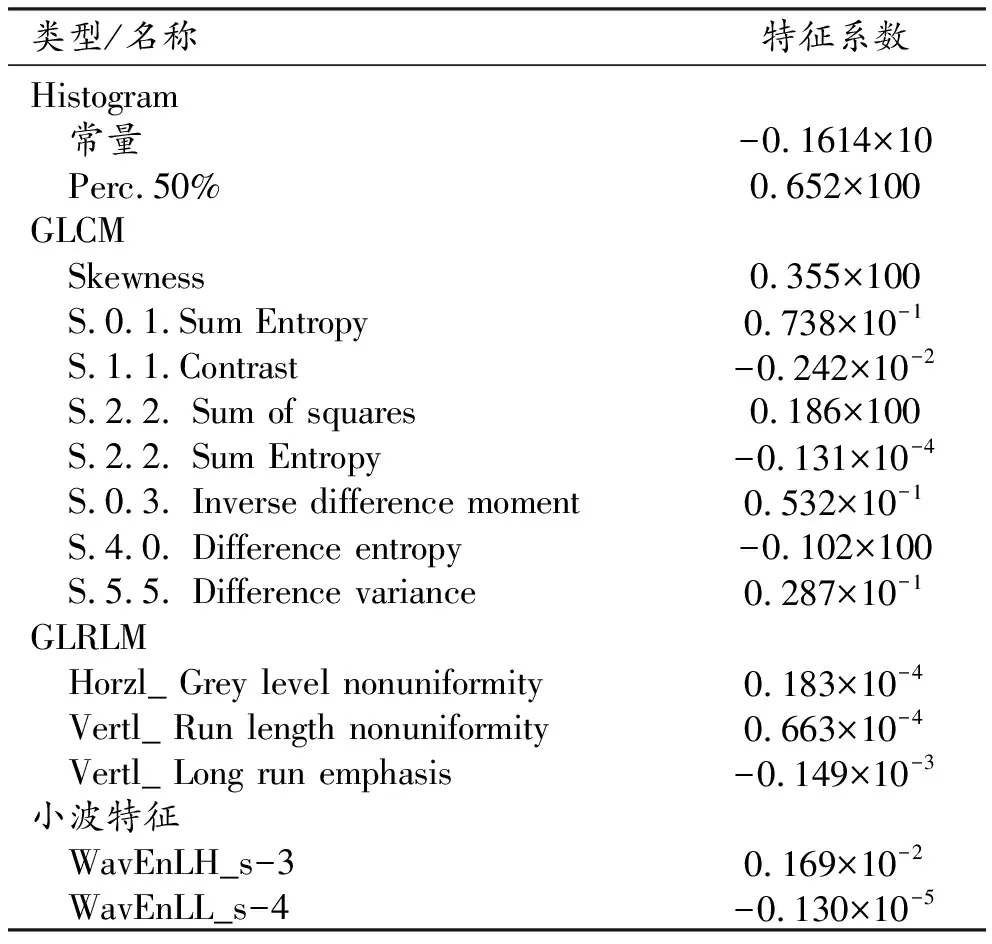
表2 基于LASSO算法进行特征筛选后选取的最佳特征参数及系数
为了给临床提供一个方便快捷的预测工具,将影像组学特征联合肿瘤大小建立联合预测模型,并绘制列线图使模型可视化(图4),训练组和验证组的校正曲线显示联合预测模型的预测值与真实值的一致性良好(图5a、b),具有较好的校准性能。列线图在训练组模型中的AUC为0.808,敏感度和特异度分别为93.10%和58.33%;验证组模型的AUC为0.811,敏感度和特异度分别为81.48%和70.97%(表3,图6a、b)。使用临床决策曲线对列线图进行评估(图7),结果显示在阈值为5%~82%时,使用影像组学列线图预测乳腺癌ALN转移的临床净收益较大。
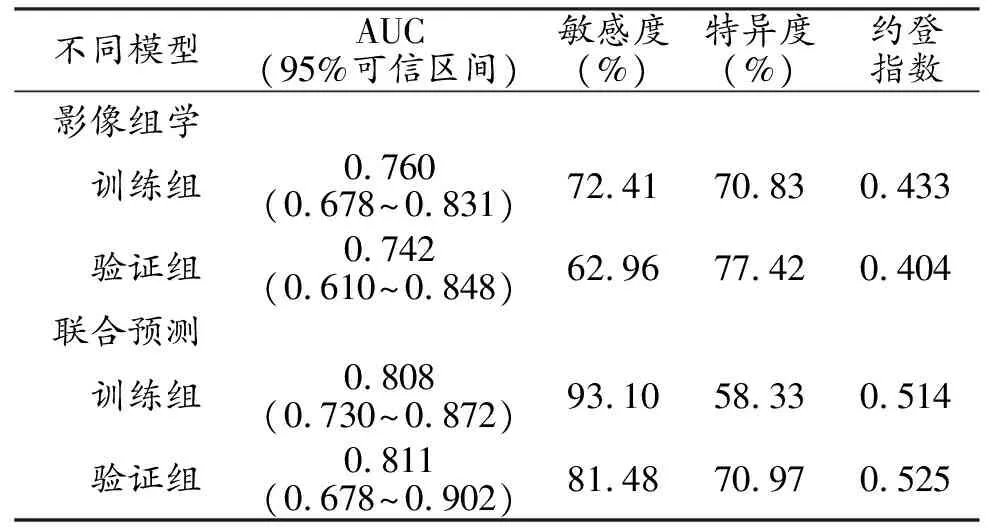
表3 影像组学标签和联合预测模型的诊断效能
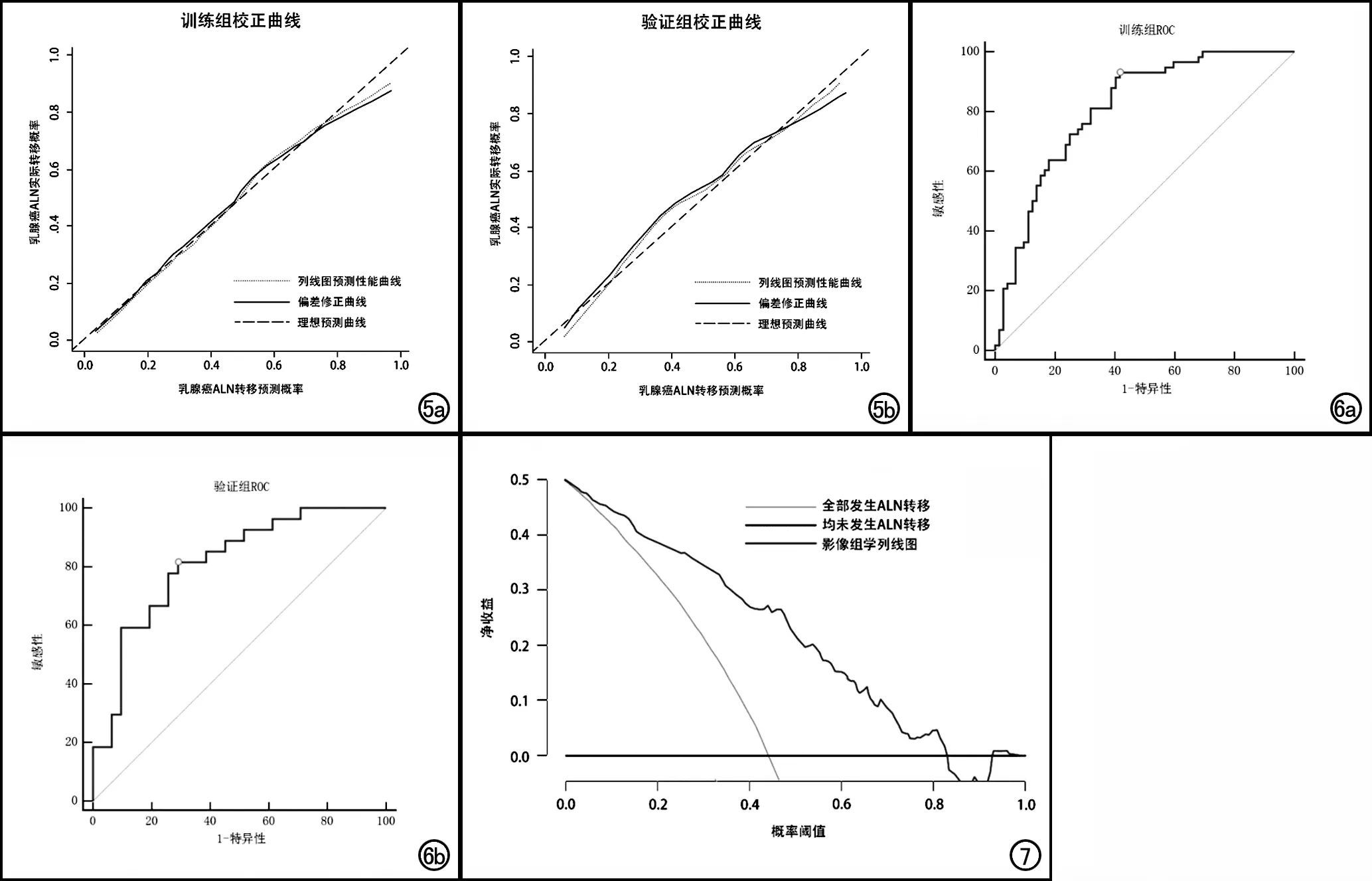
图5 联合预测模型预测ALN转移的校正曲线,描述列线图在经过1000次重复抽样后预测ALN转移的概率和ALN转移实际发生概率的一致性,45°虚线表示理想预测性能,另外两条虚线和实线分别表示列线图的预测性能和列线图偏差的修正,预测性能虚线越接近45°理想性能虚线,表示模型的预测准确度越高。a)训练组;b)验证组。 图6 联合预测模型预测乳腺癌ALN转移的ROC曲线。a)训练组; b)验证组。 图7 影像组学列线图的决策曲线分析。x轴表示阈值概率,y轴表示净收益,灰线代表所有患者均发生ALN转移,黑线代表没有ALN转移的假设,蓝线代表影像组学列线图。决策曲线显示,当阈值概率为5%~82%时,影像组学的净收益高于其余两种情况。
讨 论
近年来,无创性的影像学检查手段已广泛应用于乳腺癌的筛查和诊断。有研究显示乳腺X线、CT、MRI诊断乳腺癌ALN转移的敏感度和特异度分别为14.0%、93.0%、95.3%和84.8%、57.6%、65.2%[10],乳腺X线过低的敏感度和CT、MRI过低的特异度均难以在术前对乳腺癌患者的ALN状态进行精确评估。尽管超声引导的淋巴结细针穿刺可以提高术前ALN转移的诊断符合率,但在没有明显肿瘤侵袭的证据下,仍需进一步手术进行肿瘤分期。Caudle等[11]研究显示利用动态对比增强磁共振成像(dynamic contrast enhancement magnetic resonance imaging,DCE-MRI)图像内肿瘤和淋巴结的特征如肿瘤大小、边缘光滑程度、淋巴结的皮质厚度、脂肪门状态对ALN转移进行预测,但肉眼对影像上病灶组织细微结构的分辨率有限,很多具有较高诊断价值的图像特征不能被肉眼所捕捉。因此,鉴于传统检查方法的局限性,开发一种高度特异性、无创、安全的ALN状态检测方法一直是一个挑战。
目前乳腺癌影像组学发展迅速,已广泛应用于鉴别乳腺肿瘤良恶性、判定乳腺癌分子分型、评估新辅助化疗疗效等方面[12-14],但是关于乳腺癌ALN状态的研究较少,Yu等[15]利用426例早期乳腺癌的超声图像进行影像组学分析,利用LASSO算法筛选出14个影像组学特征作为最佳特征构建影像组学标签,训练组和验证组标签的AUC分别为0.78和0.71。Han等[16]利用411例乳腺癌DCE-MRI图像进行分析,筛选出12个影像组学特征建立标签对乳腺癌ALN转移进行预测,研究结果显示训练组和验证组标签的AUC分别达到了0.76和0.78。聂悦等[17]回顾性分析了402例乳腺癌患者的增强CT图像,筛选出10个最优影像组学特征建立模型预测腋窝淋巴结转移,结果显示测试组的AUC、敏感度和特异度分别为0.92、82%、92%。本研究利用LASSO算法对乳腺X线图像内提取了317个组学特征进行筛选,最终14个最优特征被纳入到影像组学标签中用于对乳腺癌ALN状态进行评估,特征类型包括Histogram、CLCM、GLRLM和小波特征。训练组影像学标签的AUC为0.760和0.742,达到了中等预测性能。Yang等[18]通过114例乳腺癌患者的乳腺X线图像进行影像组学分析,采用支持向量机模型对ALN转移患者进行分类,研究结果显示训练组和验证组模型的AUC分别为0.89和0.87,高于本研究影像组学标签的预测性能,可能与模型类型、特征的提取和筛选方式有关。CLCM、GLRLM特征是影像组学和机器学习领域内应用较为广泛的特征参数,本研究中有10个纹理参数纳入标签中,与Tan等[19]从T2脂肪抑制序列中筛选出的与乳腺癌ALN转移相关的17个纹理参数一致,表明该类参数在反映肿瘤内细胞分子间的相互作用所引起图像纹理空间结构分布的改变中具有重要贡献,并且可以根据影像组学标签计算出的分值对肿瘤的生物学行为进行解释。
本研究对一些可在术前获得的临床因素如患者年龄、肿瘤大小、边界、光滑程度进行了研究,ALN转移患者的肿瘤大小显著高于未转移患者,与先前研究一致,肿瘤大小与同侧腋窝淋巴结转移有着密切关系[20,21],可以作为预测因子在术前对乳腺癌ALN状态进行评估,为患者手术方案的制定提供可靠参考信息。本研究对患者临床指标进行了统计分析,将单因素Logistic分析中具有统计学差异的肿瘤大小联合影像组学标签建立联合预测模型,并绘制列线图使模型可视化,ROC曲线显示训练组和验证组联合预测的AUC分别为0.808和0.811,均高于影像组学标签的预测效能,一方面提示列线图对乳腺癌ALN转移的预测能力优于单一的影像组学标签,肿瘤大小和钙化特征在提高模型的预测性能中有着重要作用;另一方面则反映了列线图有着较好的泛化能力,未出现数据过拟合现象,可以较精确地对发生乳腺癌ALN转移与非ALN转移患者进行鉴别。本研究所采用的列线图更适合应用于临床,不仅可以从乳腺X线图像内获取影像组学分值为治疗决策的制定提供数据支持,还可联合肿瘤大小指标对ALN转移患者进行预测。因此笔者认为影像组学列线图可作为预测乳腺癌ALN转移的可靠工具,为改善患者生活质量提供一种新的医学途径。
本研究存在以下局限性:①本研究应纳入部分已被证实与乳腺癌ALN转移相关的临床、病理因素(如肿瘤类型、血管侵犯程度等),可进一步提升模型的总体准确率;②本研究基于LASSO算法对特征进行降维,可能会筛选掉一些具有潜在鉴别价值的特征参数,导致最终模型的准确度受到一定程度影响;③本研究基于二维乳腺X线图像进行影像组学分析,DCE-MRI在显示乳腺内部解剖形态和瘤体血流动力学方面优于乳腺X线和超声,且可融合为三维图像进行图像分析,可在未来的研究中进一步探讨;④本研究的样本均来自于同一家医院且样本数量较少,需要在未来加入多中心的数据集对模型进行外部验证。
综上所述,基于乳腺X线图像提取的影像组学特征可作为预测乳腺癌ALN转移的潜在生物标志物,联合临床因素构建的列线图可快速对ALN转移患者进行预测,为临床决策制定和预后判断提供更可靠的参考信息。

