MRI联合血清miR-204水平对原发性肝癌经皮穿刺射频消融术后疗效及复发的预测价值
姚升娟, 曲静琦, 曹宇, 郭雅雯, 沈文
原发性肝癌作为一种常见的消化系统肿瘤,严重危害人类健康[1]。目前对于肝癌的治疗方法,主要包括手术、肝移植和经皮穿刺射频消融(radiofrequency ablation,RFA)[2]。虽然根治性手术是治疗肝癌最有效的方式,但经手术切除后,患者发生并发症的概率大大增加。近年来,随着RFA等新型技术的发展和成熟,已被广泛应用于肝癌的治疗中,除了具有微创、简便、可重复操作等优势,其疗效和安全性也得到了广大临床医师及患者家属的认可[3]。然而,也有多项研究表明,不同个体应用RFA治疗后的疗效和复发情况存在差异[4,5]。因此,早期预测及评估RFA对原发性肝癌患者治疗后的疗效和复发情况对选择合适的治疗方法及改善患者预后具有重要意义。MRI具有成像序列多、软组织分辨率高等优点,扩散加权成像可无创性精准测定肿瘤细微结构和活性情况,通过测量表观扩散系数(apparent diffusion coefficient,ADC)值,MRI在肝癌诊断等方面具有重要意义[6,7]。但目前关于MRI在预测RFA治疗肝癌效果及复发中的研究还较少。此外,微小RNA(micro RNA,miR)因其在细胞增殖、迁移、凋亡等过程中的调控作用,近年来成为众多学者研究的热点。最近的研究表明,miR-204在肝癌的发生、发展及预后中起到重要作用,因此可能是肝癌诊断和预后评估的分子标志物[8,9],然而目前尚未有研究报道血清miR-204在肝癌经RFA治疗后疗效及复发情况中的预测价值。本研究旨在探讨MRI、血清miR-204及两者联合在肝癌经RFA治疗后疗效和复发情况中的预测价值,以期为临床治疗决策的选择提供参考依据。
材料与方法
1.病例资料
选择2019年8月-2020年8月于本院行RFA治疗的原发性肝癌患者作为研究对象。病例纳入标准:①符合《原发性肝癌诊疗规范(2019年版)》中的诊断标准,确诊为原发性肝癌;②合并肝硬化;③肿瘤直径<3 cm,且肝功能Child-Pugh分级为A或B级;④肝肿瘤数目不超过3个;⑤治疗前未接受其他治疗方案,临床及影像学资料完整。病例排除标准:①合并严重心、脑、肺、肾疾病;②合并其他部位恶性肿瘤;③患有自身免疫性疾病。最终,本研究纳入212例肝癌患者,其中男114例,女98例,平均年龄(58.28±5.38)岁。本研究所有程序均符合赫尔辛基宣言,获得了医院伦理委员会的批准(批号:H2019073)。所有研究对象均自愿参与研究,并签署了知情同意书。
2.研究方法
MRI检查方法:于RFA术前一周内对研究对象采用西门子3.0T Skyra MRI扫描仪行MRI检查,先行常规MRI,然后行扩散加权成像,最后行增强扫描。增强扫描对比剂采用钆塞酸二钠(商品名:普美显,德国拜耳医药),剂量0.1 mL/kg,流率1 mL/s,经肘前静脉注入。采用MRI工作站进行定量分析,全容积画法手动勾画感兴趣区,在轴面图像病灶连续层面上对病灶边缘进行手动勾画,确保包含整个病灶,记录表观扩散系数(apparent diffusion coefficient,ADC)值,共测量5次,取平均值作为病灶ADC值并进行记录。

图1 患者,男,56岁,RFA治疗后肝癌完全消融(箭)。 图2 患者,女,42岁,RFA治疗后肝癌完全消融(箭)。 图3 患者,男,48岁,RFA治疗后肝癌残留(箭)。 图4 患者,男,57岁,RFA治疗后肝癌残留(箭)。
血清miR-204水平测定:RFA术前抽取研究对象外周静脉血2 mL,然后于4℃、3000转/min条件下离心10 min,取上层血清,置于-80℃条件下待用。采用定量实时聚合酶联反应(quantitative real-time polymerase chain reaction,qRT-PCR)法测定血清中miR-204的相对表达量。由上海云序生物科技有限公司设计并提供引物,miR-204的引物序列如下:miR-204(F):5′-ACGAAATGACCCATTGACCGT-3′,(R):5'- GAACCTCCAACGGAGAAGCG-3′;内参基因U6的上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′- AACGCTTCACGAATTTGCGT-3′。反应体系包括0.75 μL E×12 TaqMan⑧基因表达检测液,7.5 μL TaqMan PCR反应混合液,3 μL cDNA模板,再加ddH2O至15 μL。反应条件为:95℃预变性10 min;94℃ 20 s,58℃ 20 s,72℃ 20 s,共循环40次,然后采用荧光定量PCR仪进行定量测定。采用标准曲线法对miR-204的表达水平进行相对定量分析,应用2-ΔΔCT法计算结果并记录。
3.疗效评估及复发判断标准
于RFA术后1个月再次进行MRI检查,参照原发性肝癌诊疗规范对治疗效果进行评估,判断是否完全消融。对于有肿瘤残留的患者,予以再次射频消融治疗,但不纳入随访。对完全消融组患者定期进行电话或门诊随访,截止时间为患者死亡或出院后1年,记录患者复发情况。
4.统计学分析
采用SPSS 22.0软件进行统计学分析。符合正态分布的计量数据以均数±标准差表示,组间比较采用t检验,多组间的两两比较采用SNK-q检验。计数数据以频数和百分比表示,组间比较采用χ2检验。应用受试者工作特征(receiver operating characteristic,ROC)曲线评估ADC值、血清miR-204及两者联合在预测RFA治疗后疗效和复发中的效能,两者联合的计算公式=β常量+ADC值×βADC值+miR-204×βmiR-204。以P<0.05为差异有统计学意义。
结 果
1.不同疗效肝癌患者的一般特征比较
经RFA治疗后,完全消融患者182例(85.8%,完全消融组),肿瘤残留患者30例(14.2%,残留组,图1~4)。两组患者的性别、年龄、肿瘤直径、肿瘤部位、Child- Pugh分级、RFA前AFP及合并疾病情况比较差异均无统计学意义(P值均>0.05,表1)。
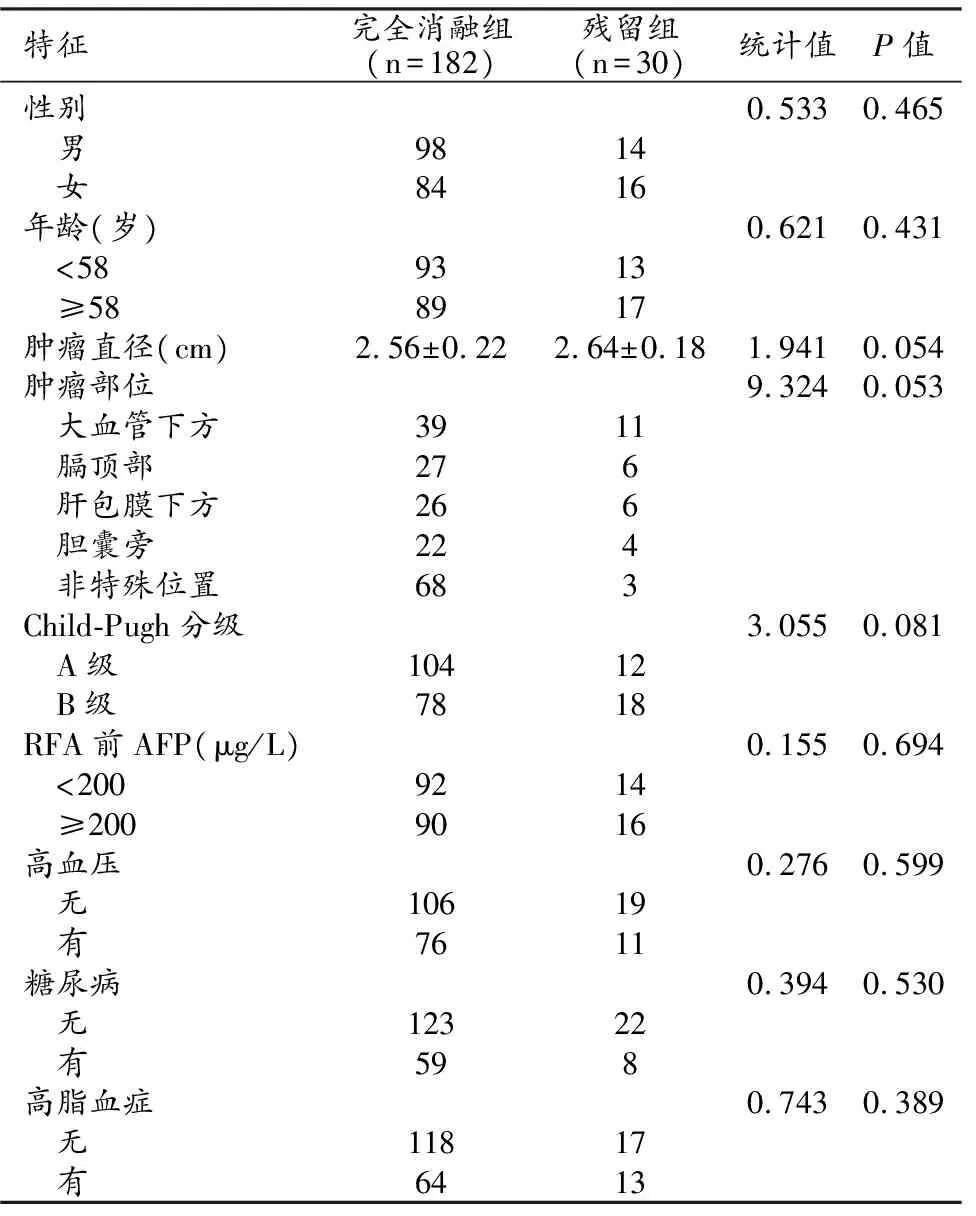
表1 两组患者的一般特征比较 (例)
2.不同疗效肝癌患者的ADC值、血清miR-204水平比较
完全消融组的ADC值为(1.30±0.12)×10-3mm2/s,显著高于残留组[(1.14±0.12)×10-3mm2/s],差异有统计学意义(t=7.091,P<0.001);完全消融组的血清miR-204相对表达量为(1.43±0.12),显著高于残留组[(1.25±0.10)],差异有统计学意义(t=7.246,P<0.001)。
3.ADC值、miR-204水平预测RFA术后疗效的效能
ADC值预测RFA术后肿瘤残留的AUC为0.837(95%CI:0.750~0.923),截断值为1.16,敏感度为70.0%,特异度为90.7%;血清miR-204预测RFA术后肿瘤残留的AUC为0.860(95%CI:0.805~0.916),截断值为1.38,敏感度为96.7%,特异度为66.5%;ADC值联合血清miR-204预测RFA术后肿瘤残留的AUC为0.915(95%CI:0.861~0.970),截断值取ADC值=1.20,miR204=1.31,此时敏感度为86.7%,特异度为90.7%(图5)。
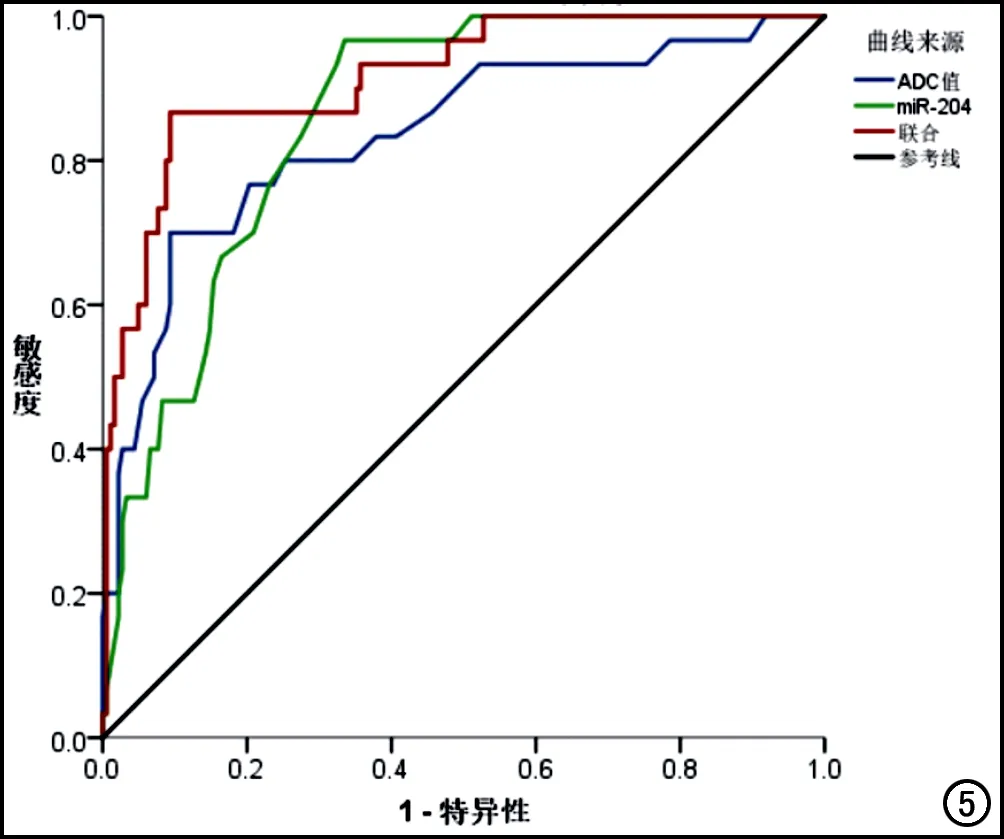
图5 ADC值、miR-204水平及两者联合预测RFA术后疗效的ROC曲线。
4.不同复发情况肝癌患者的一般特征比较
对RFA治疗后完全消融的182例肝癌患者进行随访,期间11例患者失访,将其剔除。最终32例患者复发(复发组,图6、7),复发率为18.7%,139例患者未复发(未复发组)。未复发组与复发组两组患者的性别、年龄、肿瘤直径、肿瘤部位、Child- Pugh分级、RFA术前AFP及合并疾病情况比较差异均无统计学意义(P值均>0.05,表2)。

图6 患者,男,28岁, RFA治疗后肿瘤复发(箭)。 图7 患者,男,57岁,RFA治疗后肿瘤复发(箭)。 图8 ADC值、miR-204水平及两者联合预测RFA术后复发的ROC曲线。

表2 两组患者的一般特征比较 (例)
5.不同复发情况肝癌患者的ADC值、miR-204水平比较
复发组的术前ADC值为(1.21±0.14)×10-3mm2/s,低于未复发组[(1.33±0.13)×10-3mm2/s],差异有统计学意义(t=5.052,P<0.001);复发组的血清miR-204相对表达量为(1.29±0.12),低于未复发组[(1.46±0.14)],差异有统计学意义(t=6.188,P<0.001)。
6.ADC值、miR-204水平预测RFA术后复发的价值
ADC值预测肿瘤复发的AUC为0.742(95%CI:0.646~0.838),截断值为1.22,敏感度为53.1%,特异度为82.0%;血清miR-204预测肿瘤复发的AUC为0.822(95%CI:0.746~0.898),截断值为1.34,敏感度为71.9%,特异度为84.2%;ADC值联合血清miR-204预测肿瘤复发的AUC为0.868(95%CI:0.807~0.929),截断值取ADC值=1.22,miR-204=1.42,此时敏感度为81.3%,特异度为79.1%(图8)。
讨 论
RFA是将电极刺入肿瘤中,通过发射频波,使肿瘤局部温度升高,从而使癌细胞变性坏死,达到杀死癌细胞的目的[10]。作为临床非手术治疗肝癌的主要方法,RFA具有创伤小、并发症少等优点[11]。然而,相关研究表明RFA术后部分肝癌患者会出现复发。因此早期评估RFA治疗后的疗效和预后对选择治疗方式、改善患者预后具有重要意义。MRI检查在肝癌疗效评估中具有重要价值。近年来,大量研究显示血清分子标志物对肝癌疗效和预后评估具有重要意义,miR-204已被证实在肝癌的增殖、转移和耐药性中参与调控作用[9,12]。因此本研究探讨了MRI联合血清miR-204在RFA治疗原发性肝癌后疗效和复发情况中的预测价值。
本研究结果显示,经RFA治疗后,完全消融患者占85.8%,肿瘤残留患者占14.2%,这与李世兴等[13]之前报道的结果类似。对治疗有效与无效组的基础资料进行比较,结果显示性别、年龄、肿瘤直径、肿瘤部位、Child- Pugh分级、RFA前AFP及合并疾病情况两组差异均无统计学意义,这提示可能有其他因素与RFA治疗后的疗效有关。之前的研究表明肿瘤直径和肿瘤位置是影响肿瘤预后的重要因素[14]。郑孝文等[14]的研究结果显示,当病灶直径≥3 cm时,可导致病灶残留率升高,当病灶位于大血管下方时,也可导致病灶残留率升高。本研究中,残留组和复发组的肿瘤直径大于完全消融组和未复发组,虽然完全消融组与残留组、复发组与未复发组间的差异无统计学意义,但P值均接近0.05(分别为0.055和0.053);此外,完全消融组与残留组、复发组与未复发组的的肿瘤部位分布差异均无统计学意义,但P值亦均接近0.05(分别为0.053和0.059),与以上文献报道不符,笔者分析可能的原因如下:①本研究是一项前瞻性研究,医生对处于特殊位置的肿瘤病灶可能更加关注,对特殊部位的肿瘤改进了穿刺操作技术,并且操作更加谨慎,所以可能降低了特殊位置肿瘤的残留率;②本研究样本量不够大,且纳入的肿瘤直径均<3 cm,可能导致一定程度上的统计学偏倚;虽然完全消融组与残留组、复发组与未复发组的肿瘤直径、肿瘤部位分布差异均无统计学意义,但P值均接近0.05,说明两组间还是有明显差异的。本研究结果显示,残留组的ADC值显著低于完全消融组,这与之前的研究结果一致[15]。扩散加权成像能从分子水平反映组织内水分子的扩散运动,ADC值便是其重要指标。之前的研究表明,经RFA治疗后消融区细胞发生不同程度的变性坏死,细胞组织间水分子增多,扩散速率增快,对应扩散图像上的低信号,ADC值也随之增大[15],因此可通过比较肿瘤内部的ADC值分析其内部变化。此外,本研究发现残留组的血清miR-204水平也显著低于完全消融组。之前的研究显示,miR-204对肝癌细胞的生长增殖具有抑制作用,并且可通过靶向NUAK1抑制肝癌耐药,因此当miR-204水平降低时,可能会导致治疗效果较差[16]。本研究结果显示,ADC值和血清miR-204水平降低可能预示着RFA治疗效果不佳,并对这2个指标的预测效能进行了ROC曲线分析;结果显示,ADC值预测RFA术后肿瘤残留的特异度较高(90.7%),但敏感度不佳(70.0%),血清miR-204预测RFA术后肿瘤残留的敏感度较高(96.7%),但特异度有所欠缺(66.5%),因此,笔者尝试联合ADC值与血清miR-204对术后疗效进行了评估,结果显示,两者联合预测的敏感度为86.7%,特异度为90.7%,效能较高。因此,ADC值联合血清miR-204对预测RFA治疗肝癌后的疗效具有较高价值。
笔者进一步对治疗后效果较好的182例患者进行了为期1年的定期随访,剔除11例失访患者后,共有171例患者完成了随访,其中32例(18.7%)患者复发,这与孟兆伟等[15]报道的结果类似。本研究结果显示,复发组的ADC值和血清miR-204均显著低于未复发组。之前研究发现,ADC值是微血管侵犯的独立影响因素,在一定程度上ADC值可反映肝癌细胞的侵袭情况,与肝癌复发有关。Yu等[16]的研究显示,miR-204是一种肿瘤抑制因子,在肝癌的疾病进展和转移中具有重要调控作用,miR-204表达降低预示着患者预后不良。笔者进一步对ADC值、血清miR-204预测RFA治疗后复发的效能进行了评估,结果显示ADC值联合血清miR-204预测肿瘤复发的敏感度为81.3%,特异度为79.1%,效能较高。
本研究存在以下局限性:首先,本研究所有的研究对象均来自同一家医院,因此选择偏倚不可避免;其次,本研究的样本量较小,可能会造成一定程度上的统计学偏倚,进而影响模型的要素选择,因此本研究的结论还需更大样本量研究的证实;最后,本研究是一项前瞻性研究,研究设计中的盲法至关重要,但是在实施过程中无法严格贯彻盲法,因此可能也造成了一定程度上的偏倚。
综上所述,MRI联合血清miR-204对原发性肝癌RFA术后疗效及复发情况具有一定预测价值,可为临床治疗决策的选择提供参考依据。

