MRI在G1/G2胰腺神经内分泌肿瘤病理分级及临床分期中的价值
代博,王梅云,闫峰山,贺慧,窦社伟,张孝先,谭红娜
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,约占胰腺原发肿瘤的1%~2%,发病率有逐年升高的趋势,不同病理分级及临床分期的患者预后有一定差异[1]。既往研究多对pNENs的病理分级进行评估[2-3],然而在临床工作中发现,部分G1及G2患者也会出现淋巴结及远处转移,此时仅评估pNENs与病理分级的关系不能有效地指导治疗,故术前对pNENs病理分级及临床分期进行整体性评价对患者治疗方案的选择及预后评价意义重大。pNENs病理分级及临床分期越高,预后越差,术后生存期越短[4-7]。临床上,pENEs的病理分级及临床分期往往需要结合术后组织学标本进行评估,缺乏有效的术前评价手段,而MRI检查有较高的软组织分辨力及多模态成像的优势。本研究对pNENs的术前MRI征象与术后病理分级及临床分期的关系进行整体性评价,旨在为pNENs患者临床个体化治疗方案的选择提供帮助。
材料与方法
1.病例资料
回顾性分析河南省人民医院、河南省肿瘤医院2016年1月-2019年7月经术后病理证实的pNENs患者的临床病理及术前MRI资料。病例纳入标准:①患者首次经手术病理证实为pNENs,且术前未行任何治疗;②术前行MRI平扫及增强检查,序列完整、图像清晰;③胰腺病灶直径均>5 mm;④临床资料及术后病理学资料完整。共70例患者入组,患者进一步分组时,部分组内病例数较少,因此最终共62例患者入组。
2.检查方法
70例患者均行MRI平扫+多期增强扫描,MRI检查采用3.0T MR扫描仪(Discovery MRI 750,GE Medical Systems,USA),8通道腹部相控阵线圈,扫描范围包括整个胰腺。MRI增强扫描采用双筒高压注射器(Spectris Solaris EP,PA)经肘静脉注入对比剂钆喷酸葡胺(广州康臣公司,国药准字H10950272),流率2.5 mL/s,剂量0.20 mL/kg,然后以同样流率注射20 mL生理盐水冲管,分别于注入对比剂后18 s、70 s、180 s采集动脉期、静脉期、延迟期图像。DWI序列b值取1000 s/mm2。MRI检查各序列的扫描参数见表1。

表1 MRI扫描各序列及其参数
3.病理分析
由2位病理科医师共同观察手术标本的常规HE染色和免疫组织化学染色切片。参照消化系统肿瘤WHO分类第五版(2019年版)胰腺神经内分泌肿瘤的分类标准[8]判定肿瘤病理分级并分为四组:神经内分泌瘤G1 34例(48.57%)、G2 28例(40%)、G3 2例(2.86%),神经内分泌癌(neuroendocrine carcinoma,NEC)6例(8.57%)。参照ENETS2017版TNM分期标准[9]及病理学、影像学判定临床分期并分为两组:Ⅰ期22例(31.43%)和Ⅱ期22例(31.43%)、Ⅲ期6例(8.57%)和Ⅳ期20例(28.57%)。由于G3组及NEC组病例数较少,进行统计分析时有偏倚,影响结果的可信度,因此仅对G1及G2组的62例患者进行图像及统计学分析。
4.MRI图像分析
由2位具有10年以上腹部MRI诊断经验的放射科医师采用盲法分别阅片,当2位医师意见不一致时,请更高级别医师阅片并达成一致结果。病变观察内容包括肿瘤部位(胰头、胰颈、胰体、胰尾)、质地(实性、囊实性、囊性)、边界(清、不清)、平扫及增强扫描信号(低、等、高)、强化是否均匀、主胰管扩张(≥3 mm)、胰腺萎缩、周围组织浸润、淋巴结转移及肝转移等征象。通过公式计算肿瘤直径,肿瘤直径=(横轴面最长径+横轴面最短径+冠状面最长径)/3[10];以正常胰腺组织的信号为参照判断病变信号,在同一序列上,肿瘤信号强度与正常胰腺组织信号相等者为等信号,依此将平扫及增强各期肿瘤信号分为低、等、高信号;肿瘤囊实性界定的标准:强化部分大于整个肿瘤的90%为实性,强化部分小于肿瘤的10%为囊性,强化部分占肿瘤的10%~90%为囊实性[11]。
于GE后处理工作站应用ADW 4.5软件进行ADC值的测定:2位医师在DWI生成的ADC 图上分别测量每例患者肿瘤及正常胰腺实质的ADC值。感兴趣区(region of interest,ROI)取大小为5~10 mm2放置于避开囊变出血坏死的肿瘤最大层面及胰腺实质内。若患者存在多个病灶,则选取最大的病灶测量。每例患者分别测量3个病灶及正常胰腺的ROI,计算平均ADC值,并计算肿瘤ADC值与正常胰腺ADC值的比值。
5.统计学分析
采用SPSS 22.0软件进行统计学分析。采用Kappa一致性检验或组内相关系数(intraclass correlation coefficient,ICC)评价2位医师测量数据的一致性,kappa值为0.20~0.40为一致性差,0.41~0.60为一致性中等,0.61~0.80为一致性好,>0.8为一致性非常好。定量资料进行正态性检验,其中年龄符合正态分布,以均值±标准差表示;对年龄与pNENs的病理分级及临床分期进行方差齐性检验,其中年龄与pNENs的病理分级的比较方差不齐,采用校正t检验;年龄与pNENs的临床分期的比较方差齐,采用两独立样本t检验。直径、ADC值、ADC比值不符合正态分布,以中位数(范围)表示,组间比较采用秩和检验。定性资料以例数表示,质地、DWI信号、静脉期及延迟期信号在不同临床分期及病理分级间的比较、动脉期信号在不同临床分期间的比较采用Fisher's精确概率法;主胰管扩张、胰腺萎缩、T2WI信号、淋巴结转移在不同临床分期及病理分级间的比较、肝转移及周围组织浸润情况在不同临床分期间的比较采用卡方检验的连续校正,余指标的组间比较采用卡方检验。以P<0.05为差异有统计学意义。
结 果
1.一般情况及MRI判读一致性分析
本研究最终共入组62例患者,其中男40例,女22例,平均年龄(51.52 ±10.01)岁;62例病变均为单发(图1~3),62个病灶直径平均值为27.959 mm(8.42~77.00 mm)。患者的首发症状包括无症状、低血糖症状(包括头晕、乏力和意识障碍等)、腹痛、高血压、血糖升高和其它症状(如黄疸)。

图1 胰头pNENs患者,肿瘤边界清晰,术后病理:胰腺神经内分泌瘤(G1、Ⅰ期)。a) T1WI示病灶呈低信号; b) T2WI抑脂序列示病灶呈高信号; c) DWI示病灶呈高信号; d) 增强扫描动脉期示病灶明显强化; e) 静脉期强化未见减退; f) 延迟期强化未见减退。
2位医师对MRI病灶部位、直径、质地、边界、T1WI/T2WI/DWI信号、ADC值、ADC比值、强化是否均匀、增强三期信号、主胰管扩张、胰腺萎缩、周围组织浸润、淋巴结转移及肝转移情况的判读一致性较好,kappa值或ICC值均>0.75。
2.pNENs临床及定量MRI参数在不同病理分级及临床分期间的差异比较
然而,由于酶促反应涉及的步骤增加及后处理导致的成本增加,使得酶促反应的工业应用受到一定限制。研究表明,酶促反应中添加表面活性剂,不仅可以提高酶的水解速率,还可以降低酶的负载[7-9]。目前,表面活性剂辅助酶解技术很少涉及食品工业。本文利用酶和表面活性剂辅助提取辣椒中的辣椒碱、辣椒二氢碱、辣椒红色素,通过单因素试验和正交试验优化其提取工艺,考察酶和表面活性剂添加量、酶解温度和酶解时间等对其提取率的影响规律,为辣椒的精加工和综合利用提供一定的科学理论依据。
本研究结果显示肿瘤直径及ADC比值在pNENs不同病理分级及临床分期间的差异均有统计学意义(P值均<0.05);而年龄、ADC值在不同病理分级及临床分期间的差异均无统计学意义(P值均>0.05);性别在不同病理分级间的差异无统计学意义(P>0.05),在不同临床分期间的差异有统计学意义(P<0.05,表2)。

表2 pNENs临床及定量MRI参数在pNENs不同病理分级及临床分期间的差异比较

图2 胰尾pNENs患者,肿瘤边界清晰,术后病理:胰腺神经内分泌瘤(G2、Ⅱ期)。a) T1WI示病灶呈低信号; b) T2WI抑脂序列示病灶呈高信号; c) DWI示病灶呈高信号; d) 增强扫描动脉期示病灶明显强化; e) 静脉期强化未见减退; f) 延迟期强化未见减退。
3.pNENs MRI征象在不同病理分级及临床分期间的差异比较
MRI征象表现为边界不清(图3b)、周围组织浸润(图3b)的pNENs患者,其病理分级及临床分期均较高,在不同病理分级及临床分期间的差异均有统计学意义(P值均<0.05);此外,pNENs病灶呈囊实性、有淋巴结转移及肝转移者在临床分期较高的病灶中较多见,在不同临床分期间的差异均有统计学意义(P值均<0.05),余指标在不同病理分级及临床分期间的差异均无统计学意义(P值均>0.05,表3)。
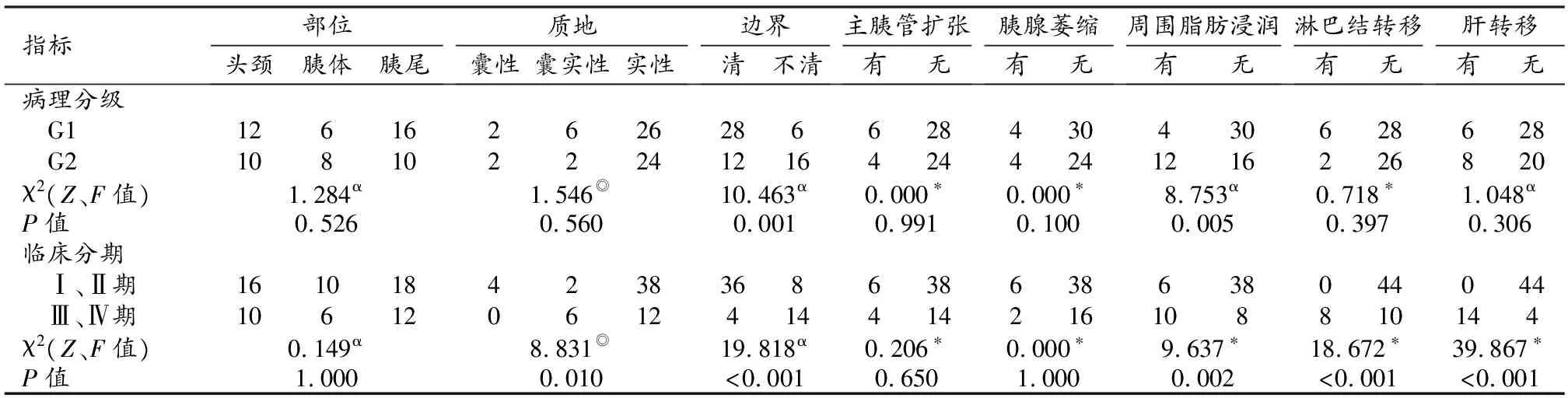
表3 pNENs MRI征象在不同病理分级及临床分期间的差异比较 (例)
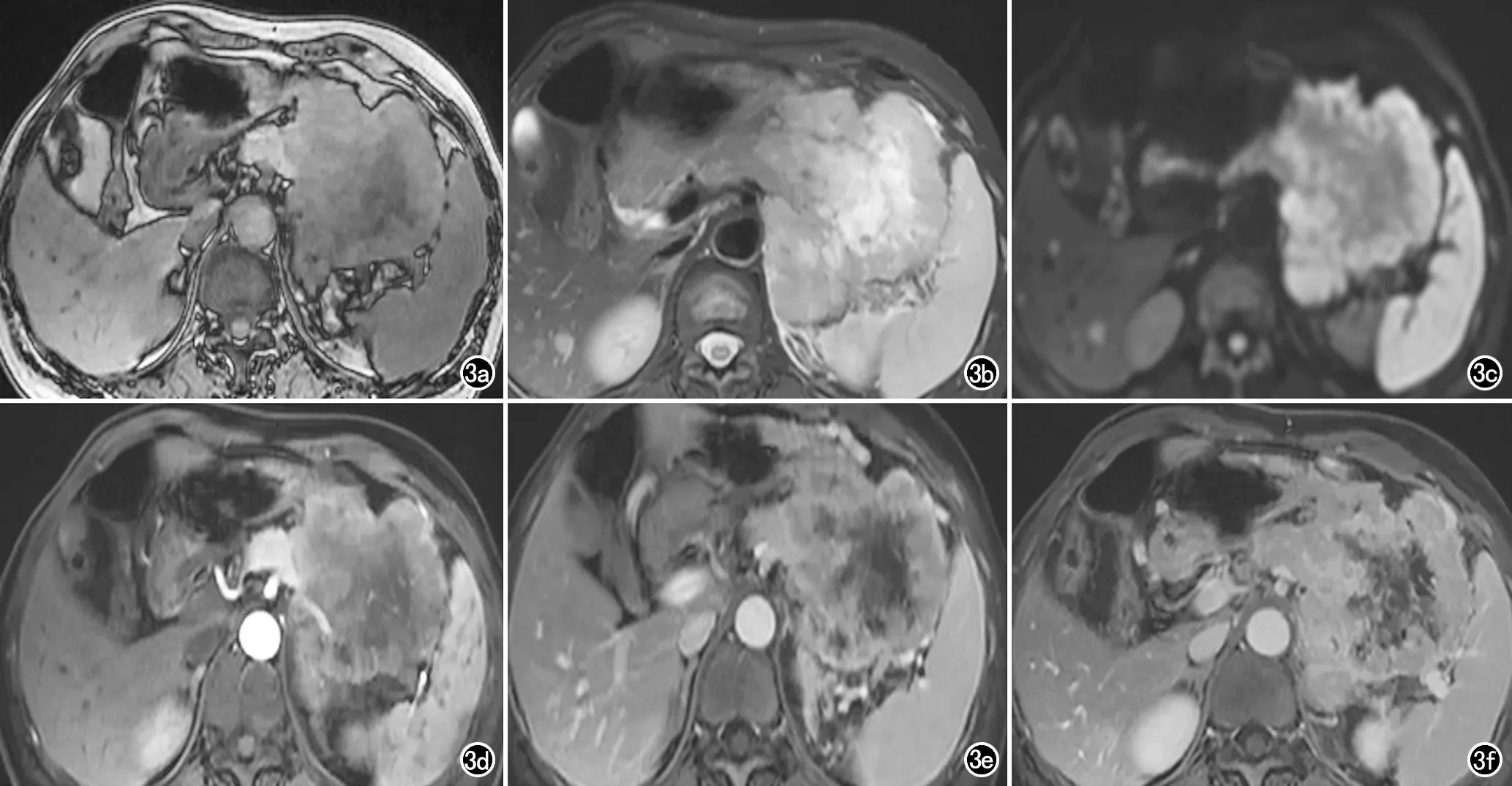
图3 胰尾pNENs患者,边界不清,术后病理:胰腺神经内分泌癌(G3、Ⅳ期)。a) T1WI示病灶呈低信号; b) T2WI抑脂序列示病灶呈高信号; c) DWI示病灶呈高信号; d) 增强扫描动脉期示病灶强化不均; e) 静脉期示病灶强化程度增加; f) 延迟期示病灶强化程度增加。
4.pNENs 平扫及增强MRI特征在不同病理分级及临床分期间的差异比较
强化不均(图3d~f)易出现在病理分级及临床分期较高的肿瘤中,在不同病理分级及临床分期间的差异均有统计学意义(P值均<0.05)。DWI信号及静脉期、延迟期MRI信号(图3e、f)在不同病理分级间的差异有统计学意义(P值均<0.05);余指标在不同pNENs病理分级及临床分期间的差异均无统计学意义(P值均>0.05,表4、图1~3)。
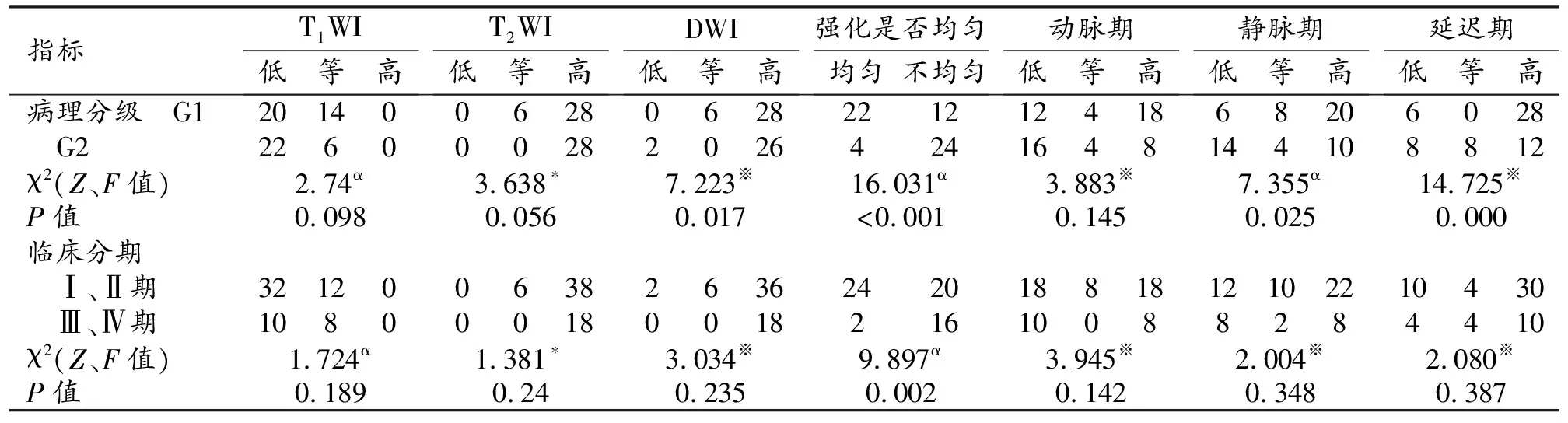
表4 pNENs 平扫及增强MRI特征在不同病理分级及临床分期间的差异比较 (例)
讨 论
本研究结果显示肿瘤直径、周围组织浸润在不同pNENs病理分级及临床分期间的差异均有统计学意义,且肿瘤直径越大,出现此征象的患者其病理分级及临床分期越高,与文献报道基本相符[10,12-13]。淋巴结转移及肝转移在不同pNENs临床分期间的差异有统计学意义,而在不同病理分级间的差异无统计学意义。本研究中G1组淋巴结转移占17.6%,高于G2组(7.1%);G1组中肝转移占17.6%,低于G2组(28.5%),但两者间差异无统计学意义。可能与本组病例在选择上存在偏倚有关,也可能是因为肿瘤病理分级更多反映的是肿瘤细胞分化及细胞增殖的情况,在反映肿瘤侵袭及转移方面价值有限。本组病例患者伴淋巴结或肝转移中有6例病理分级为G1、临床分期为IV期,8例病理分级为G2、临床分期为IV期,此时如果只参考病理分级,可能会提出错误的治疗方案,延误最佳治疗时机。因此,我们在做术前诊断的时候应该多关注基于影像学的肿瘤临床分期,后者能更准确地反映肿瘤的侵袭性及转移情况,为临床决策提供有价值的参考信息。
本研究结果显示病灶边界在不同病理分级、临床分期间的差异均有统计学意义,且随着肿瘤病理分级、临床分期增高,边界不清的肿瘤所占比例越高,与文献报道结果基本一致[10,12-13]。病变边界清楚与否在一定程度上反映了肿瘤的生长方式及向周围组织的浸润情况。因此,随着肿瘤病理分级及临床分期的增高,边界不清的比例也会随之增高。本研究结果还显示肿瘤的质地、部位、主胰管扩张、胰腺萎缩、T1WI、T2WI信号在不同病理分级及临床分期间的差异均无统计学意义。
ADC值作为DWI的定量评价指标,可定量反映pNENs病灶内水分子的扩散受限程度、细胞密度等,进一步反映其病理生理学特性。既往文献表明,肿瘤的ADC值与其恶性程度相关,ADC值随着恶性程度的增高而降低[14]。本研究结果显示DWI信号在不同病理分级间的差异有统计学意义,在不同临床分期间的差异无统计学意义;而ADC值在不同病理分级及临床分期间的差异均无统计学意义。这可能与本研究将DWI信号粗略分为三种,不能反映肿瘤信号的细微差别有关;而ADC值为定量指标,能准确反映肿瘤中水分子的扩散受限程度。ADC比值将肿瘤ADC值与正常胰腺ADC值做对比,在排除患者自身胰腺信号的差异后,更能反映肿瘤组织相对于正常胰腺组织ADC值的变化情况,且随着肿瘤病理分级及临床分期的增高,ADC比值降低,这与Jang等[15]的研究结果一致;这同时也说明ADC比值能在一定程度上反映肿瘤的恶性程度,可以作为判断肿瘤病理分级、临床分期的指标。
本研究中G1组肿瘤大部分呈持续性高强化,部分呈渐进性强化;G2组肿瘤可呈持续性高强化和渐进性强化[16],也可呈持续性稍低强化[17]。肿瘤强化是否均匀在不同pNENs病理分级及临床分期间的差异有统计学意义,且随着肿瘤级别增高,肿瘤体积增大,病变中心及周围的血供情况不一致,更易造成肿瘤的囊变坏死及增强检查中的强化不均现象,与既往文献结果一致[12-13,18]。MRI增强扫描静脉期及延迟期中的肿瘤信号特点在不同pNENs病理分级间的差异有统计学意义;动脉期的肿瘤信号特点在不同病理分级及临床分期间的差异、静脉期及延迟期的肿瘤信号特点在不同临床分期间的差异均无统计学意义,与既往文献结果不一致[10,12-13,18],这可能与本组病例中出现转移比例较高及本组病例的特殊性有关。动态增强信号特征能反映肿瘤血供情况,在一定程度上反映肿瘤细胞致密程度,因此与病理分级有关;而临床分期主要反映肿瘤侵袭及转移情况,与肿瘤的形态学特征关系密切,与肿瘤信号特征关系相对较小。
本研究存在以下局限性:首先,本研究为回顾性研究,虽然尽可能按照纳入标准选择病例,但是不可避免会出现偏倚;其次,pNENs为少见病,本研究纳入的样本量较小,特别是G3期病例较少,统计结果也可能存在偏倚,需要加大样本量进一步验证研究结果;最后,由于纳入样本量较少,且部分分组中病例数为0,因此肿瘤病理分级及临床分期与MRI征象无法进行多因素回归分析。
综上所述,pNENs病灶边界不清、强化不均、周围组织浸润、较低的ADC比值同时与较高的术前病理分级及临床分期相关,这些征象提示患者病理分级及临床分期较高,有助于临床医生术前准确且全面评估pENEs的异质性,辅助患者的个性化治疗。

