西达本胺辅助CHOP化疗方案治疗T细胞淋巴瘤患者疗效分析
李莉 徐赟 郭猛
·临床论著·
西达本胺辅助CHOP化疗方案治疗T细胞淋巴瘤患者疗效分析
李莉 徐赟2郭猛3
(1. 淅川县人民医院肿瘤血液科,河南 南阳 474450;2. 南阳市中心医院肿瘤内科三病区,河南 南阳474450;3. 南阳市中心医院病理科,河南 南阳 474450)
探讨西达本胺辅助CHOP(环磷酰胺+吡柔比星+长春地辛+地塞米松,Cyclophosphamide +theprubicin+Vindesine+ Dexamethasone)化疗方案治疗T细胞淋巴瘤(T-cell lymphoma,TCL)患者的效果。回顾性收集2017年6月至2020年6月淅川县人民医院64例TCL患者资料,根据治疗方案不同分组,采用CHOP方案治疗的30例为对照组,对照基础上西达本胺辅助治疗的34例为观察组。治疗24周后比较两组客观缓解率(Objective Response Rate,ORR)、毒副反应发生率、治疗前后血管内皮生长因子(Vascular endothelial growth factor,VEGF)、精氨酸酶1(Arginase-1,Arg-1)、CC趋化因子配体17(CC chemokine ligand 17,CCL17)、CCL22及其受体趋化因子受体4(CC chemokine receptor 4,CCR4)基因的表达。观察组ORR高于对照组(P<0.05);治疗后观察组血清VEGF、Arg-1水平低于对照组(P<0.05);治疗后观察组CCL17高于对照组,CCR4表达量低于对照组(P<0.05)观察组血液系统毒副反应发生率低于对照组(P<0.05),两组消化系统、全身反应、呼吸系统、心血管系统、神经系统、泌尿系统毒副反应发生率差异无统计学意义(P>0.05)。西达本胺辅助化疗案治疗TCL效果显著,可有效调节趋化因子及其受体,通过降低VEGF、Arg-1水平缩小淋巴结,减少血液系统毒副反应。
西达本胺;T细胞淋巴瘤;VEGF;Arg-1
T细胞淋巴瘤(T-cell lymphomas,TCL)是常见非霍奇金淋巴瘤,在西方国家中约占非霍奇金淋巴瘤的5%~15%,在亚洲约占15%~20%,具有异质性明显、病情进展迅速、治疗难度大、预后差等特点[1]。据相关数据统计,TCL 5年生存率仅30%左右[2]。目前临床治疗TCL以环磷酰胺+吡柔比星+长春地辛+地塞米松(环磷酰胺CTX Cyclophosphamide 600 mg•m-2,吡柔比星THP theprubicin,90 mg•m-2,长春地辛VDS Vindesine,2 mg•m-2,地塞米松DEX Dexamethasone,20 mg•m-2,CHOP)及类CHOP方案为主,但有化疗耐药性等问题。西达本胺是我国自主研发的组蛋白去乙酰化酶缓聚剂,可抑制血管形成、促进细胞分化、诱导细胞凋亡,有研究表明,此药物具良好的抗肿瘤效果[3],但其辅助CHOP方案能否进一步提高TCL治疗效果仍缺乏大量循证依据。基于此,本研究旨在从抗肿瘤疗效、淋巴结及疾病相关因子变化等方面分析辅助治疗的应用价值。现报告如下。
1 资料与方法
1.1 一般资料
回顾性收集2017年6月至2020年6月淅川县人民医院64例TCL患者资料,根据治疗方案不同分组,采用CHOP方案治疗的30例为对照组,男17例,女13例,平均年龄49.31±5.65岁;TCL类型:外周TCL 19例、血管免疫母细胞性TCL 4例、鼻腔NK/TCL 4例、皮下膜脂炎性TCL 2例、皮肤TCL 1例;Ann Arbor分期:Ⅰ期4例,Ⅱ期10例,Ⅲ期12例,Ⅳ期4例;结外浸润12例。采用西达本胺辅助CHOP方案治疗的34例为观察组,男18例,女16例,平均年龄51.26±6.28岁;TCL类型:外周TCL 20例、血管免疫母细胞性TCL 4例、鼻腔NK/TCL 6例、皮下膜脂炎性TCL 3例、皮肤TCL 1例;Ann Arbor分期:Ⅰ期5例,Ⅱ期13例,Ⅲ期12例,Ⅳ期4例;结外浸润15例。
两组一般资料对比,差异无统计学意义(P>0.05),且研究经医院伦理委员会审核批准。
纳入标准:均经手术或活检病理检查确诊为TCL;初次接受治疗;化疗前血常规、心电图等检查正常;预计生存期超过6个月;临床资料完整。
排除标准:合并其他恶性肿瘤;严重肝肾功能障碍者。
1.2 方法
1.2.1 对照组
采用CHOP方案治疗。静滴长春地辛(山西普德药业有限公司,国药准字H20056415)2 mg•m-2,d1;静滴吡柔比星(瀚晖制药有限公司,国药准字H20045983)90 mg•m-2,d1;静滴环磷酰胺(Baxter Oncology GmbH,批准文号H20160467)600 mg•m-2,d1-2;静滴地塞米松(江苏恒沣药业有限公司,国药准字H32020227)20 mg•m-2,d1-4。4周为1个周期,持续治疗6个周期。化疗期间保持口腔清洁,预防肛周感染,同时保肝护胃。
1.2.2 观察组
采用西达本胺(深圳微芯药业有限责任公司,国药准字H20140129)辅助CHOP方案治疗,CHOP方案同对照组,口服西达本胺每次30 mg,2次•周-1,持续用药4周后暂停2周,6周为1个周期,持续治疗4个周期。
1.3 观察指标
治疗24周后比较两组疗效、淋巴结缩小率、毒副反应发生率。淋巴结体积通过CT扫描图像获取,淋巴结缩小率公式:(放疗前淋巴结体积-放疗后体积)/放疗前体积*100%。
疗效评估标准参考淋巴瘤疗效评价标准[4]分级:完全缓解(Complete remission,CR):所有靶病灶消失;部分缓解(Partial remission,PR):靶病灶最大径和减少≥:靶病;病情稳定(Stable disease,SD):靶病灶既未消失也未进展;病情进展(Progressive Disease,PD):靶病灶最大径和增加≥:靶病或出现新的病灶。CR、PR之和计入客观缓解率(Objective response rate,ORR)。
治疗期间监测患者血液系统、消化系统、全身反应、呼吸系统、心血管系统、神经系统、泌尿系统等毒副反应情况,所有毒副反应均按照严重程度分为Ⅰ级、Ⅱ级、Ⅲ级。
治疗前、治疗24周后采集空腹静脉血3 mL,离心处理,3000 rpm,10 min,取上清液,保存于-80℃恒温冰箱内,待检。采用酶联免疫吸附法检测血清血管内皮生长因子(Vascular endothelial growth factor,VEGF)、精氨酸酶1(Arginase 1,Arg-1)、CC趋化因子配体17(CC chemokine ligand 17,CCL17)、CCL22及其受体趋化因子受体4(CC chemokine receptor 4,CCR4)水平,试剂盒购自美国贝克曼库尔特公司,所有操作遵循试剂盒说明书。
1.4 统计学处理
2 结果
2.1 疗效
观察组CR 5例,PR 23例,SD 3例,PD 3例。对照组CR 3例,PR 15例,SD 8例,PD 4例。观察组ORR 82.35%(28/34)高于对照组60.00%(18/30)(P<0.05)。
2.2 血清VEGF、Arg-1水平
与治疗前相比,各治疗组的血清VEGF、Arg-1水平均明显降低(P<0.05),其中观察组更为显著(P<0.05)。见表1。
2.3 血清CCL17、CCL22、CCR4水平
与治疗前相比,各治疗组的血清CCL17均明显增加,CCR4水平均明显降低(P<0.05),其中观察组更为显著(P<0.05)。见表2。
2.4 毒副反应
观察组血液系统毒副反应发生率低于对照组(P<0.05),两组消化系统、全身反应、呼吸系统、心血管系统、神经系统、泌尿系统毒副反应发生率差异无统计学意义(P>0.05),见表3。
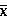
表1 两组血清VEGF、Arg-1水平对比(±SD)
注:与同组治疗前对比,*P<0.05;与同期对照组相比,#P<0.05。
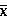
表2 两组血清CCL17、CCL22、CCR4水平对比(±SD)
注:与同组治疗前对比,*P<0.05;与同期对照组相比,#P<0.05。
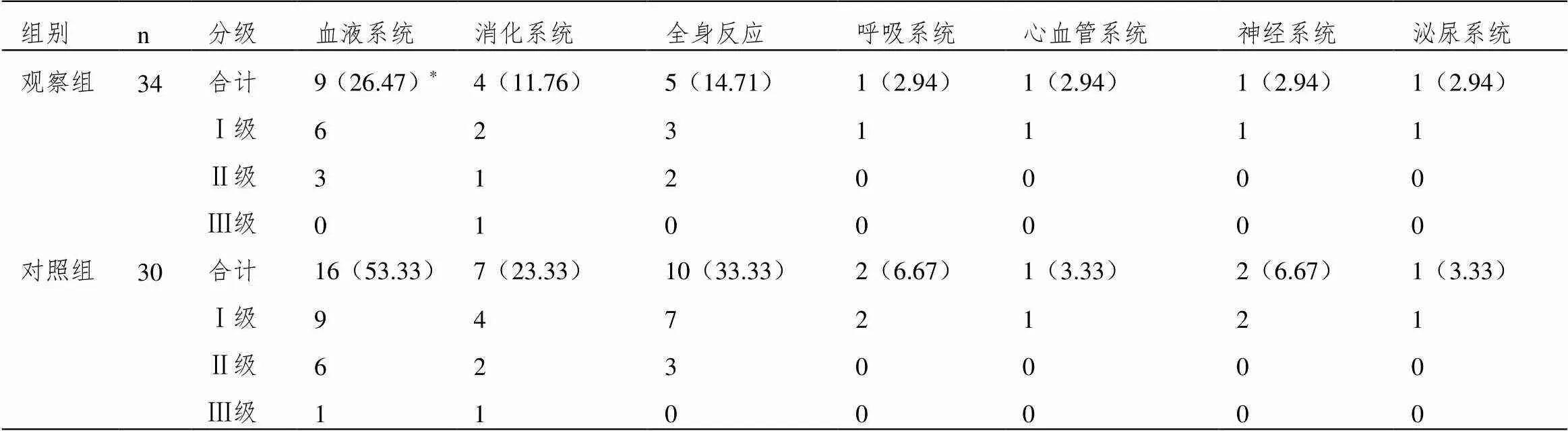
表3 两组毒副反应发生率(n(%))
注:与对照组相比,*P<0.05。
3 讨论
近年研究显示,表观遗传学与肿瘤发生、发展密切相关,可为恶性肿瘤的治疗提供新思路[5-6]。组蛋白乙酰化及去乙酰化是基因调控过程中重要环节,HDAC参与肿瘤的发生、进展,故有望采用HDAC抑制剂干扰HDAC活性,发挥抗肿瘤作用。西达本胺是一种第Ⅰ类HDAC中的1、2、3亚型和第Ⅱb类的10亚型的HDAC缓聚剂,可调控肿瘤异常表观遗传功能。本研究结果显示,观察组ORR 82.35%高于对照组,血液系统毒副反应发生率低于对照组,与章海英等[7]学者研究结果相似,可见,西达本胺辅助CHOP方案治疗TCL不仅疗效显著,且安全性有保证。西达本胺具有以下作用机制:(1)可有效抑制相关HDAC亚型,提升染色质组蛋白乙酰化水平,造成染色质重塑,并产生表观遗传改变,阻断肿瘤细胞周期,同时可强化抗原特异性细胞毒T细胞、NK细胞活性,提升肿瘤杀伤能力;(2)促进肿瘤干细胞分化,逆转肿瘤细胞上皮间充质转化,提升耐药肿瘤细胞对药物敏感性。因此,西达本胺与CHOP方案不仅可从不同途径协同促进肿瘤细胞凋亡,还可增强化疗敏感性,进一步提升治疗效果。
T淋巴细胞瘤由于免疫抑制、侵袭性强等特点,需大量VEGF促内皮细胞迁移、血管生成,从而促进肿瘤浸润[8]。Arg-1可分解环境内的精氨酸,而精氨酸属T细胞活化必需氨基酸,对T细胞增殖和功能具有抑制作用,因此,Arg-1可为TCL生长提供帮助。原发肿瘤生长、侵袭、转移是多因素参与、多步骤协同的过程,趋化因子与其相应受体结合后,通过激活抗凋亡途径、增加血管新生等多种机制参与恶性肿瘤的生长、侵袭和转移[9-10]。本研究发现,观察组治疗后血清VEGF、Arg-1水平、CCL17、CCR4表达量低于对照组,客观证实西达本胺辅助CHOP方案治疗TCL的抗肿瘤效果,趋化因子及其受体可作为药物作用靶点,为今后治疗方案的更新提供方向。但本研究作为回顾性观察试验,尚未探明西达本胺辅助CHOP方案对VEGF、Arg-1、CCL17、CCR4等变化的具体作用机制,仍需更多实验进一步深入探究。
综上可知,西达本胺辅助CHOP方案治疗TCL效果显著,可有效调节趋化因子及其受体,通过降低VEGF、Arg-1水平缩小淋巴结,减少血液系统毒副反应。
1 郭智,刘晓东,刘玄勇,等.EPOCH-L方案治疗复发难治性T细胞淋巴瘤的临床研究[J].现代生物医学进展,2019,19(19):3694-3698.
2 仲凯励,王斌,王伟霞,等.含脂质体多柔比星方案治疗成年人T细胞淋巴瘤临床分析[J].肿瘤研究与临床,2020,32(5):352-356.
3 王杰松,何鸿鸣,杨瑜,等.西达本胺治疗外周T细胞淋巴瘤的效果和安全性分析[J].解放军医药杂志,2018,30(12):15-18.
4 Younes A,Hilden P,Coiffier B,et al.International Working Group consensus response evaluation criteria in lymphoma (RECIL 2017)[J].Ann Oncol, 2017, 28(7): 1436-1447.
5 许伟,丁现超,任小晶.沙利度胺联合CHOP方案治疗外周T细胞淋巴瘤的临床研究[J].现代药物与临床,2017,32(5):897-900.
6 温晓莲,赵瑾,苏丽萍.西达本胺治疗外周T细胞淋巴瘤的临床效果及安全性[J].肿瘤研究与临床,2020,32(9):633-636.
7 章海英,赖卫强.西达本胺治疗T细胞淋巴瘤的疗效及毒副作用研究[J].药品评价,2019,16(20):3-4,12.
8 王永亮,任小晶,刘飞,等.沙利度胺联合CHOP方案治疗86例非特异性外周T细胞淋巴瘤的临床研究[J].北方药学,2018,15(3):93-94.
9 罗强,金真伊,陈少华,等.TRGV及预后相关趋化因子/受体基因在T细胞淋巴瘤中的表达变化[J].细胞与分子免疫学杂志,2017,33(3):362-366.
10 江亚军,朱贵华,何耀,等.弥漫大B细胞淋巴瘤患者外周血CD14^+单核细胞TF,VEGF表达的临床意义[J].中国实验血液学杂志,2019,27(1):79-85.
Efficacy analysis of sitabenamine adjuvant chemotherapy regimen for T cell lymphoma
Li Li1, Xu Yun2, Guo Meng3
(1. Department of Tumor Hematology, Xichuan People's Hospital, Nanyang 474450, Henan, China; 2. Division 3, Department of Oncology, Nanyang Central Hospital, Nanyang 474450, Henan, China; 3. Department of Pathology, Nanyang Central Hospital, Nanyang 474450, Henan, China)
To investigate the efficacy of cedabenamide combined with cyclophosphamide + theprubicin+vindesine + dexamethasone (CHOP) chemotherapy in the treatment of T-cell lymphoma (TCL).Data of 64 TCL patients in Xichuan County People's Hospital from June 2017 to June 2020 were retrospectively collected. According to different treatment regimens, 30 patients were treated with CHOP regimen as the control group, and 34 patients were adjuvant therapy with cedabenamine as the observation group.Response Rate (Objective Response Rate, ORR, incidence of toxic and side effects, Vascular endothelial growth factor (VEGF), Arginase-1 (ARG-1) and CC chemokine ligand 17 (CC chemokine) before and after treatment Ligand 17,CCL17), CCL22 and their receptor CC chemokine receptor 4 (CCR4) gene expression. Results: THE ORR of observation group was 82.35% (28/34) higher than that of control group 60.00% (18/30, P < 0.05). After treatment, the levels of serum VEGF and ARG-1 in observation group were lower than those in control group (P < 0.05). After treatment, CCL17 in the observation group was higher than that in the control group, and CCR4 expression was lower than that in the control group (P < 0.05). The incidence of toxicity and side effects in blood system of observation group was lower than that of control group (P < 0.05).Cedabenamine can effectively regulate chemokines and their receptors, reduce lymph nodes by reducing VEGF and ARG-1 levels, and reduce toxic reactions in the blood system.
Cedarbenamide; T cell lymphoma; VEGF; Arg-1
作者简介:李莉,女,主治医师,主要从事恶性肿瘤相关得工作,Email:worthlate666@163.com。
(2021-7-31)

