吡格列酮对糖基化低密度脂蛋白诱导血管内皮细胞损伤的保护作用
刘城言 孙宪昌 于凤秀 朱文君 张 颖 司艳红
山东第一医科大学(山东省医学科学院)1.临床医学院;2.基础医学院;3.公共卫生学院,山东济南 250117
随着社会发展、生活方式的改变以及人口老龄化的加剧,糖尿病(diabetes mellitus,DM)发病率逐渐升高。糖尿病本身并不可怕,可怕的是一系列并发症,其中慢性并发症糖尿病血管病变在临床最为常见,对人类健康威胁最大[1-2]。据统计,10 年以上病程的患者中,78%以上均可出现不同程度的心血管系统疾病[3]。美国胆固醇教育指南也明确指出:DM是冠心病的等危症,即DM患者发生冠心病的风险指数与冠心病患者再发指数相当[4]。因此,临床合理用药,保护血管内皮损伤对防治DM 并发症具有重要意义。
噻唑烷二酮是一类通过激活过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)发挥作用的抗糖尿病药物,吡格列酮(pioglitazone,PIO)是此类代表药物之一[5]。PIO能够增加胰岛素敏感性,改善胰岛β细胞功能,具有明显降血糖功效。然而,PIO 对血管内皮细胞损伤是否具有保护作用尚不明确。由于人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)是研究血管损伤的典型细胞,本实验建立了糖基化低密度脂蛋白(glycosylated low density lipoprotein,glc-LDL)损伤HUVECs 细胞模型,观察PIO的干预功效。
1 材料与方法
1.1 主要药品与试剂
HUVECs 购自上海生物化学研究所;羧甲基赖氨酸(carboxymethyl lysine,CML)ELISA试剂盒购自BlueGene 公司;胎牛血清购自 Gibco 公司;RPMI-1640 培养基、胰酶购自 HyClone 公司;PIO、MTT 粉末购自Sigma 公司;乳酸脱氢酶(lactate dehydrogen ase,LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购于南京建成生物工程研究所;活性氧(ractive oxygen species,ROS)检测试剂盒购自 Solarbio 公司;荧光定量PCR 试剂盒(UltraSYBR Mixture)购自北京康为世纪生物科技有限公司;细胞间粘附分子-1(intercellular adhesion molecule-1,ICAM-1)、血管细胞粘附分子-1(vascular cell adhesion molecule-1,VCAM-1)引物购自上海生工生物技术有限公司。
1.2 LDL的提取与糖基化修饰[6]
健康人新鲜血浆采用密度梯度超速离心法分离出LDL(1.019 ~ 1.063 g/mL),在含有1 mmol/L 乙二胺四乙酸(ethylenediamine tetra acetic acid,EDTA)的PBS溶液中4 ℃透析24 h,过滤除菌。将LDL(2 g/L)与葡萄糖(50 mmol/L)在无菌PBS 中(含2 mmol/L EDTA)37 ℃避光共孵育7 d,而后在含1 mmol/L EDTA 的PBS 溶液中透析24 h 去除多余葡萄糖。LDL 在高血糖环境下其多肽链上赖氨酸残基易与葡萄糖发生非酶促反应生成糖基化终产物CML,故通过ELISA测定CML含量反映LDL糖基化程度。本次实验中gly-LDL 中CML 浓度为242.5±52.9 pg/mg protein,明显高于 未糖化 LDL 中 水平(79.4 ±15.9)pg/mg protein,这提示LDL已充分糖基化。
1.3 细胞培养与细胞分组
HUVECs 细胞置于RPMI-1640 培养基(含有10%胎牛血清、1%青霉素-链霉素)中生长。细胞实验时,取对数生长期细胞种于6 或96 孔板,调整细胞密度为1×108/L。细胞同步化处理后,随机分为5 组:对照组,无药物干预,无损伤;模型组,无药物干预,glc-LDL(100 mg/L)损伤细胞24 h;PIO低、中、高剂量组,分别给予不同浓度PIO(1、10、100 μmol/L)干预3 h 后,加入glc-LDL 继续培养24 h 损伤细胞。收集细胞和培养液,检测相关指标。
1.4 MTT检测细胞存活率
细胞接种于96 孔板,每孔200 μL,根据实验分组干预结束后,每孔加入10 μL MTT 溶液(5 g/L),继续培养4 h 后吸弃上清,加入150 μL 二甲基亚砜(dimethyl sulfoxide,DMSO)溶液,震荡10 min,待结晶完全溶解后,使用酶标仪于490 nm波长处测定各孔吸光度值。
1.5 LDH活性检测
各组细胞培养液离心后,取上清,根据试剂盒说明书操作,最后使用酶标仪于520 nm波长处测吸光度值。
1.6 流式细胞仪检测细胞内ROS
采用DCFH-DA 作为荧光染料,经流式细胞仪测定细胞荧光强度反应ROS 水平,主要过程如下:各组细胞干预结束后,弃培养基,无菌PBS 洗3 次,每孔加入 1 mL 含 10 μmol/L DCFH-DA 的无血清培养基,继续孵育30 min,PBS 洗3 次,胰酶消化后收集细胞,培养基重新悬浮后经流式细胞仪检测。
1.7 MDA含量、SOD活性检测
6孔板中细胞每孔加入200 μL RIPA裂解细胞,离心取上清,按照说明书步骤分别测定MDA 浓度、SOD活性,同时使用BCA蛋白浓度测定试剂盒检测细胞中总蛋白浓度,结果以每毫克蛋白中MDA、SOD相对水平表示。
1.8 荧光定量PCR
通过Trizol 试剂提取HUVECs 细胞中总RNA,逆转录为cDNA,采用UltraSYBR Mixture 试剂盒进行实时定量PCR 检测获取Ct 值。所用引物序列详见表1,以β-actin 作为内参基因进行标准化。PCR反应条件如下:95 ℃ 10 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 32 s,循环40 个周期。最终结果按照2-△△Ct计算目的基因mRNA的相对表达量。

表1 荧光定量PCR引物序列
1.9 统计学处理
采用SPSS 19.0 软件进行统计学分析,数据以均数 ± 标准差()的形式表示。多组间比较采用单因素方差分析及LSD法。检验水准α=0.05。
2 结 果
2.1 PIO 升高 glc-LDL 损伤后 HUVECs 细胞存活率。
由 MTT 结果分析可知,100 mg/L glc-LDL 损伤HUVECs 24 h 后,细胞存活率降低了29%,100 μmol/L PIO 干预可逆转此抑制效应,使存活率升高了25%(图1A)。
2.2 PIO 降低glc-LDL 损伤后血管内皮细胞LDH的漏出。
如图1B 所示,与对照组相比,模型组细胞培养液中LDH 活性明显升高,为正常对照组的2.3 倍。然而,10 μmol/L PIO 及 100 μmol/L PIO 孵育可使培养液中LDH活性分别降低18%和29%。

图1 PIO对内皮细胞存活率及LDH漏出的影响
2.3 PIO减轻glc-LDL诱导的HUVECs细胞内氧化应激反应。
为评价细胞内氧化应激水平,本实验测定了HUVECs 细胞内 ROS 水平、MDA 含量和 SOD 活性。结果显示,与对照组相比,模型组中100 mg/L glc-LDL处理细胞24 h,引起细胞内ROS 和MDA 含量升高,SOD 活性降低。然而,100 μmol/L PIO 干预可使细胞内ROS 总体水平降低29%,使膜脂过氧化指标MDA水平降低25%,使细胞内氧自由基清除剂SOD升高41%(图2)。
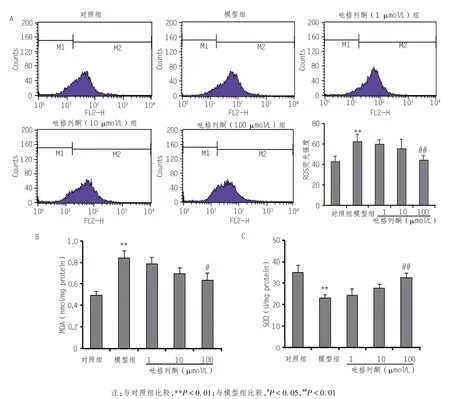
图2 PIO对内皮细胞中ROS水平、MDA含量及SOD活性的影响
2.4 PIO抑制glc-LDL诱导的HUVECs细胞内粘附分子ICAM-1、VCAM-1表达。
荧光定量PCR结果显示,glc-LDL(100 mg/L,24 h)可增加HUVECs内皮细胞ICAM-1和VCAM-1表达。然而,100 μmol/L PIO 干预使细胞内ICAM-1水平下调了34%,10 μmol/L PIO 及100 μmol/L PIO 干预使VCAM-1水平分别下调了21%和32%(图3)。
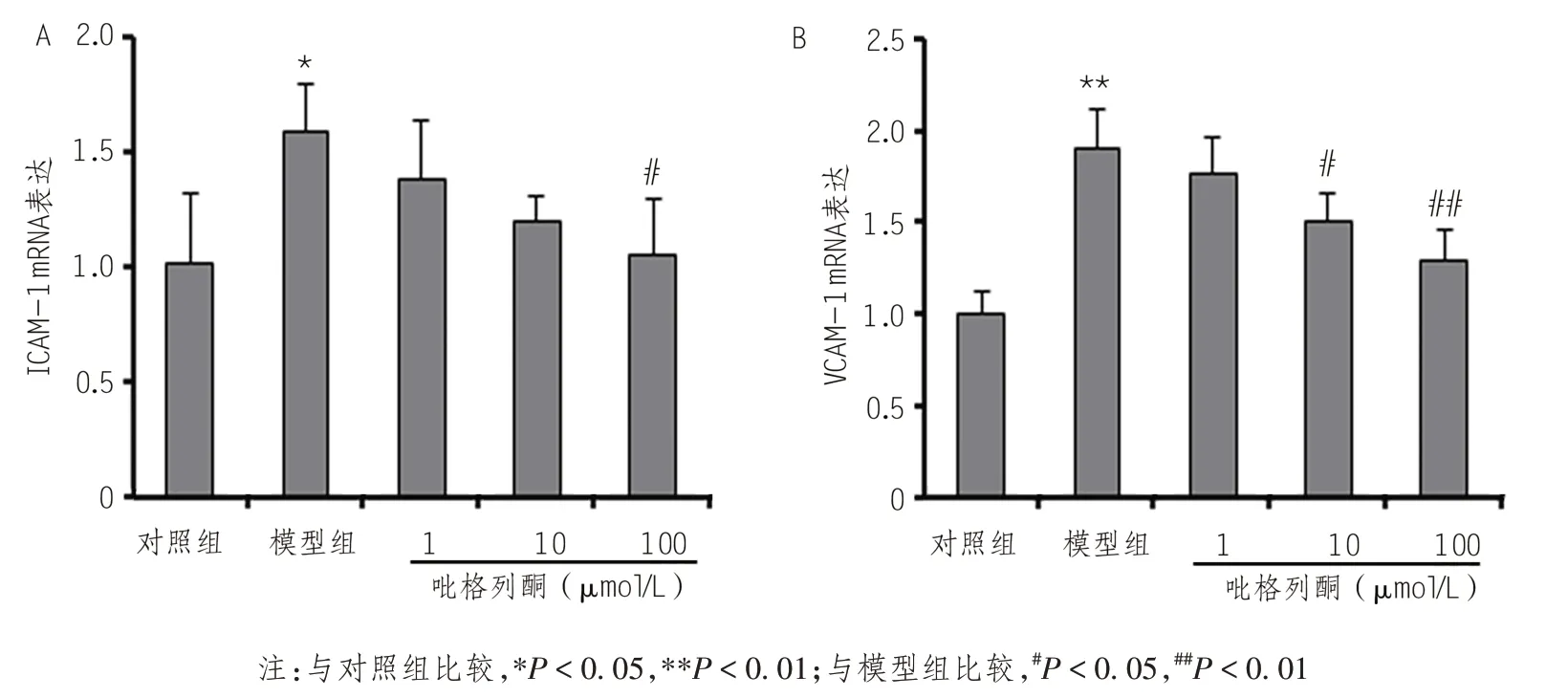
图3 PIO对内皮细胞中ICAM-1及VCAM-1 mRNA表达的影响
3 讨 论
DM是一种多病因引起的以慢性高血糖为特征的代谢紊乱性疾病。血糖持续升高,进而导致血中糖化脂蛋白、糖化白蛋白、糖基化终末产物等有害物质明显增多,损害大血管及微血管壁,严重时可危及心、脑、肾、外周神经、眼睛、足等多器官[7]。DM血管病变是DM 最常见的并发症,其致死率占DM死亡者一半以上,而血管病变的病理基础是糖基化修饰产物诱发的动脉粥样硬化(atherosclerosis,AS)[8-9]。在临床工作中,DM 患者不仅应降低血糖,改善血管功能异常、预防AS 性心脑血管疾病同样具有重要意义。
正常情况下,血管内皮细胞作为一种半透膜屏障,可以选择性地允许某些分子通过血管壁,调节血管舒缩功能,减少血小板聚集和血栓形成,抑制白细胞的粘附和游出,维持血管稳态[12]。然而,内皮细胞的数量减少或结构改变可导致其屏障功能降低,完整性破坏,引起血液中脂质及单核细胞易于沉积到动脉内皮下,并进一步转化为泡沫细胞和AS斑块。LDH稳定表达于细胞的胞质中,正常情况下不能透过细胞膜,但是细胞受损时,LDH 即被释放到胞外。故而培养液中LDH 高低可以反映细胞的损伤程度。本研究发现PIO 干预不仅升高了glc-LDL 损伤的内皮细胞存活率,还降低了培养液中LDH活性,减轻了LDH漏出和细胞膜损伤。
现已公认,氧化应激和炎症反应是DM 血管病变发病机制的重要环节[10-11]。DM时,糖基化修饰产物可刺激血管内皮细胞生成氧自由基,通过多种途径损伤血管内皮细胞。例如,膜脂质过氧化可导致细胞的转运能力降低,造成细胞Ca2+分布异常[13];氧自由基可造成细胞内蛋白、核酸变性,改变细胞形态结构,甚至导致细胞坏死和凋亡。与此相反,细胞内SOD可以还原超氧阴离子,是细胞内氧自由基清除剂。本实验结果显示PIO降低了内皮细胞中ROS和MDA 水平,并增强了细胞内SOD 活性,对受损细胞的氧化应激反应有拮抗作用。血浆中有害物质,例如glc-LDL、ox-LDL、氧自由基等可刺激内皮细胞和巨噬细胞表达粘附分子和炎症介质,介导局部粘附和白细胞迁移,促进血管壁粥样斑块和血栓形成[14-15]。本研究也证明PIO干预下调了glc-LDL诱导的内皮细胞粘附分子ICAM-1、VCAM-1 mRNA表达。
综上所述,PIO可通过提高细胞存活率,降低细胞膜通透性,减轻氧化应激和炎症反应,从而发挥保护血管内皮作用,这些研究结果将为PIO 预防DM血管病变提供新依据。
利益冲突所有作者均声明不存在利益冲突

