三氧化二砷通过早幼粒细胞白血病基因抑制三阴性乳腺癌细胞增殖、侵袭迁移的研究
张伟杰,张钟月,娄世同,李冬荟,王留兴
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
三阴性乳腺癌多呈浸润性生长,恶性程度偏高,易复发和多器官转移,预后较其他分子分型差,目前国内外对三阴性乳腺癌的治疗手段缺乏突破性研究进展[1-2]。本课题组前期研究发现早幼粒细胞白血病基因(promyelocytic leukemia protein,PML)在乳腺癌组织中的表达明显高于癌旁组织及正常乳腺组织,并且与分化程度和分期有关,PML在分化程度低、分期晚的组织中呈高表达,其中三阴性乳腺癌组织PML阳性表达率最高[3]。这些结果都提示PML参与了三阴性乳腺癌的发生、发展。
三氧化二砷(arsenic trioxide,As2O3)是中国传统中药,20世纪70年代,我国学者将As2O3应用于治疗急性早幼粒细胞性白血病取得显著疗效[4]。Chen等[5]报道As2O3治疗急性早幼粒细胞白血病的疗效是通过PML分子靶向白血病干细胞而实现的。PML分子有潜在抗肿瘤能力,PML可以将肿瘤抑制蛋白组构成一个网络来抑制肿瘤细胞的表达,或抑制肿瘤细胞增殖所需的其他蛋白质的数量,这些蛋白质在体内是最基本的分子,发挥着控制细胞诞生、生长、死亡的作用[6-7]。最近有研究[8]证实,人肝癌细胞HuH7表达PML蛋白,发现As2O3可以刺激HuH7细胞及CD13+CD133+LCSCs的增殖,病诱导细胞凋亡,其机制可能与PML蛋白表达有关。已有研究[9]证实,As2O3不仅对急性早幼粒细胞性白血病有作用,对多数实体瘤也有效,如乳腺癌、胃癌、肺癌等。三氧化二砷是否靶向PML基因参与乳腺癌的发生、发展值得研究。
本研究旨在研究As2O3对三阴性乳腺癌细胞增殖的影响及其与PML表达的相关关系的进一步研究,为As2O3的Ⅲ期临床试验提供更多的理论依据,该研究更深远的意义还在于开创了针对引起三阴性乳腺癌起始细胞的靶向药物研究。
1 材料与方法
1.1 实验细胞人三阴性乳腺癌MDA-MB-231细胞系购自中国医学科学院肿瘤医院,保存于郑州大学第一附属医院肿瘤中心实验室。
1.2 主要试剂胎牛血清、胰蛋白酶和DMEM培养基购自美国Gibco公司;BCA蛋白定量试剂盒和SYBR Green 实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自美国Thermo Fisher公司;TRIzol、逆转录试剂盒购自美国Invitrogen公司;PML引物和β-actin引物购自上海生工公司;PML抗体和β-actin抗体购自美国Abcam公司;辣根过氧化物酶标记羊抗鼠IgG购自武汉博士德公司;碘化丙啶试剂购自美国Sigma公司等。
1.3 方法
1.3.1 细胞培养 MDA-MB-231细胞用DMEM细胞培养基(含有体积分数10%胎牛血清、100 u/mL青霉素和100 μg/mL链霉素)置于37 ℃、体积分数5% CO2细胞培养箱中培养。
1.3.2 慢病毒介导的RNAi抑制PML在MDA-MB-231细胞中的表达 针对目的基因PML的序列,根据核糖核酸干扰(ribonucleic acid interference,RNAi)序列设计原则,设计3个PML敲低(PML knockdown,PML-KD)靶点序列,选择最佳的动力学参数靶点进入后续实验流程。与工具载体pGV115进行酶切,PCR扩增目的基因PML,构建病毒载体框架,合成单链引物,退火形成双链DNA,通过T4 DNA ligase将双酶切线性化的载体和退火双链DNA连接,16 ℃连接1~3 h,或连接过夜构建重组载体。将携带目的基因PML靶点序列的pGV115、病毒包装辅助质粒pHelper 1.0和病毒包装辅助质粒pHelper 2.0共转染293T细胞,在转染完成后的48~72 h进行病毒收获,采用相应的浓缩纯化得到高滴度的慢病毒保存液,测定慢病毒的滴度。将PML RNAi慢病毒感染MDA-MB-231细胞,用嘌呤霉素筛选阳性感染细胞。在MDA-MB-231细胞中进行PML RNAi慢病毒有效靶点的内源性验证,每组细胞设置3个重复,实验重复2次。
1.3.3 实时荧光定量PCR检测PML基因的表达 用TRIzol提取MDA-MB-231细胞的总RNA,反转录试剂盒合成cDNA,用于实时荧光定量PCR实验检测PML基因的表达。PML引物:正向-ACATCTTCTGCTCCAACCCC;反向-GCCAAAGGCACTATCCTGCT。β-actin引物:正向- GCGTGACATTAAGGAGAAGC;反向- CCACGTCACACTTCATGATGG。反应体系为:cDNA 0.2 μL,上下游引物各0.5 μL,SYBR缓冲溶液29.25 μL,Real Master Mix 35.7 μL,双蒸水 33.85 μL。反应条件为:94 ℃ 10 min,30个循环:94 ℃ 15 s,60 ℃ 32 s。采用2-ΔΔCt法计算PML基因的mRNA相对表达量。
1.3.4 Western blot检测蛋白的表达 培养MDA-MB-231细胞至对数生长期,磷酸盐缓冲液洗涤2次。取适当量的RIPA裂解液,使用前数分钟内加入苯甲基磺酰氟,使苯甲基磺酰氟的最终浓度为1 mmol/L。用RIPA裂解液裂解细胞提取细胞总蛋白,4 ℃、12 000 g,离心15 min,用BCA法测定蛋白浓度。加入1/5体积的上样缓冲液混匀,100 ℃ 10 min,短暂离心后-80 ℃保存备用。配制十二烷基硫酸钠-聚丙烯酰胺凝胶,上样进行电泳,调节电泳仪参数为:浓缩胶 80 mA,20 min;分离胶120 mA,1 h。电泳结束后,4 ℃、300 mA恒流条件下进行电转150 min, 将蛋白转移到聚偏氟乙烯膜上。用封闭液(含体积分数5%脱脂牛奶的TBST溶液)4 ℃过夜封闭聚偏氟乙烯膜,然后将聚偏氟乙烯膜与一抗进行4 ℃过夜孵育,用TBST洗膜3次,每次5 min;与二抗室温下孵育2 h,并用TBST洗膜3次,每次5 min。用ECL发光液进行显影,用Image J软件对Western blot条件进行灰度分析,分析目标条带和内参条带的净光密度值以及透明的比值。
1.3.5 CCK-8实验检测细胞增殖能力 将处于对数生长期的MDA-MB-231细胞胰酶消化后,用完全培养基重悬成细胞悬液,并计数。将细胞接种于96孔板中(2 000个/孔),每组设3个重复孔,过夜培养至融合度达80%~90%。每孔加入10 μL CCK-8溶液,放入培养箱中继续培养,4 h后用酶标仪检测450 nm处的吸光度值。按照以下公式计算PML沉默后对食管鳞癌细胞增殖的影响,细胞抑制率=(对照孔平均光密度值-实验孔平均光密度值/对照孔平均光密度值)×100%。
1.3.6 克隆形成实验检测细胞增殖能力 将处于对数生长期的MDA-MB-231细胞胰酶消化,用完全培养基重悬制成细胞悬液计数。将细胞接种于6孔板培养板中(800个/孔),每个实验组设3个复孔。将接种好的细胞于培养箱中继续培养到14 d或绝大多数单个克隆中细胞数大于50为止,中途每隔3 d进行换液并观察细胞状态。用荧光显微镜下对细胞克隆进行拍照,磷酸盐缓冲液洗涤细胞1次。每孔加入1 mL质量分数4%多聚甲醛,固定细胞30 min,磷酸盐缓冲液洗涤细胞1次。每孔加入结晶紫染液1 mL染细胞10 min。双氧水洗涤细胞数次,荧光显微镜观察并对克隆进行计数。
1.3.7 Transwell侵袭小室实验检测细胞侵袭迁移能力 MDA-MB-231细胞培养至对数生长期,将Transwell侵袭小室置于新的24孔板中,上、下小室各加500 μL无血清培养基,37 ℃培养箱中放置2 h使Matrigel基质层再水化。制备无血清细胞悬浮液并计数,接种细胞于24孔板(105个/孔),小心除去上室中培养基并加入200 μL细胞悬液,下室内加入750 μL体积分数30%胎牛血清培养基。37 ℃培养箱培养24 h后,用棉拭子轻轻移去小室内非侵袭细胞,迁移的细胞用多聚甲醛固定并用质量分数0.1%结晶紫染色。每个小室随机选取视野拍照,计算各组侵袭转移细胞数。
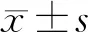
2 结果
2.1 抑制PML基因的表达对MDA-MB-231细胞增殖、侵袭迁移的影响用慢病毒介导的PML RNAi观察抑制抑制PML基因的表达对MDA-MB-231细胞增殖、侵袭迁移的影响。相对于阴性病毒干扰(negative Control,NC)组,PML-RNAi慢病毒都能降低PML在MDA-MB-231细胞中的mRNA表达水平(F=19.203,P=0.001),其中PML-KD2在MDA-MB-231细胞中对PML基因的敲减效果最高,达到83.9%,故选取PML-KD2进行后续试验研究。CCK8检测结果表明,与NC组相比,PML-KD组细胞生长速度减慢,倍增时间延长。PML-KD组对细胞的生长具有抑制作用,其细胞的增殖明显低于NC组(t=37.757,P<0.001),说明沉默PML的表达可以降低MDA-MB-231细胞的增殖。与NC组比较,抑制PML的表达MDA-MB-231细胞的克隆数量减少(t=25.080,P<0.001),说明PML可以促进MDA-MB-231细胞的增殖。Transwell小室实验结果显示,与NC组比较,PML-KD组迁移到下室的MDA-MB-231细胞数减少(t=176.000,P<0.001),表明PML沉默抑制了MDA-MB-231细胞侵袭和转移的能力。见图1~4。

图1 MDA-MB-231细胞中PML RNAi慢病毒有效靶点的筛选
A:PMLRNAi慢病毒感染293T细胞;B:PML-RNAi慢病毒感染MDA-MB-231细胞;C:PML在MDA-MB-231细胞中mRNA的表达丰度柱状图
2.2 As2O3联合PML-KD对MDA-MB-231细胞增殖的影响鉴于慢病毒介导的PML基因干扰可以抑制MDA-MB-231细胞的增殖,As2O3和PML基因干扰之间是否存在协同效果尚不清楚,因此本研究将As2O3联合PML短发夹RNA处理MDA-MB-231细胞,观察细胞增殖的变化。本研究用As2O3(75 μmol/L)分别处理NC和PML-KD慢病毒感染的MDA-MB-231细胞(NC+As2O3组和PML-KD+As2O3组)。CCK-8结果显示,各处理组MDA-MB-231细胞增殖比较差异有统计学意义(F=3571.851,P<0.001),PML-KD+As2O3联合处理组的细胞生长最慢,与NC+As2O3组、PML-KD组比较差异均有统计学意义(P均<0.05),说明联合处理组对细胞生长的抑制作用最高。见图5。

图2 抑制PML的表达对MDA-MB-231细胞增殖的影响

图3 抑制PML的表达对MDA-MB-231细胞克隆形成的影响

图4 Transwell小室实验检测抑制
A:抑制PML的表达MDA-MB-231细胞的Transwell小室迁移到下室的细胞;B、C:Transwell小室迁移到下室的细胞柱状图

图5 As2O3联合PML-KD对MDA-MB-231细胞增殖的影响
2.3 As2O3联合PML-KD对MDA-MB-231细胞克隆形成的影响克隆形成实验结果显示,各处理组MDA-MB-231细胞增殖比较差异有统计学意义(F=744.177,P<0.001)。PML-KD+ As2O3组MDA-MB-231细胞的克隆形成数量最低,与NC+As2O3组、PML-KD组比较差异均有统计学意义(P均<0.05),说明As2O3和PML-KD处理对MDA-MB-231细胞克隆形成能力具有协同效果。见图6。

图6 As2O3联合PML-KD对
A:克隆形成实验结果;B:克隆形成实验绿色荧光图;C:克隆形成实验的柱状图
2.4 As2O3联合PML-KD对MDA-MB-231细胞侵袭迁移的影响Transwell小室结果显示,各处理组MDA-MB-231细胞迁移比较差异有统计学意义(F=6 363.307,P<0.001)。PML-KD+ As2O3组迁移至下室的MDA-MB-231细胞数最少,与NC+As2O3组、PML-KD组比较差异均有统计学意义(P均<0.05),说明As2O3联合PML-KD对MDA-MB-231细胞侵袭迁移能力的抑制具有协同作用。见图7。

图7 As2O3联合PML-KD对
3 讨论
有研究[10]显示,PML分子有潜在抗癌能力,PML可以将肿瘤抑制蛋白组构成一个网络来抑制肿瘤细胞的表达,或抑制肿瘤细胞增殖所需的其他蛋白质的数量,这些蛋白质在体内是最基本的分子,发挥着控制细胞诞生、生长、死亡的作用。本研究通过慢病毒介导的RNAi抑制PML在MDA-MB-231细胞中的表达,可以降低细胞的增殖和侵袭迁移能力。
已有研究[11-15]证实As2O3不仅对急性早幼粒细胞性白血病有作用,对多数实体瘤也有效,如乳腺癌、胃癌、肺癌等。鉴于慢病毒介导的PML基因干扰可以抑制MDA-MB-231细胞的增殖,As2O3和PML基因干扰之间是否存在协同效果尚不清楚,因此本研究将As2O3联合PML-KD处理MDA-MB-231细胞,观察细胞增殖和侵袭迁移的变化。As2O3联合PML-KD处理组对MDA-MB-231细胞的增值能力和克隆形成能力最低,可以抑制细胞的侵袭迁移能力,说明联合处理对细胞生长的抑制作用最高。
我们的研究结果证实,抑制PML在MDA-MB-231细胞中的表达可以降低细胞的增殖和侵袭迁移能力,As2O3可以增强PML对细胞增殖和侵袭迁移能力的抑制作用,可能成为三阴性乳腺癌新的治疗的靶点。

