塑料食品包装材料的环境污染综述
蓝敏怡,李会茹,*,胡立新,杨愿愿,应光国,#
1. 华南师范大学环境研究院,广东省化学品污染与环境安全重点实验室,环境理论化学教育部重点实验室,广州 510006 2. 华南师范大学环境学院,广州 510006
食品包装是指对加工好的食品进行包装,使其免受外界的污染和破坏,以便食品在运输和储藏中保持其营养价值和原有状态,同时为消费者提供配料成分和营养成分信息[1]。但因其中的化学成分可通过接触迁移至食品中并造成潜在风险,所以食品包装材料的安全性是衡量食品安全的一个重要指标[2],国内外均对其中特定化学物质的迁移量进行了严格的规定。
目前常用的食品包装材料有塑料、纸、金属、玻璃、复合材料、陶瓷、麻袋、布袋和竹等。其中,塑料因为具有:(1)原材料来源丰富,价廉易得,利润空间大;(2)可塑性强,加工方式简单且多样化(如吹塑、挤塑、注塑、模压、复合等),可满足不同食品包装需求;(3)力学性能良好,具有一定的强度和弹性,不易受损,且质量轻,方便携带;(4)保气性、隔防渗性、热封性等物理性能好;(5)化学稳定性好,抗酸碱等腐蚀能力强;(6)包装外形轻巧、美观,深受消费者欢迎等优点,在食品包装中应用最为广泛。我国现有食品包装中塑料包装超过50%[3],且近年来随着人民生活节奏的加快以及O2O(online to office)新型消费模式的发展,外卖餐饮行业一直保持着高速发展的态势,一次性塑料餐饮盒的使用量也急剧上升。
虽然这些塑料/树脂本身无毒,但其中的添加剂却具有不同程度的毒性,且因为缺少化学键束缚,极易向与其接触的食品中迁移,并通过饮食进入人体并逐渐累积,进而产生各种毒性效应损害健康;一些化合物还被发现具有致癌、致畸和致突变作用。鉴于此,欧盟食品和饲料类快速预警系统(rapid alert system for food and feed, RASFF)将塑料食品包装材料作为关注重点,2019年共发布食品包装材料通报172例,其中,125例来自我国且有51例为塑料制品[4]。此外,近年来在我国,甘肃“毒奶粉”事件[5]、台湾“塑化剂风波”[6]、外卖餐盒-医疗垃圾黑色产业链等一系列食品包装安全问题的曝光,也使得塑料食品包装材料的安全性和潜在健康风险引起了人们的高度关注。
此外,这些塑料被废弃后还会通过各种方式变成塑料碎片继续污染环境,尤其是近年来广受关注的微塑料(microplastics, MPs),粒径小(<5 mm),化学性质稳定,难降解,可在环境中存在数百至数千年[7]。MPs易富集在近海沉积物、土壤等介质中,也可悬浮水中并被浮游生物、鱼类、鸟类和海洋哺乳动物等摄食,通过食物链传递富集,威胁生态系统和人类健康,已成为近年来环境领域的研究重点和热点。本文通过检索相关文献,概述了常用塑料食品包装材料的种类、用途及其中的有害化学品,并重点综述了这些塑料自身及其中化学品的环境污染过程和生态健康效应,为此类塑料今后的污染控制和研究方向提供参考。
1 塑料食品包装材料简介(Introduction of plastic food packaging materials)
塑料食品包装材料以合成树脂(高分子聚合物)为基础,在一定温度和压力下加入适量的稳定剂、塑化剂、抗氧剂、荧光增白剂和印刷油墨等来改进性能。常用的塑料食品包装材料有聚乙烯(polyethylene, PE)、聚丙烯(polypropylene, PP)、聚苯乙烯(polystyrene, PS)、聚氯乙烯(polyvinyl chloride, PVC)、聚对苯二甲酸乙二醇酯(polyethylene glycol terephthalate, PET)、聚偏二氯乙烯(polyvinylidene chloride, PVDF)、聚碳酸酯(polycarbonate, PC)、聚酰胺(polyamides, PA)和聚乙烯醇(polyvinyl alcohol, PVA)等[8-9]。其中,PE、PP和PET热稳定性好,无毒无味,透明度高,被广泛用作饭盒、矿泉水瓶、饮料/果汁瓶等;其他材料因为自身理化特性、成型工艺和添加助剂等的不同,在性能和用途上也表现出较大差异(表1)。
根据历史使用情况,我国使用的外卖餐盒经历了3个阶段,分别是发泡塑料、PP塑料和可降解餐盒。目前我国建议外卖餐盒使用可降解材料如淋膜纸碗等,但因为缺乏强制性的法律法规,目前的外卖餐盒仍以塑料餐盒为主,可降解材料的用量相对有限,由此产生的潜在污染和人体健康风险值得关注。
2 塑料食品包装材料中的化学品(Chemicals in plastic food packaging materials)
塑料食品包装材料中所含的化学品主要来自3个方面:(1)塑料添加剂及材料单体;(2)包装印刷过程中的油墨及溶剂残留物;(3)包装复合过程中使用的胶粘剂及其稀释剂。
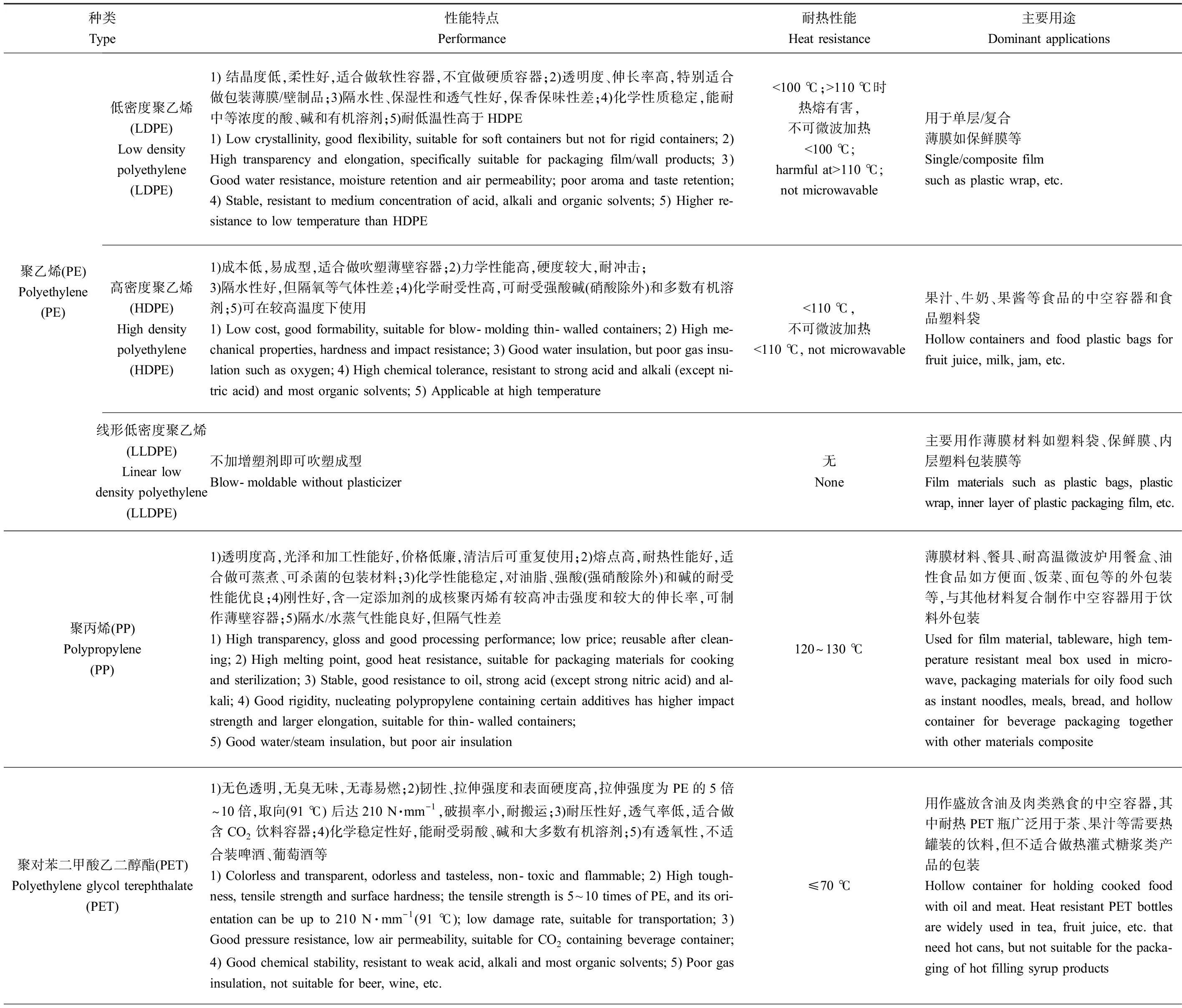
表1 常用塑料食品包装材料的种类、性能和主要用途Table 1 Type, performance, heat resistance and dominant applications of commonly used plastic food packaging materials
2.1 合成树脂单体
常见的合成树脂单体包括:PVC单体氯乙烯(vinyl chloride, VCM)、PS单体苯乙烯、乙烯、丙烯、丙烯腈-丁二烯-苯乙烯塑料(acrylonitrile butadiene styrene plastic, ABS)的单体丙烯腈(acrylonitrile, AN)、三聚氰胺甲醛树脂(melamine formaldehyde resin, MF)等。
2.2 塑料助剂
用于食品包装的塑料大部分为热塑性树脂,其加工流动性比较差。为了改善其品质和性能,厂家常会在其生产加工过程中添加大量助剂,如增塑剂、抗氧化剂、稳定剂、着色剂、润滑剂和抗静电剂等。
2.2.1 增塑剂
增塑剂也叫塑化剂,用于增强塑料制品的可塑性和柔软性,是产量和消费量最大的塑料添加剂之一。常用的增塑剂有邻苯二甲酸酯类(phthalates, PAEs)、双酚类(bisphenolics, BPs)、氯化石蜡(chlorinated paraffin, CPs)、聚酯类、柠檬酸酯类、环氧酯类、脂肪酸酯类、磷酸酯类和偏苯三酸酯类等。
PAEs又称酞酸酯类,在增加塑料可塑性和柔韧性方面性能优越,是目前使用量最大的增塑剂,市场份额约为80%,全球年产量已超过200万t,在塑料中的质量比例高达20%~30%[10]。多数PAEs为无色透明、难溶于水但易溶于有机溶剂的油状液体,属于弱极性有机物,有微弱特殊气味,难挥发,熔点较低,沸点高。最常用的PAEs增塑剂有邻苯二甲酸二(2-乙基)己酯(bis(2-ethylhexyl) phthalate, DEHP)、邻苯二甲酸二丁酯(dibutyl phthalate, DBP)、邻苯二甲酸二乙酯(diethyl phthalate, DEP)、邻苯二甲酸二辛酯(di-n-octylphthalate, DNOP)、己二酸二(2-乙基己基)酯(diadipate (2-ethylhexyl) ester, DEHA)等,其中DEHP的产量占PAEs总量的51%。上述常见PAEs的结构信息和物化性质参数如表2所示。
BPs具有2个羟苯基结构,是生产环氧树脂和PC的重要化工原料,也是塑料生产中重要的添加剂,具有增塑、防老、改性和阻燃等功能。常温状态下BPs为白色晶体、粉末或者淡黄色油状粘稠液体,易溶于丙酮、甲醇和乙腈等有机溶剂,难挥发且脂溶性强。食品包装中最常用的BPs有双酚A(bisphenol A, BPA)、双酚B(bisphenol B, BPB)、双酚C(bisphenol C, BPC)、双酚F(bisphenol F, BPF)、双酚S(bisphenol S, BPS)、双酚AF(bisphenol AF, BPAF)、双酚二环氧甘油醚及其衍生物等。上述BPs的结构信息和理化性质参数如表3所示。其中BPA或双酚二环氧甘油醚可使塑料具有无色透明、耐用、轻巧、防冲击性突出等特性,被广泛用于奶瓶、塑料瓶、一次性饭盒、保鲜膜、水杯及容器等。近年来,BPS、BPF等因结构上与BPA具有相似性而被作为BPA的替代品,广泛用于禁止或限制BPA使用的食品包装材料及容器的生产中,如以合成聚砜醚塑料替代PC塑料奶瓶。BPAF是BPA的氟化衍生物,广泛用于耐高温PC复合材料中。双酚二环氧甘油醚则是在储存过程中包装材料与食品反应的生成物:当与酸性食物、水或盐酸接触时,双酚A二缩水甘油醚(bisphenol A diglycidyl ether, BADGE)会出现水解与氢氧化反应,获得相应的水解产物与氢氧化产物,继而渗入食品内,危害人体健康[11]。
CPs是正构烷烃经氯化(氯质量在30%~70%)衍生后的复杂混合物。常温下除氯化度为70%的CPs为白色固体,其余为无色或淡黄色液体,挥发性低、阻燃性高、电绝缘性高和价格低廉。按碳链长度可分为短链氯化石蜡(short chain chlorinated paraffins, SCCPs, C10-C13)、中链氯化石蜡(medium chain chlorinated paraffins, MCCPs, C14-C17)和长链氯化石蜡(long chain chlorinated paraffins, LCCPs, C18-C30)。其中SCCPs常作为增塑剂、润滑剂、阻燃剂、加工助剂(改良剂)被广泛应用于皮革制品、胶粘剂、橡胶制品、日用消费品与PVC食品包装材料[12]。
2.2.2 抗氧化剂
受氧、光、热等外界作用,塑料中的聚合物分子链会断裂生成自由基,若不能及时消灭则会引起塑料分子断裂,最终使塑料老化并失去使用价值,因此塑料加工时常需添加一些抗氧化剂来捕获自由基,从而抑制和阻缓塑料老化变质,延长产品的使用寿命。常用的抗氧剂有取代酚类、芳香族胺类、亚磷酸酯类和含硫酯类等。其中酚类抗氧剂具有毒性低、不易污染等优点,被大量应用于食品包装塑料中。常用的酚类抗氧化剂有2,6-二叔丁基对甲酚(2,6-butylated hydroxyl toluene, BHT)、叔丁基羟基茴香醚(butylated hydroxyl anisole, BHA)、叔丁基对苯二酚(tert-butyl hydroquinone, TBHQ)、3-(3,5-二叔丁基-4-羟基苯基)丙酸正十八烷醇酯(irganox 1076)、四[甲基-β-(3,5-二叔丁基-4-羟基苯基)丙酸酯]季戊四醇酯(irganox 1010)等[13],其中irganox 1010和irganox 1076的使用量最大,前者以相对分子量大、材料相容性好、抗氧化效果强等优点而成为塑料抗氧剂中最优秀的产品[14]。欧盟食品接触塑料材料和制品的最新法规(EU No.10/2011)[15]和中国的国家标准(GB/T 9685—2016)[16]均详细规定了塑料食品包装材料中酚类抗氧化剂被允许使用的种类、范围和特定迁移量(specific migration limit, SML)等(表4)。
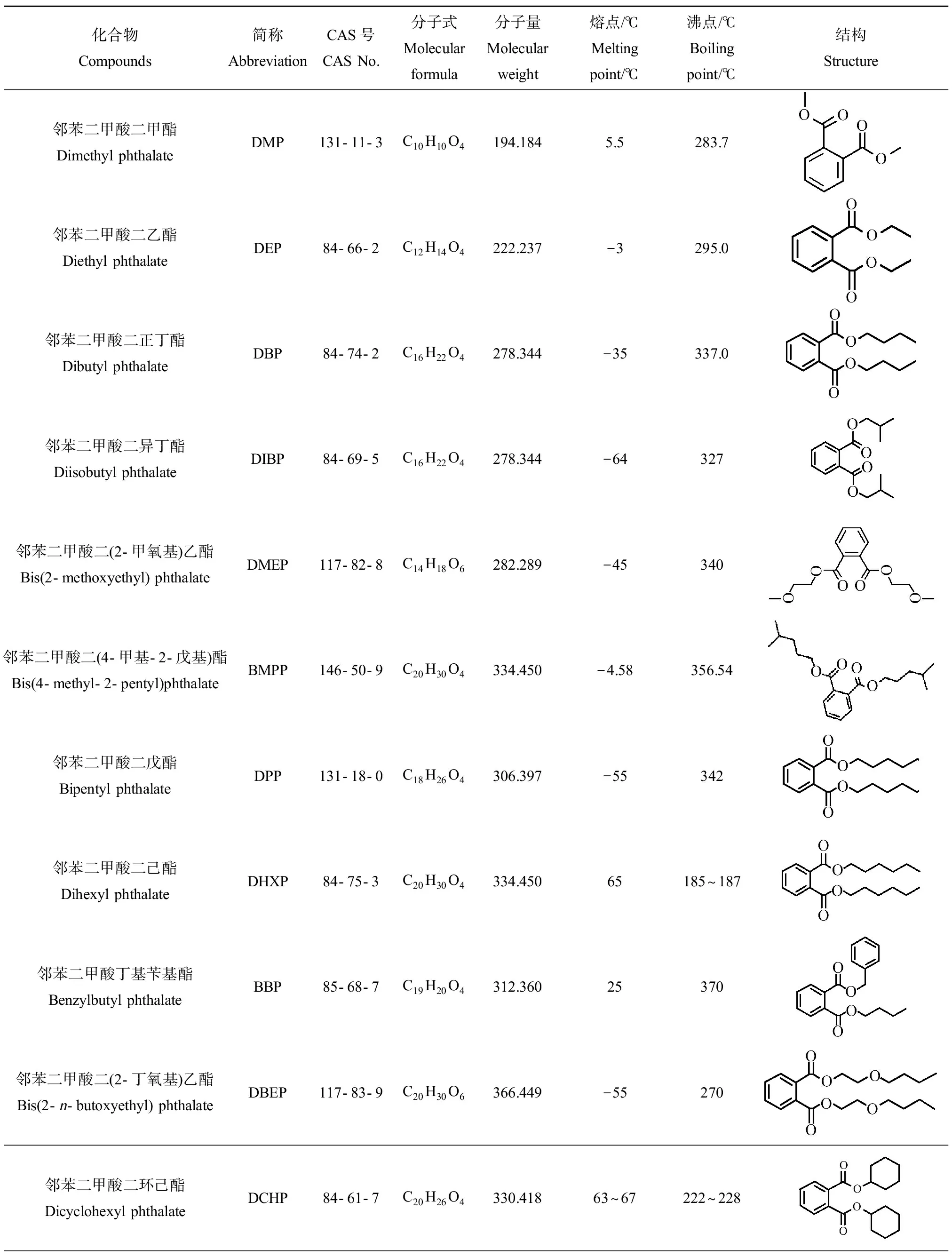
表2 常见邻苯二甲酸酯(PAEs)类化合物的结构信息和物理性质参数Table 2 Structural information and physical parameters of commonly used phthalates (PAEs)
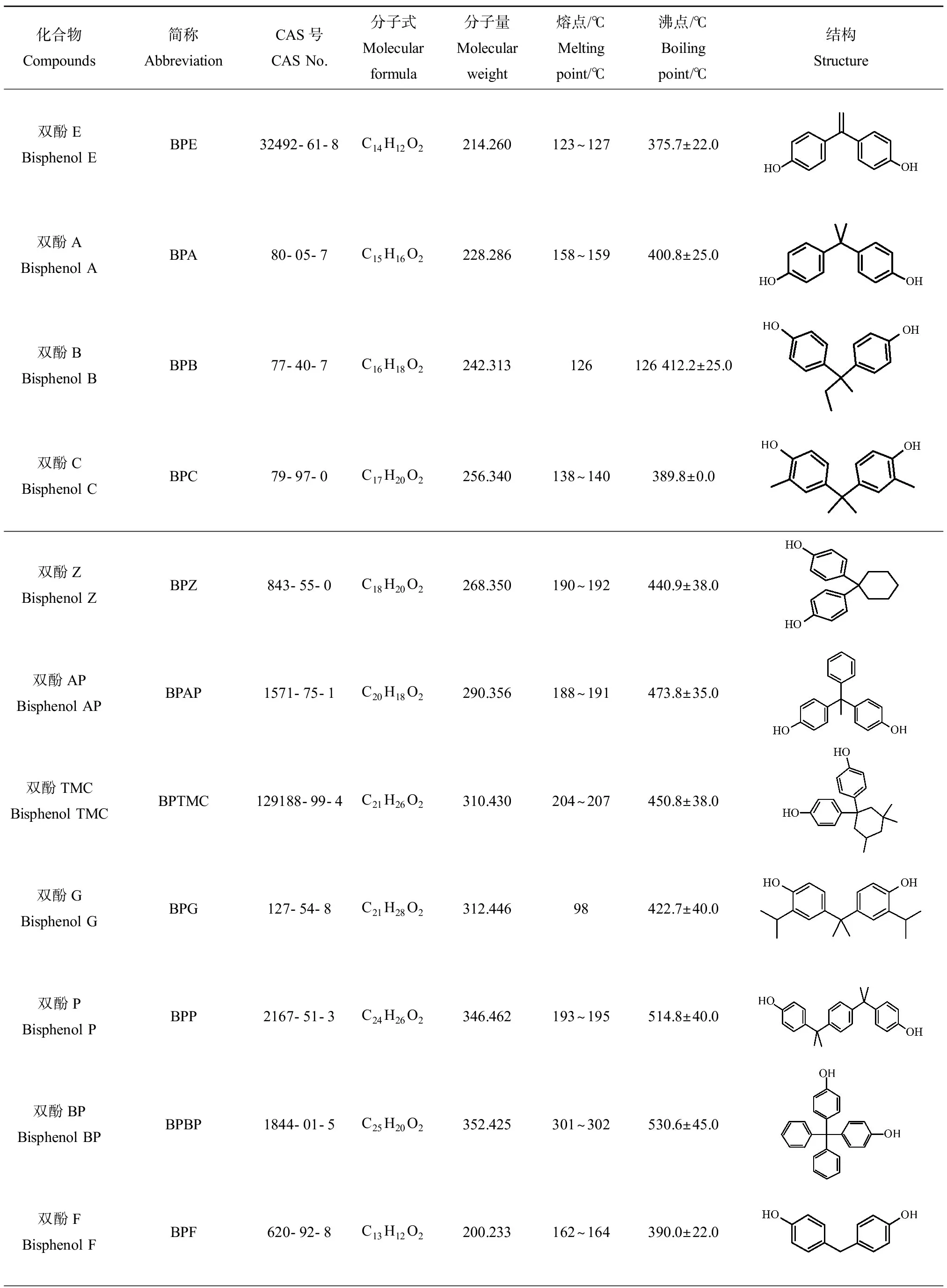
表3 常见双酚类(BPs)化合物的结构信息和物理性质参数Table 3 Structural information and physical parameters of commonly used bisphenolics (BPs)
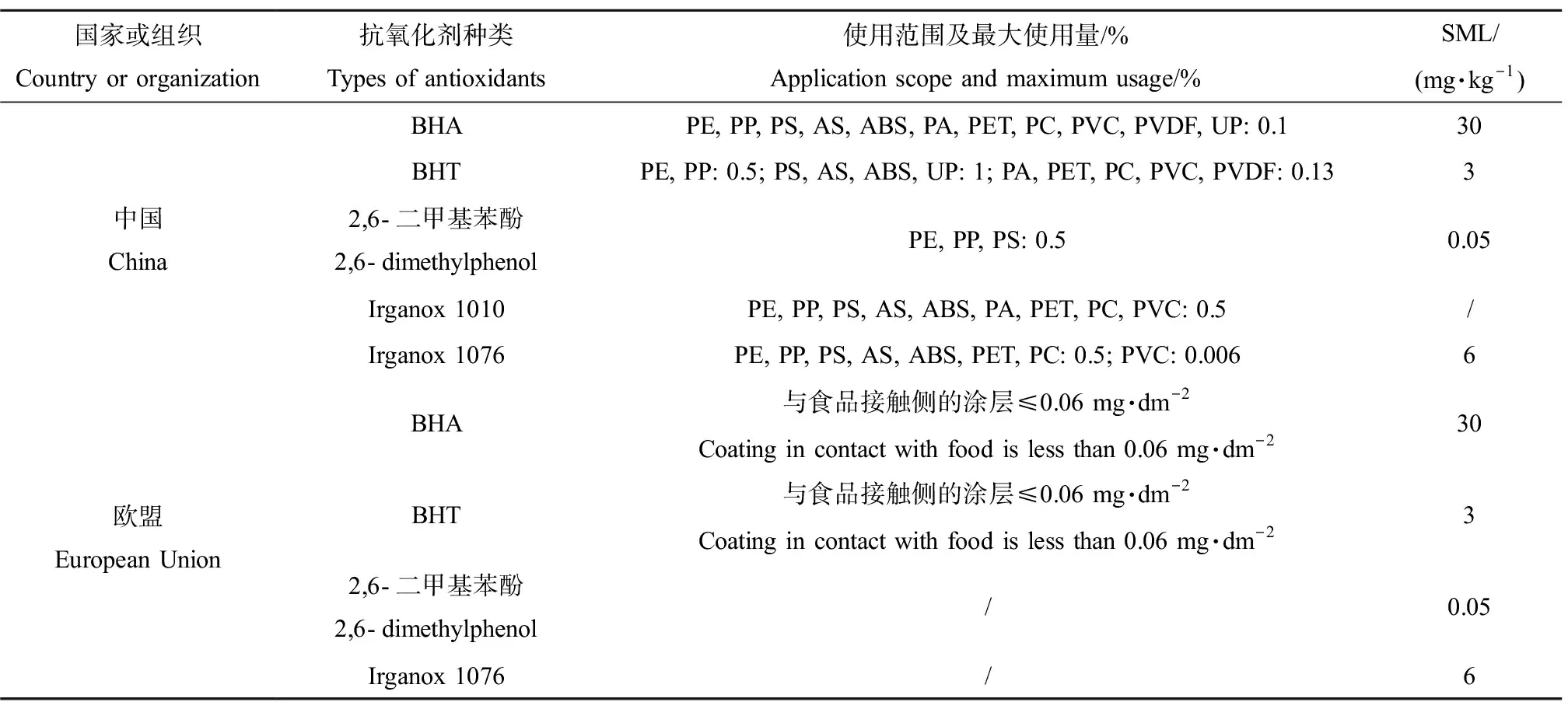
表4 中国和欧盟标准中常见的酚类抗氧化剂使用范围及特定迁移量(SML)Table 4 Use range and specific migration limit (SML) of commonly-used phenolic antioxidants in Chinese and European Union standards
2.2.3 稳定剂
塑料在生产过程中受高温易分解,在阳光和紫外线照射下易老化降解。因此,许多厂家在塑料加工过程中加入相应的稳定剂,来抑制或减缓其光/热老化速度,提高材料的耐光/热性,延长使用寿命[17-18]。从原料成分上分,目前常用的稳定剂包括铅盐、金属皂、有机锡、有机锑、有机稀土和纯有机化合物等。从功能上分,稳定剂包括热稳定剂(如铅盐、有机锡、金属皂类)、光稳定剂(如受阻胺光稳定剂和有机镍螯合物)和紫外线稳定剂(如邻羟基二苯甲酮类、苯并三唑类等)。当添加有金属稳定剂的塑料制品接触食品后,其中的金属易迁入食品中对人体造成危害,尤其是铅镉稳定剂。
2.2.4 荧光增白剂
荧光增白剂是一类荧光染料,也称为白色染料,能吸收350~400 nm波长的紫外光,然后再发射出肉眼可见的420~480 nm波长的蓝光或蓝紫色荧光,该荧光与基质上的黄光互补,使所染物质获得类似萤石闪闪发光的光学效应,从而显著提高白度和光泽[19-20]。目前全球在产的荧光增白剂有1 000余种,年总产量达15万t以上[21]。按化学结构可将荧光增白剂分为二苯乙烯型、香豆素型、吡唑啉型、苯并恶唑型和苯二甲酰亚胺型五大类。二苯乙烯型是目前工业生产中最常用的荧光增白剂,产量占全部荧光增白剂的80%以上[22],其中的三嗪氨基二苯乙烯类荧光增白剂使用量最大,市场占有率超过80%[21]。塑料制品中常用的几种荧光增白剂有荧光增白剂WS、荧光增白剂PF、荧光增白剂OB、荧光增白剂EBF、荧光增白剂EGM、荧光增白剂KCB、荧光增白剂SN和荧光增白剂OB-1等。
2.2.5 阻燃剂
作为石化产品的衍生物,多数塑料聚合物易燃。为满足消防安全要求,常在塑料制品中加入阻燃剂以增强塑料的阻燃性能,降低燃烧速度。不同类型阻燃剂的阻燃机理主要有:(1)通过改变火焰的燃烧链反应机理实现阻燃;(2)促进聚合物表面生成具有保护作用的焦炭层,从而使火焰和热源与未燃聚合物隔开;(3)在热源上添加水分,稀释可燃性气体,急冷和冷却燃烧反应[23]。
常用的阻燃剂可分为添加型和反应型两大类。前者以添加方式加入到树脂中,与树脂之间只是简单的物理混合,与材料间无化学键束缚,易释放进入环境;后者一般是分子中包含阻燃元素和反应性基团单体(如含磷多元醇、卤代酸酐和卤代双酚等),能够与材料发生化学反应,通过化学键键合到树脂分子链上成为其一部分,不易从材料中向外释放。按照化学组成的不同,阻燃剂又可分为有机型和无机型,其中无机阻燃剂包括氢氧化镁、氢氧化铝、硼酸锌、氧化锑和赤磷等;有机阻燃剂包括卤系阻燃剂、有机磷系阻燃剂等,其中的溴系阻燃剂如多溴联苯醚、溴酚等在相当长时间内是我国阻燃剂的主导产品,但自20世纪80年代以来,溴系阻燃剂自身的毒性及其所引发的二噁英类污染问题引起了人们的极大关注[24]。目前。多溴联苯醚、六溴环十二烷等溴系阻燃剂已被证实具有持久性有机污染物特征和生物毒性,被先后列入斯德哥尔摩公约并在全球范围内禁止使用。
2.2.6 其他助剂
塑料食品包装材料在加工过程中添加的助剂种类繁多,除了上述常见助剂外,还会根据食品包装的不同要求添加其他助剂。例如,为使包装材料颜色鲜艳美观而添加的着色剂;为防止聚烯烃粘连,并增强材料稳定性、坚固性和耐热性等性能而添加的填充剂(主要有白炭黑、陶土、碳酸钙、滑石粉、石棉、硫酸钙和天然硅等);为防止塑料包装材料开口,同时保持制品表面光滑而添加的硬脂酸钙及其他钙镁盐润滑剂等;为改善塑料包装材料的亲水者或疏水性,增加材料分散能力而加入的表面活性剂;为降低材料密度、减轻产品质量、降低产品成本而加入的发泡剂(以偶氮化合物、N-亚硝基化合物、酰肼类化合物为主)等[25]。这些加工助剂均可通过接触迁移至食品中,通过饮食摄入威胁人体健康。
2.3 印刷油墨及溶剂
食品包装印刷是造成包装食品二次污染的主要原因之一,特别是以苯、卤代烃等有害化学品为主要原料的油墨和溶剂的使用。油墨由粘合剂、溶剂、颜料和改性剂4部分组成。甲苯、丁酮、乙酸乙酯和异丙醇等混合有机溶剂常被添加至油墨中以调节其黏度和挥发速度,适应印刷、复合工艺等的要求。
2.4 复合包装材料胶粘剂和稀释剂
相比于合成树脂塑料,复合塑料较为复杂,是通过胶粘剂和稀释剂将各种塑料薄膜粘接成统一整体的一种功能性材料。胶粘剂的种类很多,目前使用较广泛的主要有两大类:一类是用马来酸酐改性的PP,或用丙烯酸或酯与乙烯共聚的共聚体;另一类是聚氨酯胶粘剂。我国在复合软包装材料中使用最多的是溶剂型双组分聚氨酯胶粘剂,其中绝大部分是用芳香族异氰酸酯单体合成的,该物质水解后生成的二氨基甲苯以及高温时裂解生成的低分子量物质均被证实是致癌物[26]。欧盟法规(EU No.10/2011)[15]、我国的国家标准(GB/T 9683—1988[27]和GB/T 9685—2016[16])均严格控制食品包装材料中二氨基甲苯的含量。
3 食品包装塑料的环境污染过程(Environmental pollution process of food packaging plastics)
3.1 塑料/微塑料的环境污染过程
据统计,全球每年生产的3亿t塑料中,有2.6亿t被丢弃,但其中只有16%被机械回收,3%被填埋,25%被焚烧,近20%则被丢弃进入环境,随地表径流迁移并在河口、海湾等近岸海域漂浮、沉积或聚集造成污染[28];这其中约10%最终进入海洋,占所有海洋废弃物的60%~80%[29]。这些极难降解的塑料垃圾可在风化、海水侵蚀、生物分解等物理、化学和生物作用下形成塑料碎片,长期存在于环境中,并在风力、潮汐和洋流等外力作用下进行远距离迁移扩散。据推算,全球每年经河流传输作用进入海洋的塑料总量可高达200万t以上,这些塑料废弃物中包含大量的微塑料[30]。Mai等[31]估算每年通过珠江流域水体进入南中国海的微塑料质量在2 400~3 800 t之间。
3.1.1 塑料/微塑料的来源
包括食品包装塑料在内的塑料制品在废弃后进入环境,其中的大块塑料可在太阳辐射下发生氧化降解,从而脆化成塑料碎片,并进一步在风沙吹扫、海浪侵蚀、水体扰动等机械磨损作用下分解成粒径更小的微塑料,如粒径<5 mm的MPs。
陆地环境中的MPs主要来源于生活垃圾、农用塑料薄膜、污泥农田施用、含MPs的污水灌溉、添加有MPs的个人护理品(牙膏、洗面奶、化妆品和洗涤剂)的使用、工业生产过程释放(塑料制品的生产、空气爆破)、纤维纺织物洗涤过程中MPs的脱落、大气沉降等过程[32-33]。经模型估算,目前陆地环境中的MPs总量超过40万t,远高于淡水和海洋环境中MPs的总和[34]。污水处理系统产生的污泥中保留了污水中约90%的MPs[35],这些污泥被用作肥料或修复材料在农田中施用将导致土壤中MPs的大量增加。受污泥农用影响,北美地区土壤中的年MPs输入量为6.3~43万t,欧洲的为4.4~30万t,远远高于全球海洋MPs的年输入量(9.3~23.6万t)[34]。MPs可以长期保留在土壤中,对土壤产生持久性影响[36]。此外,由垃圾填埋或其他表面沉积物产生的微粒和微纤维,则可通过大气沉降作用进入陆地环境[37]。
水环境中MPs的来源主要包括陆源塑料垃圾、水产养殖、滨海旅游业、船舶运输、含MPs污水等的排放输入以及大气沉降等。由于MPs广泛应用于个人护理产品[38]和人造合成纤维纺织物[39]中,可随生活污水进入污水处理系统中,最终通过出水直排,或污泥农用后经地表径流或雨水冲刷等方式进入水环境中[40]。此外,含MPs的地表径流和地下径流的引入[41],大气干湿沉降、沙尘暴和台风等极端恶劣天气的引入[42],已引入的大块塑料的老化降解等均可加剧水环境中的MPs污染。另外,海上作业、船舶运输业和沿海旅游业导致大量的塑料产品和废弃物进入海滩或海洋中,据统计,2010年全球由沿海城市向海洋输入的塑料垃圾为4.8×106~12.7×106t[43],而MPs碎片总计约有35 000 t,海洋生态系统经济损失每年高达130亿美元[44]。在海洋环境的高盐度、光热及微生物作用下,塑料垃圾极易降解成细小的塑料碎片,成为海洋MPs污染的重要来源。随着研究不断深入,人们发现MPs可被海洋中的生物摄食,经生物体消化后被包裹在粪便中,其他生物可通过食用粪球间接摄取MPs,从而使其进入海洋生态系统[45]。
对于大气中的MPs,工业粉尘排放、人造合成纤维纺织物和合成橡胶轮胎的腐蚀颗粒被认为是其重要来源,其他来源还包括日常丢弃的塑料碎片、建筑材料、垃圾焚烧和填埋场及交通释放的废气颗粒、园艺土壤中使用的合成颗粒(如PS泥炭)、用作肥料的污水污泥的颗粒再悬浮等[46]。Dris等[46]发现法国巴黎市区大气降尘中MPs明显高于郊区,且29%的微纤维是人造合成纤维或天然和合成材料的混合物,估算大气沉降物的纤维在巴黎城市群(2 500 km2)中的年沉积量为3~10 t,。Liu等[47]估算中国上海市空气中的悬浮MPs年含量约为120.7 kg,合成化合物占MPs颗粒的54%。
3.1.2 塑料/微塑料在环境中的迁移分布
MPs能够在不同环境介质中进行迁移。风和地表径流可将MPs从陆地转移至水体,大气中的MPs还可通过干湿沉降进入水体和陆地。据模型推测,微塑料在大气中的传输距离可达95 km[48],但关于MPs迁移至大气的规律和污染特征目前尚不清楚。在重力和生物活动的作用下,部分MPs会从陆地迁移至深层土壤中;同时,这些MPs也可能通过地下径流、地表径流或水土流失迁移至淡水中。淡水环境被视为是陆地和海洋MPs迁移的桥梁,陆地上约80%的MPs是通过河流进入到海洋环境中[49]。MPs在陆地和海洋的迁移是双向的,在涨潮或发生洪水时,MPs将从河流或海洋向陆地进行迁移。此外,由于MPs质量轻、密度小,会悬浮或漂浮在水体表面,易在潮汐、海啸、风浪和洋流等外力条件下在海岸带和海洋等各种水环境中迁移。
MPs的迁移过程取决于许多因素,包括人类行为(乱扔塑料制品或回收利用)、颗粒自身特征(尺寸大小、密度和形状)、天气(风力、降雨)、水文条件(流速和水位)、环境地形等。MPs在淡水环境迁移时,流速越慢、河水越深越易沉积,反之越易迁移[50]。由于聚集沉积和斯托克斯沉降作用,中等粒径的MPs更易迁移,而较小或较大粒径的却易被截留[51]。
由于海洋的流动性,MPs在海洋中普遍存在,受环流等作用影响,MPs甚至在两极和深海[52]也被发现。2002年,人们首先在北太平洋中央环流中发现了高浓度的微塑料,并创造了“海洋垃圾带”一词[53]。全球的5个海洋环流(北大西洋、南大西洋、南印度、北太平洋和南太平洋)均发现大量MPs聚集,包括塑料碎片、颗粒、聚乙烯、聚丙烯和塑料薄膜[54-55]。此外,MPs能够通过海洋及大气的长距离运输影响人类活动低的偏远地区和内陆湖泊,造成全球性的MPs污染[56]。海洋中MPs最终有2个去处:一方面受重力影响,密度超过海水的MPs会下沉并堆积在海洋沉积物中;另一方面,低密度的MPs漂浮在水面或悬浮在水中,并受风浪而向海岸线迁移,或者在生物污染的作用下密度增大,最终沉积深海[57]。因此,海岸线、深海地区和海洋沉积物能够富集MPs。
进入土壤的MPs可在气候(风力、降雨)、植物根系、生物和机械扰动作用下发生横向和纵向迁移。其中风力可使MPs发生长距离的横向迁移。Bergmann等[58]发现欧洲偏远地区阿尔卑斯山的雪中均有相当高浓度的MPs存在[58]。降雨则可影响MPs的纵向迁移。O’Connor等[59]在砂土柱中MPs的渗透迁移模拟实验中发现,MPs的迁移深度与干湿交替循环次数成正比,增加渗透液体积或表面MP浓度对迁移深度的影响很小,作者由此预测100年后MPs的平均渗透深度达5.24 m[59]。土壤中的生物活动和植物根系生长能够促进MPs的横向和纵向迁移,且MPs粒径越小,越易于迁移[60],不同动物物种对MPs的迁移影响有显著差异[61-62]。MPs迁移至土壤内部后可通过侵蚀、地表径流等方式进入水体(包括地下水),进而迁移至海洋中。Nizzetto等[63]利用INCA-污染物分布理论模型模拟发现,从使用污泥的土壤中迁移至水体的MPs比例为62%~84%,是水环境中MPs污染的重要来源。因此,土壤不仅是MPs的“汇”,也是水体中MPs的“源”。
此外,MPs在土壤中受风化、高温氧化、紫外辐射、生物降解和机械磨损等作用,表观形态及聚合物分子化学结构均可被改变,包括内部分子键断裂和歧化等,从而进一步分解成粒径更小的MPs甚至是纳米级塑料。生物降解是土壤中MPs降解的重要途径之一,农用塑料薄膜PE碎片难以自然降解,可长期存在于自然界中,最终形成较小的微塑料残留物,而PE降解菌的存在可加快其降解过程[64-65]。
3.2 食品包装塑料中化学品的环境污染过程
在紫外线辐射、风化、温度、湿度、氧化、pH及可溶性有机质的影响下,结合于塑料中的化学物质可在其风化降解过程中释放,如通过淋溶作用进入土壤,然后从土壤向水环境迁移,也可通过植物吸收进入食物链,对生态系统和人类造成危害。这些塑料添加剂的释放速度和释放量受pH[66]、环境条件[67](微波、高压蒸汽和太阳辐射)、浸泡时间、温度、塑料老化降解程度及理化性质等影响。老化的或者脆性MPs释放添加剂的速率较快[68]。
PAEs和BPs是塑料食品包装材料中最常用的添加剂,其通过包装接触向食品中的迁移过程引起了人们的高度关注。研究表明,包装食品运输过程中的震荡、暴晒、高温及食用前的微波加热、蒸煮等情况,均会加速塑料中PAEs和BPs向食品中的迁移行为,从而威胁人体健康[69]。PAEs和BPs的迁移量受食品类型、pH、温度和储藏时间影响[69-71];接触时间越长,迁移量越大[72-73]。其中PAEs化合物DEHP极易迁移至食品中,其在食品中的含量容易超过欧盟安全限量标准委员会的限制标准[73]。在我国江苏省、安徽省、浙江省和陕西省等4个地区抽取的PVC和复合材料塑料食品包装样品中分别检出了DEHP、DBP和邻苯二甲酸二异丁酯(diisobutyl phthalate, DIBP)[74]。一次性塑料杯、塑料保鲜袋及塑料保鲜膜[75]、快餐和早点包装用一次性餐盒[76]中也均有PAEs检出,但低于国家限定的迁移量。食品保鲜膜中的主要增塑剂DEHA也极易迁移到其所包裹的肉类、鱼类、奶酪和即时食品中[77]。塑料餐盒在盛放高温汤水时(>65 ℃)会析出包括BPA在内的6种有害成分,经食用或饮用进入人体后会对人体生殖系统等造成伤害[78]。BPA的迁移量受温度、储存时间、酸度、乙醇浓度、溶剂极性及萃取方式和消毒灭菌情况的影响;温度升高、储存时间延长、酸度和乙醇浓度增加、微波加热时间延长、油脂增加,BPA的迁移量增加[79]。但因BPA易挥发,温度过高时BPA的迁移量反而减小;相同温度时,食品模拟溶剂极性越小,迁移量越高;溶剂相同时,微波萃取的迁移量明显高于水浴加热萃取[78]。温度和时间对食品灭菌罐涂漆中BPA的迁移量无显著影响,但对未消毒罐中BPA的迁移量有显著影响[80]。
此外,一些塑料添加剂以聚合状态和游离状态赋存于塑料中,在MPs进入人体后有可能缓慢释放出来,并形成复合暴露风险。聚合态化合物的释放过程主要由塑料本身的降解速率决定,而游离态添加剂则在进人环境后可很快通过浓度梯度扩散释放。
4 生态与健康风险(Ecological and health risks)
4.1 塑料及其中化学品的生态效应
4.1.1 塑料/微塑料的生态毒性效应
由于MPs粒径小,很容易被生物误食,特别是海洋生物,其次是淡水生物和土壤生物。自然界中,超过220个物种被发现能够摄食MPs,小至浮游生物、鱼类、贝类、龟类、鸟类,大到鲨鱼、鲸鱼等哺乳动物,其中超过150种是海洋鱼类[81]。目前对于淡水和土壤环境的研究较少,仅发现淡水鱼、大型溞(Daphniamagna)、蚯蚓(Pheretima)和秀丽隐杆线虫(Caenorhabditiselegans)能够摄入MPs。
由于MPs很难降解,一旦进入生物体将会对肠道系统产生大量机械性损伤,比如饮食器官和消化道梗阻、假性饱腹感和由此引发的摄食效率降低[82]、肠道功能紊乱、营养不良、生长缓慢、行为异常、受伤甚至死亡[83]。虽然大部分被生物摄入的MPs能够通过排泄过程排出体外,但仍有少量MPs存在于肠道中,甚至穿过肠道壁进入其他脏器,进一步产生毒害效应。粒径较大的MPs除了被生物摄食外,还能附着在生物体表面,甚至富集在水生生物的鳃、肝脏、淋巴组织和肌肉等组织和器官中[84],从而引发生物体的渗透压和呼吸作用异常,引起肠道炎症等。粒径较小的MPs可能会进入血液循环系统或其他周边组织,进而对整个生物机体产生毒害作用。研究发现,PVC碎片长期暴露会引起鱼肠道末端明显的炎症反应,且暴露时间越长,肠道末端的病理改变越明显,甚至肠道功能完全受损[85]。Rodriguez-Seijo等[86]研究了不同浓度的PS微粒(粒径为250~1 000 μm)对蚯蚓的毒性效应,发现虽然不同浓度的PS颗粒对蚯蚓成虫的繁殖、成长、存活数量、暴露28 d存活率、幼虫数量和最终体质量等均无显著影响,但其肠道病理检测结果显示,在PS浓度>125 mg·kg-1时,会产生显著的组织损伤,且不同浓度的PS颗粒也会产生不同程度的免疫应答。
除使肠道系统受损外,MPs还可使生物体产生一些应激性反应和组织损伤,延缓发育、降低繁殖力[87]。MPs主要沉积在贝类的血淋巴、鳃和消化组织中,致使其产生诸如免疫反应改变、溶酶体改变、过氧化物酶体增殖、抗氧化系统改变、神经毒性和遗传毒性等细胞毒性效应[88]。MPs还可干扰生物的内分泌系统,影响其酶活性,通过改变机体内某些信号通路和蛋白表达,造成细胞坏死,从而影响生物的生长繁殖和寿命。
低营养级生物体内的MPs可通过食物链传递作用进入高营养级生物体内,最终进入人体并富集,从而产生潜在危害。商业贝类[89]、海盐、湖盐、岩盐、井盐[90]和塑料茶包[91]等样品中均已检出了MPs的存在,由此估算消费者每年通过海产品和盐类饮食对MPs的暴露量分别可达1.1×104个和37个,且仅接触茶袋释放的MPs颗粒就会对人体造成生物剂量依赖性的行为和发育影响。研究表明,在人类的粪便内可检测出多达9种MPs,其直径在50~500 μm之间,其中直径<150 μm的PS和PVC微粒可以通过人类的肠道移动到淋巴系统和血液循环系统中[92]。
此外,MPs比表面积大,疏水性强,极易吸附和富集环境中的重金属和持久性有机污染物,如PAEs、BPA、双对氯苯基三氯乙烷(dichlorophenyl trichloroethane, DDT)、多环芳烃、多氯联苯、有机氯农药和抗生素等,从而成为多种毒害污染物的载体。MPs对有机污染物的吸附量比天然沉积物和土壤高出约2个数量级,比海水中有机化合物的浓度高出6个数量级[93]。随着MPs被生物体摄取吸收,其上所吸附的有毒物质也同时进入生物体中并累积,两者联合不是MPs和有害物质各自对生物体毒性的简单叠加,而是复合暴露毒性效应,会造成更加严重的化学性伤害,甚至产生病理性损伤。Rochman等[94]研究发现,暴露在含复杂混合物PE颗粒中的鱼类出现了严重糖原消耗、脂肪空泡化、细胞坏死和病变等一系列肝脏应激反应,其中摄食了吸附有持久性有毒物质如多氯联苯的PE颗粒的鱼,其肝脏出现严重的脂肪空泡化,作者由此认为MPs会造成生物肿瘤病变。成年日本青鳉鱼(Oryziaslatipes)长期暴露在含内分泌干扰物质的MPs中,其内分泌系统受到严重影响,雄鱼的生殖细胞异常增殖,雌鱼的基因表达显著下调[95]。PE和多环芳烃联合对海洋虾虎鱼(Pomatoschistus)成鱼和幼鱼具有短期神经毒性作用,能显著降低其乙酰胆碱酯酶和异柠檬酸脱氢酶的活性,从而导致天然鱼群死亡率上升[96]。
由于MPs具有良好的流动性和稳定性,能在水体中长距离迁移,为微生物、浮游动物和藻类等生物提供附着生长的载体,因而可能影响生物的群落结构和组成。在天然水体中,MPs表面大约l周内便可附着生物膜,生物膜上含有大量的微生物、藻类和虫卵[97],产卵密度与MPs含量显著正相关[98]。一些有害生物会附着在MPs上,为生物传播提供载体,当附着生物的MPs跨生物地理区迁移时,就可能导致生物入侵。同时,MPs上吸附的有毒物质也随之从环境转移到生物体内,并沿食物链产生富集放大,毒性效应增强,最终进入人体产生潜在性危害。
4.1.2 塑料中的化学品的生态毒性效应
塑料制品中的各类添加剂,如PAEs、BPs、苯甲醛、多溴联苯醚等,对不同生物体也存在程度不同的毒性效应。其中部分化合物会对生物体产生呼吸困难、麻醉等急性毒性作用。动物实验表明,大鼠吸入333 mg·kg-1的ABS塑料的单体丙烯腈(acrylonitrile, AN)达4 h时会产生呼吸毒性[99]。PVC塑料的单体VCM具有麻醉作用,会引起人体四肢血管收缩而产生痛感[100]。斑马鱼(Daniorerio)和黑斑蛙(Pelophylaxnigromaculatus)毒性暴露实验证明,BPF与BPA生物毒性相当[101-102],毒性等级为Ⅱ级,属于中毒,而BPS的急性等级属于低毒[103]。SCCPs在μg·L-1水平就对水生生物有慢性毒性效应,在几十到几千mg·kg-1水平对陆生生物有毒性效应[104]。
不仅是急性毒性,这些塑料添加剂还可被生物体吸收并在体内积累,并产生不同程度的化学性危害或病理性损伤,如影响酶活性、干扰内分泌和神经系统等,进而影响生物的生长发育、繁殖、运动等正常生理现象,一些化合物还具有致癌性。研究表明,当苯乙烯质量分数超过0.05(即LD50=50 g·kg-1)时能抑制成年大鼠(Rattusnorvegicus)的中枢神经系统,引起心率不整,并导致其生育能力、肝脏及肾脏平均质量下降等症状[18]。MF本身无毒,但其热固性易受温度影响,导致塑料中含有一定量的游离甲醛,尤其是酚醛树脂和脲醛树脂。甲醛是细胞的一种原浆毒,已被证实可导致大鼠鼻癌,并诱发多种微生物基因突变[105]。VCM可引起动物胚胎毒性及肌肉和骨骼发育异常;在肝脏中形成氧化VCM并与DNA结合形成肿瘤,产生强致癌致畸作用[100]。已有塑料浸出实验证明,PAEs增塑剂会对大型蚤(Daphniamagna)产生毒害作用[106],使绿海胆(Lytechinusvariegatus)的胚胎发育异常率增至58%以上[107],甚至对海洋甲壳类动物Nitocraspinipes产生致死作用[108]。一定浓度的BPA可对动物神经细胞产生毒性效应,导致细胞受损;BPA还表现出致癌和致畸性,可增加实验动物造血细胞癌变,诱发睾丸肿瘤,并可在动物胚胎时期或器官形成过程中产生致畸作用[109]。BPS和BPF能显著降低斑马鱼胚胎产量和孵化率,延长孵化时间,减弱免疫能力,低暴露水平会危害大脑发育和影响行为,甚至产生致畸效应,如脊柱弯曲、尾部畸形等[110-111]。斑马鱼胚胎BPAF暴露实验表明,子代斑马鱼的畸形率随浓度升高而增大,存活率随浓度升高而降低;且低浓度(5 μg·L-1)的BPAF会使斑马鱼子代受精卵孵化延迟[112]。SCCPs可引起非洲爪蟾(Xenopuslaevis)发育畸形、胚胎生长缓慢[113]和幼年虹鳟鱼(Oncorhynchusmykiss)严重的肝脏组织病理学反应,包括大范围的纤维损害和肝脏细胞坏死,但未观察到对甲状腺的损害[104,114]。
除此之外,多数塑料添加剂存在潜在的雌激素效应,可导致动物内分泌紊乱、血红细胞减少、肝肾功能下降等疾病[115]。动物实验表明,某些PAEs及其代谢物是环境类雌激素物质,可模拟体内天然激素与激素受体结合,使机体体内激素产生过度作用,从而导致内分泌失调、生殖细胞基因损害和卵子质量异常变化等,进而阻碍生殖发育等机能,最终导致习惯性流产、停产、早产和胎儿畸形(遗传变异)等[116],长时间的累积暴露甚至有引发恶性肿瘤与生物绝种的危害[117]。BPs也是一类重要的内分泌干扰物,会影响高等动物各方面的生理代谢。其中BPA能够与雌激素受体结合导致内分泌失调,阻碍雄性生殖器官的发育,降低精子活性或繁殖能力[118]。实验证实,小剂量的BPA即可对细胞功能产生作用,导致诸如前列腺癌细胞增殖、影响睾丸激素合成、抑制甲状腺分泌激素行为等[119]。此外,BPA具备急性毒性与类雌激素活性诱变性,同时与多种疾患的发生存在某种关联,如心血管疾病、糖尿病、肝脏疾病等[120]。在雌激素受体结合、雌激素活性和抗雌激素活性方面,BPS和BPF具有类似于BPA激素效能,平均雌激素效能BPA=BPF>BPS[110,121],BPS会促进雄性斑马鱼体内的雌二醇浓度升高,降低雄激素浓度,进而减少精子数量;而BPS和BPF均会升高雌性斑马鱼体内的雌二醇浓度[122]。BPS还具有BPA所缺乏的部分类胆固醇激素活性,引起17-OH孕酮显著增加[123],与脂肪蓄积和肥胖的发生存在关联[124]。此外,研究表明,BPAF、BPB和双酚Z(BPZ)等BPs比BPA具有更强的雌激素活性[125],如BPAF与雌激素受体ERα和ERβ的结合能力分别是BPA的20倍和48倍[126]。在对大鼠持续13周分别喂食5 000 mg·(kg·d)-1和2 000 mg·(kg·d)-1的SCCPs后并未观察到其生殖器官发生改变,但高剂量的SCCPs会导致雌鼠严重的生育中毒,并影响其发育[104]。
4.2 人体健康效应
4.2.1 塑料/微塑料的健康毒性
一般来说大块塑料一般不容易被人摄入,但塑料食品包装材料年消耗量不断激增,导致人类随时随地都会与MPs接触,在高浓度或高个体敏感性条件下,MPs进入人体后的释放和积累会产生健康风险。目前推测MPs被人体摄入的途径主要包括以下途径。
(1)通过饮食直接摄入。市售鱼类[127]、啤酒、海盐、生活饮用水[128]和贝类[129]等样品中均已检测到高浓度的MPs,人体外暴露水平高。
(2)通过呼吸道摄入。风可使MPs随地面扬尘漂浮到空中并通过呼吸作用进入人体,并引起一些慢性疾病,如慢性支气管炎、肺泡炎和哮喘等。由于MPs不易被人类肺部清除干净,从而留在肺部进入人体呼吸系统,这可能造成肺部的炎症反应和DNA损伤,进而导致免疫力下降并可能诱发癌症。据估算,人体肺部每天要暴露在26~130个空气MPs中,其中甚至能观测到长达250 μm的塑料纤维[130]。研究人员在我国39个主要城市的室内外粉尘中均检测到PET的MPs,约70%的样本中检测到PC的MPs[131]。PVC生产厂工人患肺癌的风险与其年龄、暴露剂量和暴露时间显著正相关,其致病机制是MPs刺激体内的氧化应激反应导致DNA损伤(加合物和突变),促炎介质促进血管和有丝分裂生成,有利于恶性细胞的形成,而慢性刺激和炎症可促进癌症的发生[132]。合成纺织工人慢性呼吸系统疾病的患病率高于非纺织工人,其中以咳嗽发生率最高,即在合成纺织厂吸入粉尘导致呼吸障碍[133]。
(3)通过皮肤接触。使用含有MPs的洗护清洁产品可能导致其通过皮肤屏障进入人体,但目前由于皮肤暴露引起的毒性实验大多数在鱼类模型上[134],尚未有研究证明MPs可以通过皮肤暴露途径对人体造成直接危害。
4.2.2 塑料食品包装材料中化学品的健康毒性
塑料对人体健康的潜在危害主要在于其中的毒害化学物质,如PAEs、BPs、苯甲醛和多溴联苯醚等,这些化合物具有不同程度的神经毒性、内分泌干扰毒性、生殖发育毒性甚至致癌性,在塑料或MPs迁移过程中逐渐被释放出来,被生物体吸收并最终进入人体产生健康危害。
4.2.2.1 合成树脂单体
纯树脂本身是无毒的,但实际的合成树脂材料并不是一种纯物质,其中含有未反应完全呈游离状态的单体分子(如PVC单体、PS单体、乙烯、丙烯、苯乙烯和甲醛等[135])、裂解物和降解物等,这些单体化合物多具有一定毒性甚至致癌性,且容易从包装材料中释放进入食品,从而造成食品安全和健康风险。PS本身无毒,卫生安全性好,但其单体苯乙烯及其他一些挥发性物质,如乙苯、异丙苯、甲苯等均有一定毒性,其中苯乙烯、乙苯、甲苯对眼睛和呼吸道粘膜有刺激和麻醉作用,可引发血液系统疾病[136],尤其是苯乙烯,可引起神经、血液等系统受损。MF本身无毒,但其产生的游离甲醛进入人体后因氧化还原反应而被还原成甲醇,甲醇会影响人体内酸碱平衡,从而产生代谢性酸中毒、中枢神经系统及视力受损等。美国职业安全与卫生研究所已将甲醛列入人体可疑致癌物[24]。
ABS的单体AN也是人类潜在致癌物之一,具有较强毒性,人体大量接触时会引发高铁血红蛋白血症,造成肾脏损伤、血液生化物质改变等。水杯和婴幼儿奶瓶中残留的BPA是一种类雌激素物质,会影响内分泌系统,导致婴幼儿荷尔蒙分泌紊乱。我国在2011年已禁止生产使用含有BPA材质的奶瓶。
除了在合成过程中生成低聚体外,塑料制品在使用过程中因受到外界环境影响而发生老化,会降解生成低分子量物质,这些降解物在与食品的接触过程中同样会迁移进入食品,进而被人体摄入并造成危害。例如:在加工、储藏和使用过程中,PET在一定温度下会与空气中的氧发生缓慢的热氧化反应而降解(即热氧老化),生成有毒的甲醛、乙醛等挥发性醛类[137]。
4.2.2.2 增塑剂
虽然多数增塑剂急性毒性很低,但其低剂量长期暴露产生的慢性毒性对人体危害相当大。PAEs可通过多种途径进入人体内,如呼吸、食物链传递、皮肤接触等。如果吸入过多的PAEs蒸气会刺激呼吸道和眼粘膜,出现疼痛症状。如果皮肤长期暴露在高浓度PAEs的环境中会出现致敏反应。某些PAEs及其代谢物是环境类雌激素物质,对人体可产生与动物类似的毒性效应,如内分泌失调、生殖细胞基因损害、卵子质量异常变化等,进而阻碍生殖发育等机能[116]。有学者发现PAEs能够通过抑制胎儿睾丸的睾酮合成,破坏雄激素依赖性结构的发育[138],导致男性胎儿出现尿道下裂、睾丸停止发育、精子数量减少、阴茎变小等症状。此外,PAEs还会产生有毒物质,对人或动物的神经系统造成影响,从而削弱人和动物的可逆记忆[139]。不过,PAEs对人体健康的伤害是一个慢性过程,需要较长周期才会出现并发症,德国研究者就专门针对儿童体内的PAEs残留做了跟踪调查[140]。鉴于PAEs的致癌、致畸、致突变效应,国际癌症研究署(International Agency for Research on Cancer, IARC)和美国环保局(U.S. Environmental Protection Agency, US EPA)均将其列为人类可能的促癌剂或致癌物质。国内外对塑料食品包装中的PAEs的最大残留量/限值(maximum residue limit, MRL)有明确规定,包括欧盟指令(2007/19/EC)[141]、中国的国家标准(GB/T 9685—2016)[16]等。
大量研究表明,BPA及其替代物对人体可产生与动物类似的毒性效应,如影响内分泌失调,对神经细胞产生毒性,具有致癌致畸作用,甚至诱发多种疾病,如影响大脑发育、多动症、脂肪蓄积和肥胖发生的相关性[109,118-120,124]。BPA、BPAF、BPS和BPF能改变人外周血单个核细胞(peripheral blood mononuclear cell, PBMCs)(包括淋巴细胞和单核细胞)的形态,促进活性氧的生成,导致PBMCs脂质和蛋白质损伤,其中以BPAF氧化刺激最强,低浓度BPAF(1 μg·mL-1)即可表现细胞毒性潜能;BPA和BPS对蛋白质氧化损害最大,通过增加PBMCs内活性氧的含量,降低细胞的存活率,从而造成蛋白质氧化损害,威胁人体健康[142]。由于BPA的致癌、致畸和内分泌干扰作用,欧盟法规(EU No.10/2011)[15]对塑料食品接触材料中BPA的迁移限量作了规定,并限定人体日摄入的最大可接受剂量为0.05 mg·kg-1bw。美国食品与药物管理局(U.S. Food and Drug Administration, US FDA)规定BPA可以作为食品接触材料的原料使用,但必须严格限制其使用量。加拿大政府于2010年3月11日通过了《危险品法》,提出禁止在一次性PC饭盒中使用BPA的修订法令,是全球第一个颁布BPA禁令的国家。由于BPS在环境中比BPA有更长的半衰期、持久性和更强的皮肤渗透能力[143],所以我国在国家标准(GB 9685—2016)[16]中规定BPA和BPS在食品或食品模拟物中的迁移限量分别为0.6 mg·kg-1和0.05 mg·kg-1,BPF尚未被纳入正面清单。
将人体肝癌细胞(HepG2)暴露于SCCPs(0、1.0、10.0和100.0 μg·L-1;C13-CPs,55.5% Cl)后,检测其小分子代谢物发现,SCCPs可引起细胞在糖代谢、氨基酸代谢和脂肪酸代谢方面发生不同程度的紊乱,其中低剂量(1.0 μg·L-1)暴露可明显刺激HepG2细胞对氨基酸的吸收,而高剂量(100.0 μg·L-1)SCCPs暴露抑制了细胞对氨基酸和葡萄糖吸收,从而不可避免地影响蛋白质的合成,同时SCCPs的暴露使饱和脂肪酸代谢紊乱,使不饱和脂肪酸水平上调[104,144]。鉴于SCCPs具有持久性、生物累积性和生物毒性,国际癌症机构和欧洲化学物质信息系统均将SCCPs列为致癌物质,联合国环保署将其列入《关于持久性有机污染物的斯德哥尔摩公约》禁用POPs清单。欧盟POPs法规(EU 2015/2030)[145]规定所有物品中SCCPs质量分数低于1%,消费品中SCCPs质量分数应不高于0.15%。
4.2.2.3 酚类抗氧化剂
酚类抗氧化剂也是一类环境雌激素物质,可以在人体内蓄积并干扰人体内分泌系统,威胁人体健康。研究表明,人体短时间接触BHT会产生恶心、呕吐、呼吸困难、定向障碍等过敏反应,长期或反复暴露会损害人体甲状腺、肝、肺等器官,食品中的BHT被人体消化系统吸收后可抑制呼吸酶的活性,造成染色体病变,存在致癌风险;而一定量的TBHQ摄入会引起人体耳鸣、反胃、作呕、窒息和虚脱等症状;同时还会抑制人体内酶活性,长期的摄入会引起人体神经系统、生殖系统、免疫系统等疾病;个别苯基取代的亚磷酸酯也被证实会对人体产生一定的毒性[8,25,146]。
4.2.2.4 稳定剂
铅镉稳定剂中尤其是铅经人体摄入后,会造成神经系统、免疫系统、消化系统等损害,严重时可破坏造血系统,导致肾功能衰竭,尤其是婴幼儿,摄入铅后会引起血铅中毒;三烃基锡、四烃基锡等有机锡化合物多为神经毒物,二烃基锡则被证实具有胆管和肝脏毒性[24-25]。
4.2.2.5 荧光增白剂
荧光增白剂一旦进入人体便会与体内蛋白质结合,引起蛋白质变性沉淀和累积。因其普遍含有苯乙烯基或芳香胺基结构,性质稳定,不易被分解,只能通过肝脏酵素分解,从而不仅加重肝脏负担,而且削弱人体免疫力及伤口愈合能力,甚至造成感染。荧光增白剂进入人体血液循环系统后还会破坏红细胞的细胞膜引起溶血,损害血液系统。长期接触荧光增白剂会对细胞的正常发育和成长产生影响,具有潜在的致癌风险[21,147]。目前,欧盟的法规(EU No.10/2011)[15]、中国的国家标准(GB/T 9685—2016)[16]均明确列出了允许用于生产食品接触材料/制品的荧光增白剂清单,同时对其最大使用量和SML做出明确规定。
4.2.2.6 印刷油墨及溶剂
甲苯、丁酮、乙酸乙酯和异丙醇等是油墨中的常用溶剂,其中苯类溶剂毒性最大,渗入皮肤或血液后会随血液循环危及人的血球及造血机能,损害神经系统,导致溶血性贫血、再生障碍性贫血和白血病等血液系统疾病的发生[13]。世界卫生组织和US FDA已将其列为可致癌化学品[22]。日本相关部门也明确规定,凡是食品包装,必须使用醇溶油墨取代甲苯油墨。我国在《包装用塑料复合膜、袋干法复合、挤出复合》(GB/T 10004—2008)[148]中也规定了油墨溶剂残留总量不得高于5 mg·m-2,其中苯类溶剂不得检出。
4.2.2.7 胶粘剂和稀释剂
一般情况下胶粘剂中的溶剂应该是单一的高纯度的乙酸乙酯,但个别厂家为降低生产成本,使用回收的不纯净的乙酸乙酯,杂质多,有异味臭味,更甚者还会掺和一定量的甲苯,对人体危害较大。此外,胶粘剂中的重金属也存在潜在的迁移问题,威胁消费者健康[149-150]。
4.2.2.8 “毒包装”材料
甘肃“毒奶粉”事件导致多名婴幼儿患肾结石、塑化剂风波导致消费者对食品行业尤其是饮料行业的恐慌,这些事件引起了人们对塑料食品包装材料的高度重视。我国在《食品用塑料包装、容器、工具等制品生产许可审查细则》中规定,食品用塑料包装产品生产时必须使用食品用原辅材料,不得使用外购回收料及受污染的原料。然而,一些企业为了获取利益最大化,用工业级材料进行生产,有的企业甚至违规添加高比例的外购回收料,这些回收料来源广泛,成分复杂,有的可能是医疗垃圾,有的可能接触过一些废弃物,在流通回收渠道过程中存在二次污染,其安全性根本得不到保障。而且,塑料的再生加工过程往往还会再加入一些增塑剂、掩盖剂等化学品,进一步增加了毒害化学品迁移到食品中的风险。此外,某些企业还会加入大量的碳酸钙、滑石粉等无机矿物填充料,造成产品蒸发残渣严重超标,在盛装酸性或脂肪性食物时易析出粘到食物上,导致消费者食用后出现胆石症等症状[13]。
5 总结与展望(Summary and prospect)
我国不仅是塑料包装食品的生产大国,也是外卖餐饮消费大国。据我国互联网络信息中心《第47次中国互联网络发展状况统计报告》:截至2020年12月,我国网上外卖用户规模达4.19亿,手机网上外卖用户达4.18亿[151];外卖市场交易规模达8 352亿元,同比增长14.8%[152]。但大量使用的一次性塑料餐盒和其中的各类化学品(尤其是PAEs、BPA及其替代物、CPs等塑料添加剂),以及废弃后产生的塑料垃圾和MPs污染对生态环境和人体健康的潜在危害值得进一步关注。鉴于此,今后的研究应着重于以下方面。
(1)重点研发高效低廉、可生物降解、可再生、可再加工重复利用的绿色环保食品包装材料,如铝箔材料、可食用材质等;寻找低毒甚至无毒无害的增塑剂替代DBP、DEHP、BPA、BPS和BPF等常用的且存在生物毒性的增塑剂;用安全材料替代受限制或可疑材料,如采用PET替代PVC,PP替代PS。
(2)加强对一次性塑料餐盒中各类化学品在食品中的迁移特征和毒性风险研究,尤其是PAEs、BPA及其替代物、CPs等塑料添加剂,并重点开展多种塑料添加剂对人体的联合毒性试验,探索其是否存在毒性相互促进/协同或拮抗效应,科学全面地评估塑料餐盒使用及废弃全过程对生态系统和人体健康带来的潜在风险,特别是对胎儿和婴幼儿暴露风险。
(3)加强对MPs污染现状和迁移规律的系统研究,利用基因组学、蛋白组学、代谢组学和同位素示踪定量技术等分子生物学新技术,综合考虑真实环境中不同生物的生活习性、构造特征及复合污染,深入探索MPs的生态毒性效应,尤其是其生物毒性机制及食物链传递效应以探究生物体摄入MPs的毒性机理。
(4)完善食品塑料包装材料的生产使用和废弃塑料制品回收的相关法律法规,严格监督规范企业生产塑料食品包装材料时使用PAEs、BPA及其替代物、CPs等有毒有害化学品的用量,加强监管部门对企业的监督检查。同时强化企业的安全责任,建立健全的企业生产工艺体系,引进先进的技术也设备,使用新型环保溶剂(醇溶性油墨)或开发推广无溶剂复合工艺,严格生产过程,保证食品塑料材料的生产质量。
(5)加强社会宣传,提高消费者的食品安全意识和对塑料污染危害的认识,进而改变消费行为、积极主动减少塑料制品的使用和塑料垃圾的排放、促进垃圾的循环使用和无害化处理等,都有助于从源头上解决塑料污染问题。

