帕博丽珠单抗致肺肉瘤样癌超进展1例
宋忠全 郭桂芳 朱燕梅 郭涛 韩强
肺肉瘤样癌(pulmonary sarcomatoid carcinoma, PSC)是一种罕见、低分化、进展迅速、具有高度侵袭性的、治疗手段有限、放化疗不敏感、恶性程度极高、预后极差的肿瘤。高表达PD-L1、高肿瘤突变负荷的患者可以从免疫治疗中获益。本文报道的PSC为高表达PD-L1、帕博丽珠单抗治疗后超进展性疾病(hyperprogressive disease,HPD)。
病例资料
患者男性,60岁,因胸背部疼痛1月余入院。患者入院前1月无明显诱因出现右侧胸背部持续性钝痛,咳嗽、深呼吸时加重,伴阵发性咳嗽,咳少量白粘痰,余无不适,未予重视,后症状逐渐加重,于2020年10月1日就诊于当地医院,行胸部CT示:右肺上叶高密度灶,肿瘤可能性大;左肾上腺肿块,考虑转移;双肺间质性改变、肺气肿、肺大泡、慢性支气管炎。遂以肺肿物入住我科。患病以来,饮食、睡眠差,大小便正常,近1月体重减轻约3~4公斤。既往2型糖尿病病史10余年,平素服用二甲双胍缓释片、阿卡波糖;冠心病、支架植入术后半年余,平素服用阿司匹林片、瑞舒伐他汀、氢氯吡格雷;否认高血压及其他病史。吸烟40余年,每日约30支;饮酒40余年,每日约250g,婚育史、家族史无特殊。入院查体:体温:36.7℃,血压:133/90mmHg,神志清,精神可,胸廓对称,双肺听诊呼吸音低,未闻及明显干湿性啰音;心、腹查体无异常。初步诊断:肺肿物性质待诊:肺恶性肿瘤?冠心病,心功能I级;2型糖尿病;间质性肺炎;慢性支气管炎;冠脉支架植入术后。积极完善相关检查,结果回示:血常规:WBC 16.63×109/L,中性粒细胞绝对值(GRAN) 14.07×109/L,Hb 101 g/L;CRP 71.5 mg/L;PCT 0.29 ng/mL;肝功:ALT 128U/L,AST 87U/L,白蛋白 27.5g/L;乳酸脱氢酶(LDH)212 U/L(参考范围:103~198 U/L);肿瘤标志物(CY211 5.37 ng/mL,NSE、CEA、CA72-4未见异常),肾功、电解质、血脂、D二聚体、血糖、凝血常规、尿常规、心脏彩超等均未见明显异常,治疗上暂给予抗感染、化痰、保肝、调脂、降糖等治疗。并积极完善颈+胸+腹+盆腔CT平扫+强化(图1~4):右肺上叶占位,伴纵隔淋巴结多发肿大,考虑周围型肺Ca可能大;左侧肾上腺占位,考虑转移瘤;右肾囊肿、右肾结石。全身骨扫描、颅脑MR未见转移征象。停用抗凝药物1周后,于2020年10月9日完善CT引导下肺穿刺,病理(图5)回示:肺肉瘤样癌(PD-L1<肿瘤细胞+,90%>)。期间多次复查血常规、肝功示:红细胞、血红蛋白、白蛋白进行性降低,转氨酶正常,考虑肿瘤消耗。进一步完善基因检测(EGFR、ALK、ROS1、KRAS)未见突变。患者诊断明确,临床分期cT4N0M1b ⅣA期,无手术机会,机体功能欠佳,可行抗血管生成联合免疫治疗及局部粒子植入治疗。家属同意行免疫治疗,完善免疫前检查:皮质醇、TSPOT、甲功、BNP、ACTH均未见明显异常,2020年10月15日给予帕博利珠单抗 200mg治疗,后出现发热,给与积极对症处理,体温降至正常,病情稳定出院。院外仍咳嗽、咳痰,间断发热,无明显胸痛,于2020年11月7日再次就诊我科行下一周期治疗,入院评估病情PS=1分,完善血常规:WBC 17.64×109/L,GRAN 15.19×109/L,Hb 84 g/L;白蛋白 31.0 g/L;CRP 103.4 mg/L;PCT 0.72 ng/mL;D-二聚体 3.3 mg/L;LDH 319 U/L,余肾功、甲功、血脂、BNP、肿瘤标志物等较前无明显变化,给予抗感染、化痰等对症治疗。进一步完善胸部CT平扫+强化(图6~8)示:右肺癌,左肾上腺转移治疗后复查,较前片进展;新发右肾上腺占位,考虑转移。遂于次日行CT引导下粒子植入术(图9),后出现持续性发热。多次复查WBC、PCT、CRP进行性上升,耐药菌感染不除外,给予利奈唑胺联合比阿培南抗感染,并辅以激素抗炎治疗,体温恢复正常;期间复查WBC最高达38.65×109/L,余炎性指标好转,完善骨髓穿刺考虑反应性血细胞增多。无明显禁忌,2020年11月24日再次给予帕博利珠单抗治疗,病情稳定出院。出院后仍有咳嗽、咳痰,反复发热,伴右侧胸背部持续性疼痛,较前加重,偶有胸闷、憋气,活动后为著,于2020年12月14日就诊我科,入院病情评估PS=2分,血常规:WBC 14.91×109/L,GRAN 13.30×109/L,Hb 70 g/L;白蛋白 20.5 g/L;CRP 45.6 mg/L、PCT 0.88 ng/mL;余较前无明显变化。胸部CT平扫+强化(图10~12)示:右肺癌、双肾上腺转移治疗后复查,较前片进展;新增左肺上叶结节。给予对症治疗,症状改善可。CT示病灶进一步扩大,于2020年12月16日再次行CT引导下粒子植入术,并给予帕博丽珠单抗行第3周期治疗,病情稳定出院。出院10天后随访,患者胸痛、憋喘明显,反复高热,5天后死亡。
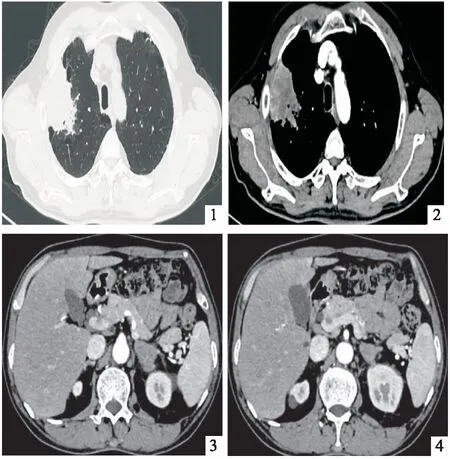
2020年10月3日
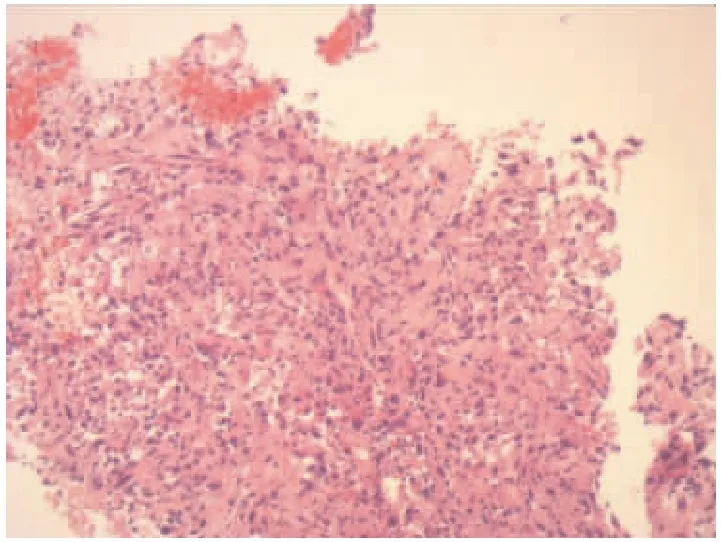
图5 (右肺穿刺组织)恶性肿瘤,伴大片坏死,结合形态学及免疫组化符合肉瘤样癌。免疫组化结果:CK广(+)、CK7(部分+)、ALK(-)、Syn(-)、CgA(-)、PD-1(-)、PD-L1(肿瘤细胞+,90%;间质细胞+,5%)、TTF-1(-)、CK5/6(-)、P40(-)、CD56(-)、Ki-67指数(20%,变性坏死严重)(HE×400)

2020年11月7日
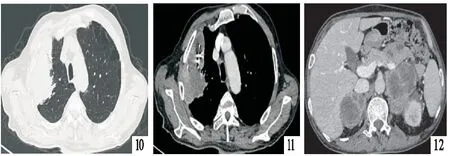
2020年12月15日
讨 论
PSC早期以手术和围手术期放化疗为主,对放化疗不敏感或不能手术的患者可行辅助放化疗或靶向、免疫治疗。近年来,研究报道PSC中有较高基因突变率:EGFR(3%~40%)[1]、KRAS(22%)[1]、MET(31.8%),其中MET阳性中14外显子跳跃突变率为60%[2],已有相应靶向药物用于PSC的研究。后报道,PSC的肿瘤突变负荷明显高于非PSC的非小细胞肺癌(NSCLC)[3],且PD-L1在PSC中的表达明显高于NSCLC[4],提示PSC可能从PD-1/PD-L1通路抑制剂中获益。目前PSC的免疫治疗多为个案报道,如:Schrock等报道1例Ⅳ期PSC患者,应用派姆单抗10个月,疗效评估PR[5];Salati等报道1例纳武单抗治疗脑转移PSC,脑转移灶完全消失,其它病灶部分缓解[6]。但本文患者首次行帕博利珠单抗治疗后即出现超进展。
鉴于免疫治疗的非常规反应,当实体肿瘤的反应评估标准评估为PD后,不再是选择轻易停药,继续使用免疫检查点抑制剂(ICI)可能带来56%有效率[7],在一定程度上改善患者的总生存,建议以8周为界进行超进展和假性进展的鉴别。本例患者首次治疗后评估为PD后未停药,在为期2月的治疗中出现原发病灶的进行性增大及新发远处转移,证实为HPD。也有研究表明[8],免疫治疗进展后,继续单用免疫治疗能带来34%获益率,或先局部治疗后继续免疫治疗,其疗效也是不错的。本例患者免疫治疗2周期后证实为HPD,但患者的体力状况恶化不能耐受化疗,故继续使用局部放射治疗联合免疫治疗。目前对于“超进展”具体机制不详,多种因素可能参与其发生发展,随后研究进一步探讨了ICI可能的负性因素,目前公认的:⑴MDM2基因扩增:MDM2作为一种癌基因,参与调控抑癌基因P53的表达;其几乎不表达于正常组织中,若表达增加将促进肿瘤的发生发展[9]。Kato等[10]研究证实ICI使MDM2扩增而引起HDP,其机制可能是ICI使IFN-γ升高, 激活JAK-STAT信号通路,使下游干扰素调节因子IRF-8表达增加,进而结合MDM2启动子诱导MDM2表达;MDM2高表达致P53蛋白失活, 加速肿瘤进展。⑵EGFR突变:研究报道[10],EGFR突变患者在使用ICIs过程中有20%发生HPD。相关研究表明,PD-L1表达与EGFR突变呈负相关,且突变型EGFR可导致免疫抑制性微环境及低肿瘤突变负荷[11]。⑶LIPI评分为差:衍生中性粒细胞/淋巴细胞比值(dNLR=中性粒细胞数/(白细胞数-中性粒细胞数))和LDH是反映机体抗肿瘤炎症和肿瘤负荷的替代物,高dNLR患者通常具有较高水平的中性粒细胞依赖性炎症和更低的CD8+、CD3+T细胞,于此Mezquita[12]等率先于2017年提出LIPI的概念,认为基线dNLR和LDH可能与ICI疗效有关。LIPI评分基线dNLR>3和LDH>正常上限,根据风险因素个数将患者分为3组:没有风险因素(好);1个风险因素(中);2个风险因素(差)。随后他们进行相关临床试验,证实3组患者有不同的PFS和OS,故其可初步的评估免疫疗效。而后研究[13]证实LIPI评分为差的患者接受ICI治疗更倾向于进展或HPD。⑷年龄>65岁、治疗前超过2个转移部位[14]、PS>2分[15]可能是HPD的独立危险因子。PSC中KRAS和MET 14外显子跳跃突变比例较高,相关研究表明MET扩增与肿瘤浸润CD8+T细胞相关,提示MET扩增的PSC可能对ICI有高反应[16];而研究[17]显示,KRAS突变不是ICIs疗效的影响因素。本例患者未行全基因监测进而全面了解基因突变状况及粒子植入时未做病理再评估是诊治中的不足之处;同时,提示患者一般状况恶化,有超进展可能时,不推荐继续使用ICI治疗。
综上所述,本例患者首次免疫治疗后超进展明确,患者年龄<65岁、EGFR无突变、MDM2及MET未知,但治疗前转移病灶>2、LIPI评分为差、体力状况恶化、感染提示该患者的不良预后。

