血小板促进肺癌细胞A549增殖与迁移的体外实验研究
郑凤 董星宇 李庆林 朱婷 李白坤
血小板不但在止血和血栓形成中发挥重要作用,而且参与炎症反应和免疫应答。近年来,血小板在肿瘤进展中的作用也日益得到重视;研究发现,肿瘤细胞可释放组织因子、二磷酸腺苷、凝血酶等血小板激活因子,诱导血小板活化和促凝,起到帮助瘤细胞转移的作用。但是,血小板是否具有促进肿瘤细胞增殖的作用,研究结果却不一致;有的研究结果显示血小板能促进瘤细胞增殖[1-2],有的显示抑制增殖[3],还有的显示与增殖无关[4]。导致这种不一致现象的原因比较复杂,瘤细胞种系就是一个重要因素。肺癌(lung cancer)是当前全球范围内最常见的恶性肿瘤,近年来肺癌的发病率和死亡率一直保持在相当高水平;血小板是否促进肺细胞系A549细胞的增殖,尚不十分清楚。本文采用细胞实验研究了血小板对A549细胞增殖作用和迁移力的影响,旨在为进一步的药物干预研究奠定基础。
资料与方法
一、材料
1 细胞株 肺腺癌细胞株A549来自安徽中医药大学科研实验中心。
2 血小板提取相关试剂 ACD抗凝剂(Leagene公司),CGS缓冲液(氯化钠3.6 g、D-葡萄糖3.3 g、柠檬酸三钠2.165 g,试剂溶解于400 mL超纯水,调节PH至6.5,定容至500 mL,现配现用)。
3 细胞培养相关试剂 DMEM培养液(Hyclone公司)、胎牛血清(Biological Industries公司)、胰酶(碧云天公司)、双抗(碧云天公司)、CCK-8(AbMole BioScience公司)、Transwell小室(BD FALCON公司)。
二、实验方法
1 细胞培养 细胞复苏后,培养在含10%胎牛血清的DMEM培养液中(1U/mL双抗),置于37℃、含5%CO2饱和湿度的培养箱内培养,每2天传代1次,取对数生长期细胞用于实验。
2 血小板提取 抽取健康成年志愿者静脉全血10 mL,用枸橼酸(ACD)1 ∶7充分抗凝,水平离心机室温200 g离心20 min,小心抽取上清得到富血小板血浆(PRP),再1000 g离心10 min,弃上清后得到沉淀血小板。CGS缓冲液洗涤血小板,600 g离心5 min,洗涤2次后,预热培养基重悬血小板,计数后制成3.0×108个/mL的血小板悬液。血小板制备后立即进行细胞实验。
3 镜下观察血小板与瘤细胞黏附情况 将贴壁的肿瘤细胞消化,250 g离心5 min,弃去上清,预热培养基重悬,取200 μL细胞悬液移至1.5 mL EP管中,再取200 μL制备好的血小板悬液加入同一EP管中,振荡混匀、封盖,放置37 ℃水浴孵育1 h。反应完成后取出EP管,轻轻摇匀后水平涂片,倒置显微镜下观察血小板粘附肿瘤细胞的形态。
4 CCK-8实验检测细胞增殖力 取对数生长期的A549细胞,0.25%胰酶消化后,用含10%FBS的DMEM吹打制成细胞悬液。按5×103细胞/孔接种于96孔平底培养板,待细胞贴壁后弃去培养基,并进行分组加样:①对照组:DMEM培养液;②Cell+P50组:DMEM培养液,2.5×105个血小板(PLT);③Cell+P100:DMEM培养液,5×105个PLT;④Cell+P200:DMEM培养液,1×106个PLT;⑤Cell+P400:DMEM培养液,2×106个PLT;⑥Cell+P600:DMEM培养液,3×106个PLT;⑦Cell+P800:DMEM培养液,4×106个PLT;另设空白组;每组设3个复孔。各组均设三块板,分别于孵育24、48和72 h后,采用CCK-8实验,测试细胞增殖力。CCK-8实验操作按说明书进行,主要是更换培养基,加CCK-8试剂,避光孵育1h,酶标仪450nm下测定各孔的吸光度值。最后根据说明书提供的公式计算细胞增殖力。
5 Transwell实验检测细胞迁移力 收集适量处于对数生长期的瘤细胞,胰酶消化后无血清培养基重悬细胞,调整细胞浓度为5×104mL-1。设A549细胞组(Transwell小室加入100μL细胞悬液,下室加入600 μL含10%胎牛血清培养基),和A549+PLT组(在A549组的基础上,加2 μl血小板悬液于上室中)。37℃、5%CO2条件下培养过夜。取出小室,弃掉培养基,先用棉签小心擦掉上室内的细胞后用预冷的PBS洗2次,再加入4%多聚甲醛固定30 min,适度风干后用0.1%结晶紫染色20 min,预冷的PBS洗3次。倒置显微镜下选取上下左右中5个视野拍照,计数小室下表面附着的细胞(迁移细胞)数。
三、统计学方法
结 果
一、血小板向瘤细胞聚集
与贴壁后的瘤细胞共孵育1 h后,血小板的分布不再均匀,出现向瘤细胞聚集的现象,即瘤细胞周围的血小板密度明显增高(图1)。

图1 血小板向瘤细胞聚集的现象(×100)
二、血小板促进瘤细胞增殖
不同血小板加入量及共孵育时间对瘤细胞增殖的影响情况(见表1)。由(表1)和(图2)可见,随着血小板加入量的增加,瘤细胞的增殖力总体上呈现上升趋势,其中共孵育48 h者最明显。在共孵育24 h的7组中,组间增殖力差异有统计学意义(F=7.431,P=0.001),且6个加血小板组的瘤细胞增殖力均高于未加血小板组(P<0.05);共孵育48 h(F=7.560,P=0.001)和共孵育72 h(F=17.159,P<0.001)的瘤细胞组间增殖力差异也有统计学意义,除cell+P50组外,其他加血小板组的瘤细胞增殖力均高于未加血小板组(P<0.05)。
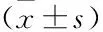
表1 三种共孵育时间下血小板对A549细胞增殖的促进作用
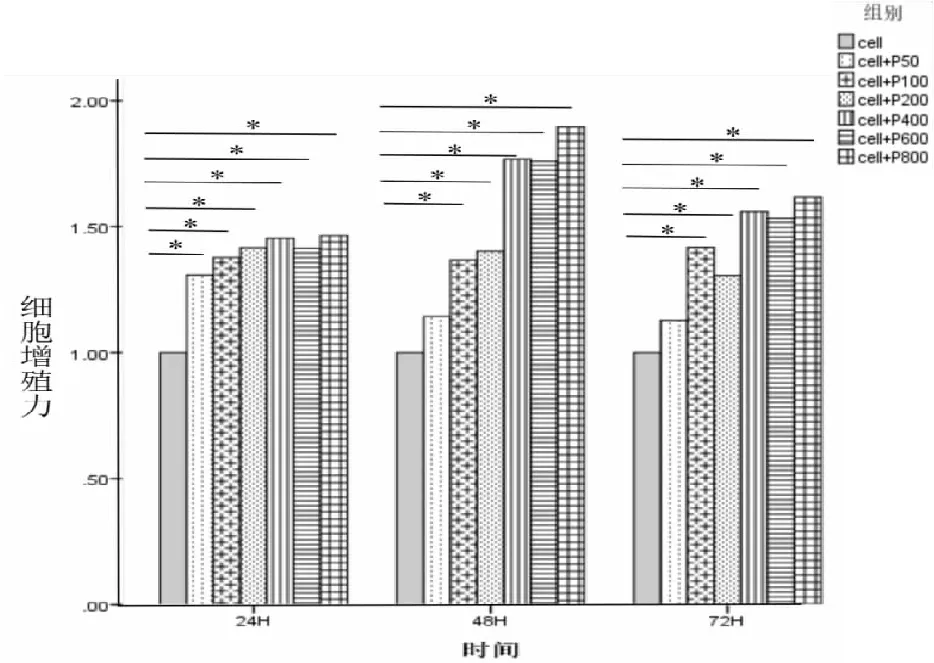
图2 血小板加入量对瘤细胞增殖力的影响(*P<0.05)
由(表1)和(图3)可见,共孵育的时长在也可影响血小板对瘤细胞增殖的促进作用。血小板加入量较少的3个组,三个不同作用时长对瘤细胞增殖的促进作用差异均无统计学意义(P>0.05),而血小板加入量较多的3个组,这种促增殖作用差异有统计学意义(cell+P400组:F=10.750、P=0.010,cell+P600组:F=5.061、P=0.049,cell+P800组:F=8.727、P=0.017),且均表现为共孵育48小数者强于共孵育24小数者(P<0.05)。
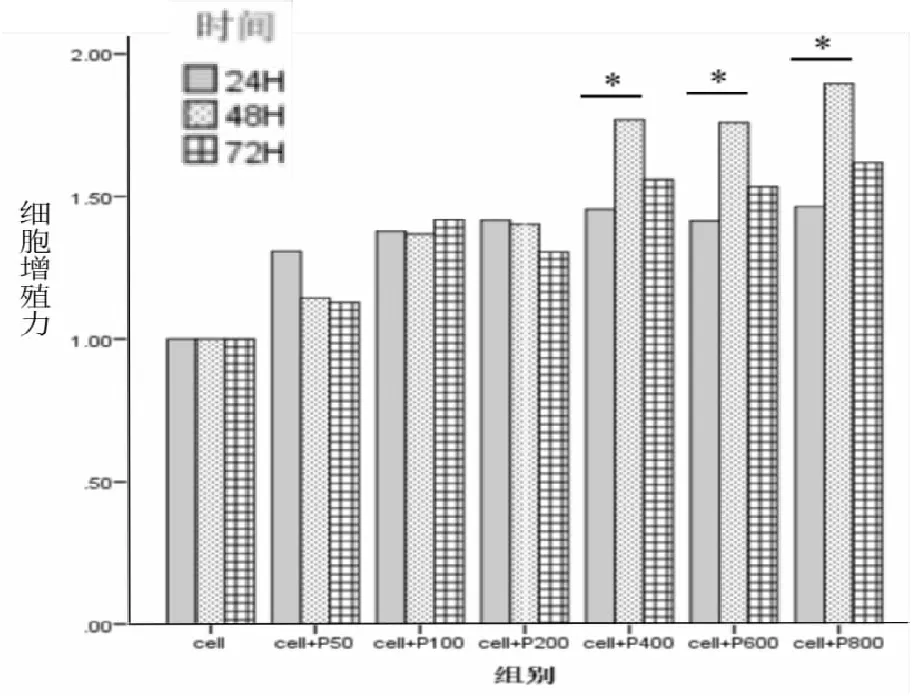
图3 与血小板共孵育时间对瘤细胞增殖力的影响(*P<0.05)
(图4)更清晰地展示了瘤细胞与不同数量血小板共孵育下,其增殖活力逐渐增强的变化趋势;以及同一血小板加入量下,不同共孵育时间瘤细胞增殖活力的变化情况。呈现出血小板加入量少时共孵育时间24 h为佳,加入量多时共孵育时间48小数为佳,不管加入量多少共孵育72 h都不理想的有趣现象。

图4 血小板数量及共孵育时间对A549细胞活力的影响
三、血小板促进瘤细胞迁移
(图5)为Transwell迁移实验的镜下结果,可见与血小板共孵育24 h后的A549细胞,其迁移能力明显高于对照组( 128.6±16.0vs84.4±12.0 ),差异有统计学意义(P<0.05)。

图5 血小板促进A549细胞迁移(×100),*P<0.05
讨 论
肺癌严重危害人类健康,特别是非小细胞肺癌危害更甚[5]。医学的进步在一定程度上改善了肺癌患者的预后,但五年生存率依然不高。探究影响肺癌发生发展的因素,将有利于控制肺癌进展,减轻其所致的健康危害。
许多实验研究结果表明,血小板能直接与瘤细胞相互作用,分泌生物活性蛋白参与肿瘤细胞的增殖和转移。如有研究结果显示,血小板可促进Lewis肺癌细胞的增殖、迁移和侵袭,而采用抗血小板药(替卡格雷)则能抑制Lewis肺癌细胞的增殖、迁移和侵袭,并能诱导血小板凋亡[6]。血小板也可通过上调c-MYC癌蛋白促进结肠癌细胞SW480和胰腺癌细胞PANC-1的增殖,而此增殖能力可被阿司匹林逆转,且存在剂量反应关系[7]。血小板还可通过影响血管生成发挥促进卵巢癌生长的作用[8]。肿瘤患者的血小板也能显著促进肝癌细胞Bel-7402的增殖[9]。
本研究结果提示,血小板可促进肺腺癌A549细胞增殖和迁移力,且随着血小板加入量的增加,其促瘤增殖作用呈现增强趋势。此外,随着与瘤细胞共孵育时间的延长,血小板的促瘤增殖作用呈现先增强再减弱的趋势;可能提示血小板对瘤细胞发挥作用需要一定的时间,但在没有持续血小板补充的情况下,一次加入的血小板难以维持较久的促瘤增殖作用。本研究的结果为血小板促进肿瘤增殖和迁移增加了证据,也为进一步开展体内动物实验和临床干预试验提供了参考数据。
然而,血小板对肿瘤细胞并非总是表现出促增殖的作用。如有报道称,健康人的血小板没有明显的促肝癌细胞Bel-7402增殖作用[9]。也未发现血小板对SW620癌细胞增殖的影响[7]。甚至还有报道血小板可抑制黑色素瘤细胞和前例腺癌细胞[3]、结肠癌细胞[10]的增殖。这些研究结果提示,血小板对肿瘤细胞的增殖有无影响以及是促进或抑制作用,可能与瘤细胞株的种类有关;诚然,隐藏在这种现象背后的具体作用机制还有待进一步研究阐明。
简言之,本研究明确了血小板对肺腺癌A549细胞增殖和迁移的促进作用,提示血小板可能具有作为肺癌治疗潜在靶点的价值,但需要进一步的体内实验和临床试验加以验证。

