有氧运动对肺腺癌吉非替尼获得性耐药的影响
杨洪, 刘怡文, 孔金玉
(1.河南科技大学 体育学院, 河南 洛阳 471000; 2. 河南科技大学 第一附属医院(临床医学院), 肿瘤医院∥河南省微生态与食管癌防治重点实验室∥河南省肿瘤表观遗传重点实验室, 河南 洛阳 471003)
肺癌发病率与死亡率极高,80%为非小细胞肺癌,而肺腺癌为非小细胞肺癌主要的病理类型之一.肺腺癌早期多表现为呼吸系统疾病的一般症状,易被忽略,确诊时多发展至晚期,预后极差[1].随着医学研究的不断发展,靶向治疗逐渐成为一种新的治疗方式,现已证实EGFR的激活突变是肺腺癌的关键驱动因素.以表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKIs)为主的分子靶向治疗为晚期肺腺癌患者开启了“希望之门”[2],但耐药的产生使后续治疗无法进行.因此,探索肺腺癌获得性耐药机制以及寻找延缓耐药产生的方法成为降低肺腺癌死亡率的有效策略.大量团队发表了关于EGFR-TKIs获得性耐药机制的研究成果,其中肿瘤干细胞领域的研究处于蓬勃的上升态势,且已在肺癌中成功分离、富集出了肿瘤干细胞[3-4].
肿瘤干细胞(cancer stem cells,CSCs)是存在于肿瘤中具有高度自我更新和异常分化潜能的一小部分细胞亚群[5].尽管传统的放、化疗对肿瘤有一定的治疗效果,但临床数据显示CSCs对各种治疗均具有抗性,CSCs已被认为是肿瘤耐药、复发和转移的根源[6].肺腺癌获得性耐药的产生可能由于TKIs药物富集了大量CSCs.研究资料已证实乙醛脱氢酶1(acetaldehyde dehydrogenase 1,ALDH1)可作为肺腺癌优选的干细胞标记物[7-8].
近年来,有氧运动已成为肿瘤辅助治疗的新趋势.乳腺癌、结直肠癌及前列腺癌患者治疗后进行有效的有氧运动可显著改善其生活质量,并延长其生存期[9-10],而肥胖、缺乏运动和高代谢综合征的恶性肿瘤患者复发和转移率则显著增加[11],提示有氧运动可作为肿瘤治疗的有效辅助措施.临床资料显示,有氧运动可加速血液循环,改善组织供氧量,减少活性氧(reactive oxygen species, ROS)生成,上调内源性抗氧化酶如超氧化物歧化酶,有利于肿瘤组织中缺氧诱导因子1(hypoxia-inducible factor-1, HIF-1)降解[12-13],从而削弱其对CSCs的维持作用[14].
本研究首先建立吉非替尼诱导的肺腺癌耐药细胞系,然后通过不同强度有氧运动联合吉非替尼干预裸鼠皮下荷瘤,研究有氧运动对肺腺癌吉非替尼获得性耐药的影响,为肺腺癌的临床治疗提供新思路和有效治疗手段.
1 材料与方法
1.1 主要试剂与仪器
人肺腺癌PC-9细胞系(中国博谷生物科技有限公司);吉非替尼(美国Selleck Chemicals公司);CCK-8试剂盒(日本同仁公司);ALDEFLUOR®干细胞检测试剂盒(加拿大Stemcell technologies公司);4~6周龄健康SPF级BALB/C雄性裸鼠,体质量约20 g(中国常州卡文斯实验动物有限公司),动物许可证号:SCXK(苏)2016-0010;PKH67细胞荧光标记试剂盒和ROS检测试剂盒(美国Sigma-Aldrich公司);超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物工程研究所);HIF-1、ALDH1和内参GAPDH抗体(美国abcam公司);二抗和BCA蛋白定量试剂盒(中国康为世纪生物科技有限公司);凋亡检测试剂盒(美国Millipore公司);ECL发光显影液(美国Invitrogen公司).
凝胶成像系统和酶标仪(美国BIO RAD公司Universal Hood II和1681130A);倒置光学显微镜(日本尼康公司ECLIPSE Ti);共聚焦显微镜(德国ZEISS公司LSM 800);小动物活体光学成像系统(美国珀金埃尔默公司IVIS Lumina Series Ⅲ);流式细胞仪(美国贝克曼公司MoFlo XDP);SA101C动物跑台(中国江苏赛昂斯生物科技有限公司SA101A).
1.2 研究方法
1.2.1 建立耐药细胞系PC-9-GR
选择人肺腺癌PC-9细胞系,采用逐步诱导法,建立吉非替尼诱导的耐药细胞系,具体步骤参考文献[15-16],将诱导成功的耐药细胞命名为PC-9-GR.
1.2.2 CCK-8法检测吉非替尼半数抑制浓度(IC50)
96孔板中配制100 μL细胞悬液(每孔103个细胞),加入不同浓度(0.000 1、0.000 2、0.000 3、0.000 5、0.001、0.002、0.003、0.008、0.2、1、3、8、10 μmol/L)的吉非替尼,至培养箱(37 ℃,含体积分数为5%的CO2)培养24 h.向每孔加入10 μL CCK-8溶液,酶标仪测定450 nm处吸光度,比较吉非替尼对不同细胞的24 h半数抑制浓度(IC50),具体步骤参考文献[15-17].实验重复3次.
1.2.3 ROS相关指标检测
(1)试剂盒检测ROS 采用ROS试剂盒检测各组细胞及瘤体中ROS水平,取对照组荧光值为1,其余各组与之比较,得出相对ROS含量,具体步骤参考说明书及文献[15,17].实验重复3次.
(2)试剂盒检测MDA及SOD 取各组细胞培养上清液或裸鼠血清,采用MDA及SOD试剂盒检测各组细胞及裸鼠中MDA含量及SOD活性,具体步骤参考说明书及文献[18-19].实验重复3次.
1.2.4 Western blot 检测蛋白相对表达量
提取新鲜细胞或组织蛋白后,BCA蛋白定量试剂盒检测浓度并定量.每泳道30 μg总蛋白,10% SDS-聚丙烯酰胺凝胶电泳分离,PVDF膜转膜,质量分数为5%的脱脂牛奶封闭1 h,HIF-1、ALDH1和内参GAPDH(按V一抗∶VTBST=1∶1 000稀释)抗体4 ℃孵育过夜.二抗(按V二抗∶VTBST=1∶2 000稀释)孵育2 h,ECL显影液检测目的蛋白条带,凝胶成像系统采集图像,Image Lab软件测定蛋白条带灰度值,以目的蛋白与内参蛋白条带灰度值比值为最终蛋白相对表达量[20].实验重复3次.
1.2.5 流式细胞术检测CSCs百分比
用ALDEFLUORTM检测缓冲液重悬细胞.每个待测样本均设置一个“检测”管(DEAB-)与一个“对照”管(DEAB +),于流式细胞仪检测ALDH1+标记的CSCs百分比,具体步骤参考说明书及文献[15-16],实验重复3次.
1.2.6 裸鼠皮下荷瘤实验
(1)裸鼠准备 48只4~6周龄健康SPF级雄性BALB/C裸鼠,体质量约20 g.动物房温度为(25±2)℃,湿度为 40%~60%,采用自然昼夜照明.饲料、饮水均为SPF级,裸鼠自由进食、饮水.适应性饲养 1周后,随机分为8 组:PC-9-GR组(对照组),PC-9-GR+吉非替尼组(吉非替尼单药组),PC-9-GR+低强度有氧运动组(低强度有氧运动组),PC-9-GR+中强度有氧运动组(中强度有氧运动组),PC-9-GR+高强度有氧运动组(高强度有氧运动组),PC-9-GR+低强度有氧运动+吉非替尼组(低强度有氧运动+吉非替尼组),PC-9-GR+中强度有氧运动+吉非替尼组(中强度有氧运动+吉非替尼组),PC-9-GR+高强度有氧运动+吉非替尼组(高强度有氧运动+吉非替尼组).每组6只,SPF级鼠笼饲养.
(2)细胞准备 将耐药细胞系PC-9-GR由PKH67荧光标记,检测细胞已全部携带荧光.裸鼠皮肤消毒后,于每只裸鼠右侧腋下接种标记后的PC-9-GR细胞5×106个.
(3)吉非替尼用法及用量 成瘤后,每日口腔灌注75 mg/kg吉非替尼,至实验结束.
(4)运动方案 对照组及吉非替尼单药组不做运动训练,其余6组裸鼠在适应性跑台训练5 d(速度1 m/min,坡度0°)后,分别给予不同强度运动训练[21]:低、中及高强度跑台速度分别为4 m/min(58% VO2max)、12 m/min(76% VO2max)、17 m/min(84% VO2max),坡度均为 0°;每次训练前均做10 min热身运动(速度1 m/min,坡度 0°);每天运动1次,每次60 min;每周运动6 d;实验周期为8周(56 d).
(5)样本处理 实验期间由小动物活体成像仪拍摄并检测肿瘤大小.结束后用戊巴比妥钠(50 mg/kg)腹腔注射麻醉裸鼠,颈椎离断法处死,取血清用于测定MDA含量和SOD活性,后将瘤体剥离称重.称重后将瘤体分为两部分:一部分脱水包埋制备为组织切片,采用TUNEL法凋亡试剂盒检测各组裸鼠瘤体内肿瘤细胞凋亡情况(凋亡细胞标记为FITC),具体步骤及计数方法参考说明书及文献[20].另一部分研磨,①采用ROS试剂盒检测各组瘤体内ROS水平;②提取新鲜组织蛋白,通过Western blot法检测各组瘤体内HIF-1及ALDH1蛋白的表达情况;③配制成单细胞悬液,应用ALDEFLUOR®干细胞检测试剂盒,通过流式细胞仪检测各组瘤体内ALDH1+标记的CSCs百分比.以上检测方法均取各组裸鼠均值为本组最终值.
1.3 统计学方法

2 结果
2.1 耐药细胞系与亲本细胞系中ROS相关指标差异
吉非替尼诱导耐药后,与亲本细胞系PC-9相比,耐药细胞系PC-9-GR表现出边界不清、核大、伪足增多等出显著不同的形态结构(图1A).CCK8法检测PC-9与PC-9-GR的吉非替尼药物IC50的结果显示: PC-9-GR的吉非替尼药物IC50显著高于PC-9,具有统计学差异(P<0.05,图1B),成功建立吉非替尼诱导的肺腺癌耐药细胞系PC-9-GR.采用试剂盒检测两组细胞系中ROS与MDA含量及SOD活性,结果显示:与PC-9相比,PC-9-GR中ROS与MDA含量显著增加,而SOD活性则显著降低,具有统计学差异(P<0.05,图1C、D与E).
2.2 耐药细胞系与亲本细胞系中HIF-1与ALDH1蛋白及CSCs百分比差异
提取亲本细胞系PC-9与耐药细胞系PC-9-GR蛋白,采用Western blot法检测HIF-1与ALDH1蛋白的表达情况,结果显示:与PC-9相比,PC-9-GR中HIF-1与ALDH1蛋白表达量均显著增高,具有统计学差异(P<0.05,图2A-C),且HIF-1增高时,ALDH1表达量随之增高;应用ALDEFLUOR®干细胞检测试剂盒,通过流式细胞术检测两组细胞系中ALDH1+标记的CSCs百分比(图2D),结果显示:PC-9-GR中ALDH1+标记的CSCs百分比显著高于PC-9,具有统计学差异(P<0.05,图2E).
2.3 不同强度有氧运动对PC-9-GR获得性耐药的影响
活体成像(图3A、B)、瘤体质量(图3C)及瘤体内凋亡细胞(图3D、E)检测结果均显示:①与对照组相比,吉非替尼单药组成瘤能力及抗凋亡能力无明显差异,而低、中及高强度有氧运动组成瘤能力及抗凋亡能力逐渐降低,但仅高强度有氧运动组降低显著(P<0.05);②与吉非替尼单药组相比,低、中及高强度有氧运动联合吉非替尼组成瘤能力及抗凋亡能力逐渐显著降低(P<0.05),具有强度依赖性,即随运动强度增加,降低逐渐显著;③与不同强度有氧运动组相比,不同强度有氧运动联合吉非替尼组成瘤能力及抗凋亡能力均显著降低(P<0.05).

A: 吉非替尼诱导对PC-9细胞形态的改变(400);B: 吉非替尼的剂量反应曲线;C: PC-9与PC-9-GR细胞中ROS含量差异;D: PC-9与PC-9-GR细胞中MDA含量差异;E: PC-9与PC-9-GR细胞中SOD活性差异. 1) 与PC-9组比较,P<0.05.

A: Western blot法检测PC-9与PC-9-GR细胞中HIF-1与ALDH1蛋白的表达情况;B: PC-9与PC-9-GR细胞中HIF-1蛋白表达差异;C: PC-9与PC-9-GR细胞中ALDH1蛋白表达差异;D: 流式细胞术检测PC-9与PC-9-GR细胞中ALDH1+标记的CSCs百分比;E: PC-9与PC-9-GR细胞中ALDH1+标记的CSCs百分比差异. 1) 与PC-9组比较,P<0.05.
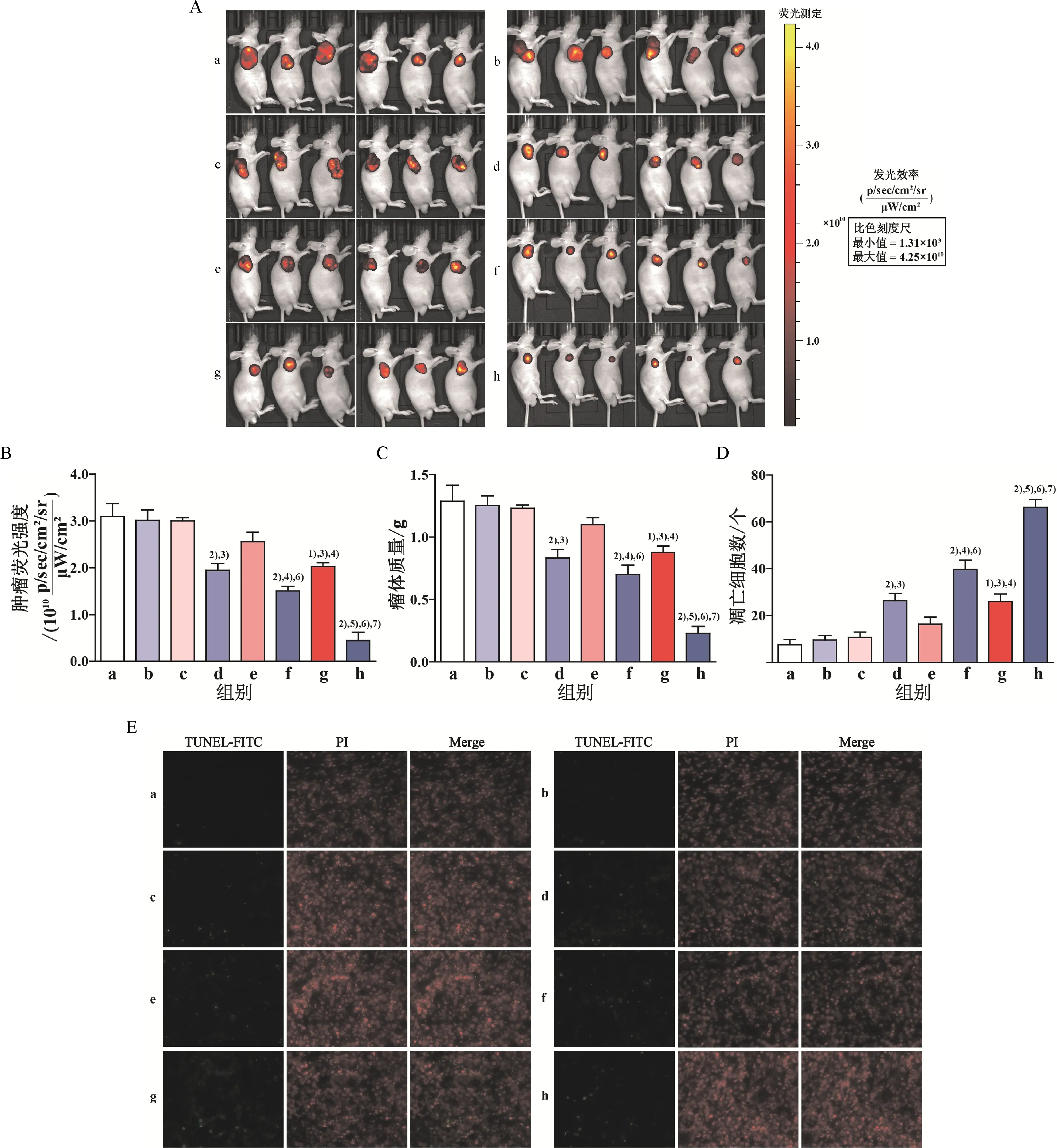
A: 对照组;b: 吉非替尼单药组;c: 低强度有氧运动组;d: 低强度有氧运动+吉非替尼组;e: 中强度有氧运动组;f: 中强度有氧运动+吉非替尼组;g: 高强度有氧运动组;h: 高强度有氧运动+吉非替尼组. A: 活体成像检测各组裸鼠瘤体大小及荧光强度;B: 各组裸鼠瘤体大小及荧光强度差异;C: 各组裸鼠瘤体质量差异;D: 各组裸鼠瘤体内凋亡细胞差异;E: 凋亡试剂盒检测各组裸鼠瘤体内凋亡细胞(200). 1) 与对照组比较,P<0.05;2) 与吉非替尼单药组比较,P<0.05;3) 与低强度有氧运动组比较,P<0.05;4) 与中强度有氧运动组比较,P<0.05;5) 与高强度有氧运动组比较,P<0.05;6) 与低强度有氧运动+吉非替尼组比较,P<0.05;7) 与中强度有氧运动+吉非替尼组比较,P<0.05.
2.4 各组裸鼠HIF-1与ALDH1蛋白、CSCs百分比及差异
ROS相关指标(图4A、B与C)、HIF-1与ALDH1蛋白(图4D、E与F)及CSCs百分比(图4G与H)检测结果显示:①与对照组相比,吉非替尼单药组无明显差异,而低、中及高强度有氧运动组ROS与MDA含量逐渐显著降低(P<0.05),SOD活性逐渐显著增强(P<0.05),且HIF-1与ALDH1蛋白及CSCs百分比逐渐显著降低(P<0.05),具有强度依赖性;②与吉非替尼单药组相比,低、中及高强度有氧运动联合吉非替尼组ROS与MDA含量逐渐显著降低(P<0.05),SOD活性逐渐显著增强(P<0.05),且HIF-1与ALDH1蛋白及CSCs百分比逐渐显著降低(P<0.05),具有强度依赖性;③与不同强度有氧运动组相比,不同强度有氧运动联合吉非替尼组均无显著差异.
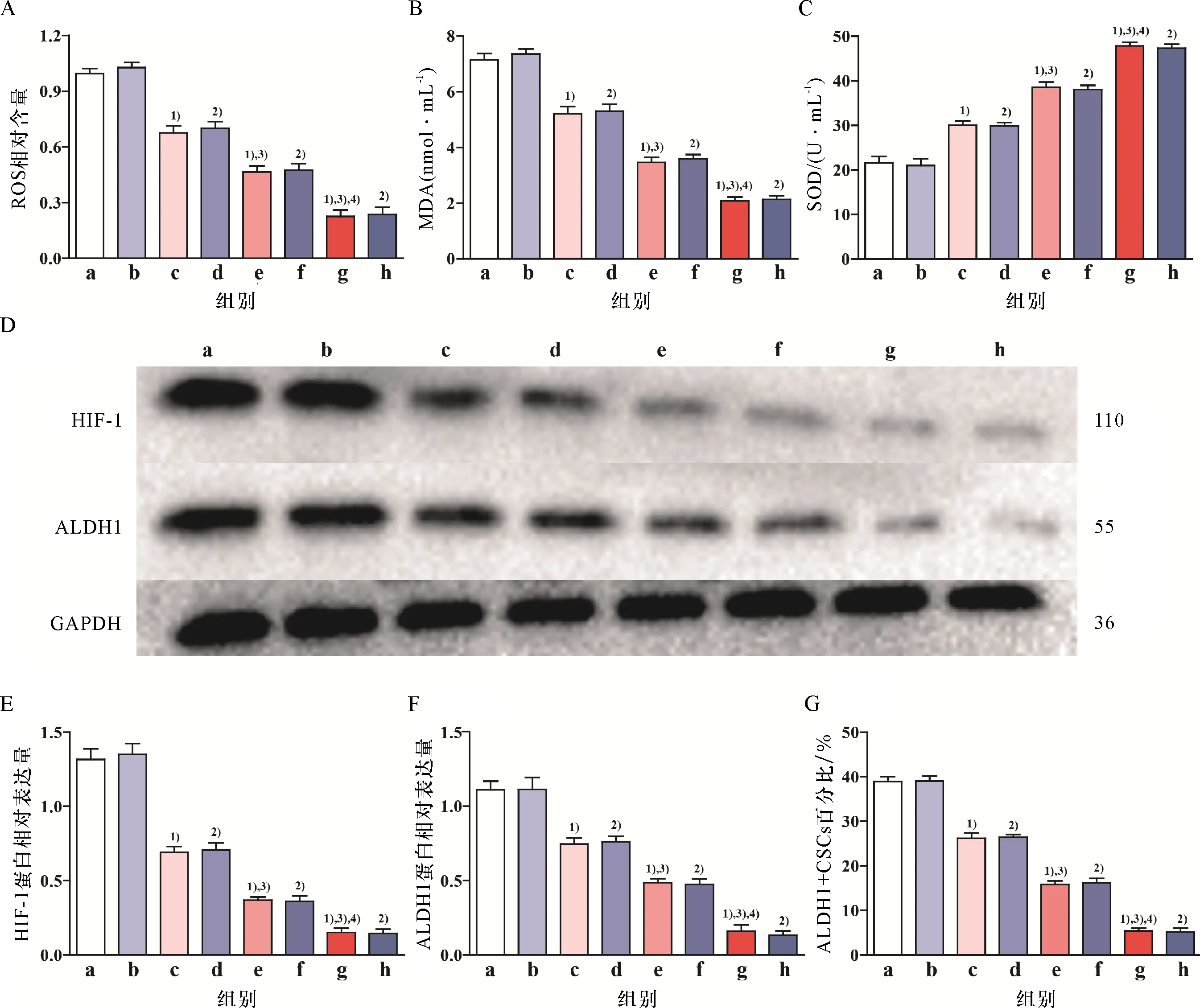
(续上图)
3 讨论
EGFR优势突变的肺腺癌患者对TKIs药物反应良好,但易产生耐药[2].研究表明,目前的治疗手段主要针对已分化的细胞,而不是CSCs,恰恰这些数量极少的CSCs决定了恶性肿瘤的发生、侵袭、转移及对治疗的敏感性[5-6].CSCs的检测与分选已成为肿瘤治疗的关键.ALDH1是一种将醛类氧化成羧酸类的依赖NAD(P)+的酶,具有高度氧化活性,参与基因表达、组织分化和维持内环境稳定等功能[7-8].2007年Ginestier等[22]发现 ALDH1 是乳腺癌干细胞的标志物,揭开了 ALDH1 在CSCs领域研究的篇章.此后,陆续研究证实了ALDH1是包括肺腺癌在内的多种肿瘤的CSCs标志物,且其高表达与患者临床预后密切相关[23-25].目前,研究团队已利用荧光染料Aldefluor,根据ALDH1在细胞中的不同荧光强度,检测分选出CSCs.
CSCs异常增殖和分化的潜能与其所处的微环境密切相关.肿瘤细胞生长迅速及中心血供不足导致的缺氧是肿瘤微环境的特性之一.肿瘤细胞缺氧时,氧化磷酸化代谢途径受阻,线粒体内膜电子呼吸链传递异常,导致ROS增多,不能被及时清除,即造成氧化应激.MDA 作为脂质过氧化产物,可反应细胞受ROS攻击的严重程度,同时SOD作为关键抗氧化酶,其活性反映了细胞清除氧自由基的能力[14].肿瘤细胞为适应缺氧环境,满足自身迅速生长的能量需求,其代谢过程重塑,主要通过大量ROS抑制脯氨酸羟化酶活性,阻断其对HIF-1的降解,导致HIF-1异常活化,从而调节相关靶基因及各种细胞信号通路以耐受缺氧,最终引起肿瘤细胞干性增强及放化疗抵抗[26-27].本研究发现,与亲本细胞系相比,耐药细胞系PC-9-GR中ROS与MDA含量显著增加,而SOD活性显著降低,且HIF-1、ALDH1蛋白与CSCs百分比均显著增高,提示吉非替尼长期诱导可使肺腺癌细胞氧化应激水平增强,抗氧化能力减弱,激活HIF-1,引起ALDH1蛋白高表达,导致ALDH1+标记的CSCs大量富集,这可能是肺腺癌吉非替尼获得性耐药产生的重要原因之一.
资料显示,有氧运动可使ROS生成减少,上调内源性抗氧化酶如线粒体超氧化物歧化酶,加速HIF-1降解[12];同时,有氧运动可抑制HIF-1反应基因,调节多个信号通路,抑制肿瘤细胞干性[13],与本研究结果一致.本研究裸鼠皮下荷瘤实验中:(1)与对照组相比,①吉非替尼单药组成瘤能力、抗凋亡能力及裸鼠血清或瘤体内ROS相关指标、HIF-1与ALDH1蛋白及CSCs百分比无明显差异,提示耐药细胞系PC-9-GR由于ROS大量富集,氧化应激水平增强,抗氧化能力减弱,HIF-1高度活化,引起ALDH1蛋白过表达,导致ALDH1+标记的CSCs大量富集,对吉非替尼不再敏感;②低、中及高强度有氧运动组成瘤能力及抗凋亡能力逐渐降低,同时裸鼠血清或瘤体内ROS与MDA含量逐渐显著降低,SOD活性逐渐显著增强,且HIF-1、ALDH1蛋白及CSCs百分比均逐渐显著降低,具有强度依赖性,提示随运动强度增加,有氧运动对ROS的抑制和对抗氧化酶的激活逐渐增强,引起HIF-1与ALDH1蛋白及CSCs逐渐减少,导致肿瘤增殖逐渐受到抑制.(2)与吉非替尼单药组相比,低、中及高强度有氧运动联合吉非替尼组成瘤能力、抗凋亡能力及裸鼠血清或瘤体内ROS与MDA含量逐渐显著降低,而SOD活性逐渐显著增强,且 HIF-1、ALDH1蛋白及CSCs百分比逐渐显著降低,具有强度依赖性,提示在吉非替尼耐药的情况下,进行有效的有氧运动,可通过降低氧化应激水平,增强抗氧化能力,引起HIF-1、ALDH1蛋白及CSCs减少,从而使肿瘤细胞重新对吉非替尼敏感,最终抑制肿瘤的恶性增殖,且该作用与运动强度呈显著正相关.(3)与不同强度有氧运动组相比,不同强度有氧运动联合吉非替尼组裸鼠ROS相关指标、HIF-1与ALDH1蛋白及CSCs百分比无显著差异,而成瘤能力及抗凋亡能力均显著降低,提示有氧运动需联合吉非替尼,才能更有效的抑制肿瘤恶性增殖.
综上所述,有氧运动对氧化应激的抑制作用有助于增强耐药细胞对吉非替尼的应答效力,可作为肺腺癌治疗中的有效辅助措施.由于疾病的多样性和复杂性,有氧运动在肺腺癌中的调控机制有待进一步探讨,但进行合理有效的有氧运动,对患者的临床治疗具有非常重要的意义.
作者贡献声明
杨洪:提出研究思路和框架,修改论文;刘怡文:设计实验,撰写论文;孔金玉:整理结果,统计分析数据.
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突.

