神经鞘磷脂合成酶2与阿霉素致乳腺癌细胞线粒体损伤的相关性
冯海湛, 游紫聪, 翁俊彦, 梁佩乔, 史福军
(南方医科大学 珠江医院 普通外科中心 乳腺外科, 广东 广州 510280)
乳腺癌是全球女性最常见的恶性肿瘤,在女性癌症中死亡率排名第一,严重影响女性身心健康[1-2].化疗是乳腺癌的主要治疗方法之一,对于局部晚期或转移性乳腺癌患者尤其如此.阿霉素(adriamycin,ADR)作为乳腺癌常用的临床一线化疗药物,在癌症的治疗中起到重要作用,但部分患者在接受化疗后,癌细胞会产生一定抗药性,从而导致难治性乳腺癌和肿瘤复发[3-4].癌细胞耐药的相关机制错综复杂,至今尚未完全阐明.因此,探索研究乳腺癌细胞对ADR耐药的分子机制,对于临床诊疗活动中指导用药及预测患者预后具有积极意义,并有助于开发逆转癌症抗药性的新策略.
神经鞘磷脂合成酶2(sphingomyelin synthase 2,SMS2)以神经酰胺(ceramide,Cer)和卵磷脂为底物,催化合成鞘磷脂(sphingomyelin,SM)和甘油二酯,是催化该合成反应的关键酶,调控细胞内Cer和SM的水平,进而影响细胞的生物学行为[5].神经酰胺具有多种细胞学作用,影响细胞的增殖、细胞间粘连、迁移、衰老和细胞凋亡等[6-7].有研究提出SMS2与乳腺癌的发生发展具有一定相关性,可通过Cer相关途径抑制细胞凋亡[8].线粒体作为细胞的能量源,代表着细胞内重要的信号传递中心,是癌症发生发展的主要决定因素之一.线粒体在许多刺激触发的细胞凋亡中起主要作用,越来越多的证据表明线粒体功能障碍在癌症进展和化学耐药中发挥重要作用[9].线粒体是许多促凋亡信号转导分子的靶标,其中包括神经酰胺.神经酰胺和线粒体在调节细胞凋亡方面存在密切的相互作用,而癌细胞凋亡减少可促进其获得耐药性,因此SMS2可能通过Cer调节线粒体的凋亡程序,改变乳腺癌细胞对ADR的药物反应.
目前SMS2的相关研究主要集中于心脑血管方面,其对于乳腺癌细胞线粒体功能的影响尚不明确.本研究拟采用乳腺癌MCF-7细胞,研究SMS2过表达后,MCF-7细胞线粒体对ADR作用效果的相关改变,探索SMS2与乳腺癌细胞线粒体损伤的相关性,为乳腺癌细胞的ADR耐药提供新的思路及理论依据.
1 材料和方法
1.1 材料
人乳腺癌MCF-7细胞株购自中科院细胞库(上海);SMS2过表达慢病毒购自上海吉凯有限公司;胎牛血清、DMEM细胞培养基购自 Gibco;ATP检测试剂盒、线粒体分离试剂盒购自北京索莱宝科技有限公司;CCK-8细胞增殖/毒性检测试剂盒购自东仁化学科技(上海)有限公司;MitoSOX试剂、BCA蛋白质定量试剂盒购自凯基生物技术有限公司;SMS2抗体购自BIOSS;GAPDH、细胞色素C、COX IV抗体均购自Proteintech;ADR购自瀚晖制药有限公司.
1.2 实验方法
1.2.1 细胞培养及构建SMS2过表达细胞
MCF-7细胞用含质量分数为10%胎牛血清的DMEM培养基培养,于37 ℃、5% CO2培养箱内培养.
取对数生长期的MCF-7细胞,消化后接种于6孔板中.待细胞密度生长至75%后,分别加入SMS2过表达慢病毒和对照病毒的稀释液,同时加入Polybrene工作液促进病毒感染效率,12 h后6孔板换液,24 h后用嘌呤霉素(5 μg/mL)进行筛选,连续作用5 d,收集细胞检测SGMS2过表达效率,将构建成功的细胞进行扩大培养.
1.2.2 Western blot法检测MCF-7细胞蛋白表达水平
取对数生长期的MCF-7细胞,消化后接种于6孔板中.待细胞密度生长至80%时,加入1 mL PBS后轻刮下贴壁细胞,加入总蛋白裂解液冰上裂解30 min,离心收集上清液;总蛋白样品和5×上样缓冲液混匀,99 ℃煮沸5 min蛋白变性;制备10%分离胶和4%压缩胶,30 μg总蛋白加样器上样,压缩胶90 V电泳50 min,分离胶120 V电泳80 min;以0.45 μm的PVDF膜200 mA电流转膜60 min;置于质量分数为5%脱脂奶粉PBS-T封闭液中封闭1 h;加入一抗(V一抗∶V抗体稀释液=1∶1 000),4 ℃孵育过夜;加入二抗(V二抗∶V抗体稀释液=1∶5 000),室温孵育60 min;ECL高敏显影液显影,成像分析系统拍照分析.
1.2.3 CCK-8法检测ADR对MCF-7细胞的抑制率
取对数生长期的MCF-7细胞,消化后离心并制成细胞悬液,调整细胞数为1×105个/mL.取96孔板,每孔加入100 μL的细胞悬液,24 h后待细胞贴壁,吸去培养基,并分别加入含不同浓度ADR(0、0.5、1、2、4、6 μmol/L)的培养基,每个浓度设5个复孔,并设空白对照孔.37 ℃、5% CO2培养箱内分别孵育24 h.吸去培养基,避光条件下每孔加入100 μL配置好的CCK-8检测试剂,培养箱中避光孵育1 h,在450 nm波长处测得各孔的光密度D(450 nm).计算不同浓度ADR作用后细胞的抑制率:抑制率(%)=[1-D(450 nm)不同浓度ADR/D(450 nm)空白对照]×100,并绘制药物浓度-抑制率曲线,计算IC50值.选取含有适当浓度ADR的培养液处理细胞24 h作为后续实验的药物处理条件.
1.2.4 MitoSox检测线粒体ROS
取处于对数生长期的MCF-7细胞,消化后接种于6孔板中.待细胞密度生长至80%时,加入适当浓度ADR药物处理24 h后,PBS缓冲液洗涤两遍,加入2 mL的5 μmol/L MitoSOX工作液覆盖细胞培养板中的贴壁细胞,于37 ℃温箱避光孵育10 min.用温的PBS缓冲液轻轻清洗细胞3次,于荧光显微镜下观察.
1.2.5 细胞内ATP水平检测
取对数生长期的MCF-7细胞,消化后接种于6孔板中.待细胞密度生长至80%时,加入适当浓度ADR药物处理24 h后,PBS缓冲液洗涤两遍,6孔板每孔加入200 μL裂解液,裂解细胞,裂解后4 ℃ 12 000g离心5 min,取上清,用于后续的测定;根据试剂盒说明书配置标准ATP标准品、ATP检测工作液;每个检测孔加入100 μL ATP检测工作液,室温放置3~5 min,在每个检测孔加入20 μL样品或者标准品,迅速用微量移液器混匀,至少间隔2 s后,使用Luminometer仪器检测.
1.2.6 电镜观察线粒体形态
收集经过适当浓度ADR药物处理24 h后的MCF-7细胞,先用2.5%的戊二醛固定,后采用2%锇酸再次固定.样品脱水,浸润,包埋;超薄切片(80 nm),采用FEI Tecnai G2电子显微镜(×20 000)观察.
1.2.7 细胞色素C释放实验
使用索莱宝线粒体提取试剂盒,按照说明书操作分离线粒体和细胞质,并充分裂解,分离线粒体及细胞质蛋白,进行Western blot实验,观察细胞色素C在线粒体和细胞质中的表达变化.
1.3 统计学分析
每组实验重复3次,取均值.本次实验数据均用采用IBM SPSS 19.0软件进行数据分析;两组间资料比较采用t检验和单因素方差分析,配对资料采用配对样本t检验.以P<0.05表示差异具有统计学意义.
2 结果
2.1 构建并验证稳定过表达SMS2的MCF-7细胞株
使用慢病毒LV-SMS2和对照病毒LV-NC分别感染MCF-7细胞,使用嘌呤霉素进行筛选,通过荧光显微镜观察、Western blot验证SMS2的过表达.结果表明慢病毒感染细胞稳定显现绿色荧光,SMS2过表达组的SMS2蛋白表达水高于对照组(图1),提示稳定性过表达SMS2的MCF-7细胞株构建成功.

A:荧光显微镜观察用慢病毒-SMS2组或慢病毒-对照组感染MCF-7细胞的效率;绿色荧光表示细胞已感染;B:蛋白质免疫印迹实验检测MCF-7细胞内SMS2的表达水平;C:MCF-7细胞内SMS2的相对表达量,以GAPDH为参照蛋白. 1)与对照组比较,P<0.05.
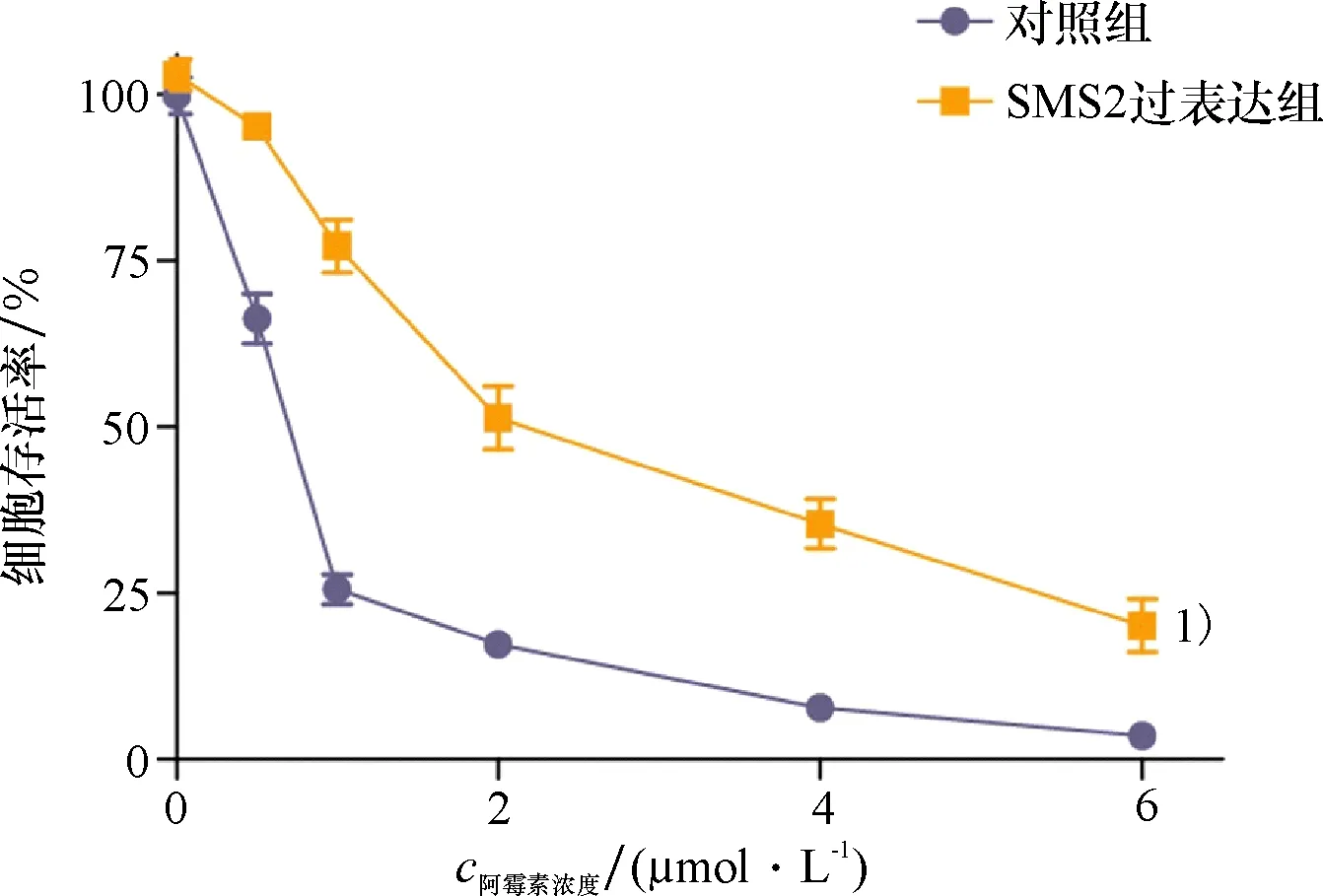
2.2 SMS2过表达致MCF-7细胞对ADR药物抗性的变化
使用CCK-8法检测SMS2过表达的MCF-7细胞对ADR药物敏感性的改变,以选取适当浓度的药物进行后续实验的药物处理.结果发现,ADR对SMS2过表达的MCF-7细胞的IC50值为(2.42±0.073)μmol/L,而ADR对对照组MCF-7细胞的IC50值为(0.62±0.036)μmol/L(P<0.01,图2).因此,在后续的实验条件中选取含有2 μmol/L ADR的细胞培养基,培养MCF-7细胞24 h后进行药物处理,以观察细胞对药物的相关反应.此外,该结果表明SMS2过表达后,MCF-7细胞对ADR的IC50值较对照组增加,对ADR药物抗性增强.
2.3 SMS2过表达对ADR致MCF-7细胞内线粒体ROS水平改变的影响
含有2 μmol/L ADR的细胞培养基分别培养SMS2过表达组和对照组的MCF-7细胞24 h后,使用MitoSOX试剂染色并通过荧光显微镜观察检测线粒体内ROS水平的改变.结果发现,经ADR药物处理后,SMS2过表达组的MCF-7细胞内红色荧光强度较对照组减弱(图3),提示SMS2过表达可降低细胞线粒体的ROS水平.
1)与对照组比较,P<0.01.

蓝色荧光为DAPI染色的细胞核,红色荧光提示细胞内ROS水平.
2.4 SMS2过表达对ADR致MCF-7细胞内ATP浓度改变的影响
含有2 μmol/L ADR的细胞培养基分别培养SMS2过表达组和对照组的MCF-7细胞24 h后,通过ATP检测试剂盒检测细胞内ATP浓度的改变.结果发现,经ADR药物处理后,SMS2过表达组的MCF-7细胞内ATP浓度比对照组细胞增加(P<0.01,图4).

1)与对照组比较,P<0.01.
2.5 SMS2过表达对ADR致MCF-7细胞线粒体超微结构损伤的影响
含有2 μmol/L ADR的细胞培养基分别培养SMS2过表达组和对照组的MCF-7细胞24 h后,收集细胞进行透射电镜(×20 000)观察.由于ADR的毒性作用,细胞出现线粒体超微结构损伤,表现为线粒体肿胀,嵴断裂或消失,基质变淡、透明,基质内多个局灶性空泡等异常现象.与对照组相比,SMS2过表达组的MCF-7细胞中线粒体超微结构损伤较轻(图5).
2.6 SMS2过表达对ADR致MCF-7细胞内线粒体细胞色素C释放及细胞凋亡的影响
含有2 μmol/L ADR的细胞培养基分别培养SMS2过表达组和对照组的MCF-7细胞24 h后,使用线粒体分离试剂盒分离并提取线粒体蛋白和胞质蛋白,Western blot法检测细胞色素C的释放水平.线粒体内参蛋白选取COX-IV,胞质内参蛋白选取β-actin.结果发现在ADR药物处理后,与对照组相比,SMS2过表达组的MCF-7细胞线粒体内细胞色素C含量增加,胞质中细胞色素C含量减少(图6A、B);提示SMS2抑制线粒体细胞色素C的释放.
含有2 μmol/L ADR的细胞培养基分别培养SMS2过表达组和对照组MCF-7细胞24 h后,Western blot法检测细胞内凋亡相关蛋白Cleaved-PARP、Cleaved-Caspase3、Bcl-2、Bax的表达水平.结果发现,ADR药物处理后,SMS2过表达组MCF-7细胞的促凋亡蛋白Cleaved-PARP、Cleaved-Caspase3、Bax表达较对照组减少,抗凋亡蛋白Bcl-2表达较对照组增加(图6C、D);提示SMS2可抑制细胞凋亡.

N代表细胞核,箭头所指为线粒体.N stands for the nucleus, and the arrow showed a mitochondrion.

A:蛋白质免疫印迹实验检测线粒体和胞质内细胞色素C的含量;B:线粒体及胞质内细胞色素C的相对表达量,分别以COX-IV、β-actin为参照蛋白;C:蛋白质免疫印迹实验检测细胞凋亡相关蛋白的含量;D:凋亡相关蛋白的相对表达量,以GAPDH为参照蛋白.1)与对照组比较,P<0.05;2)与对照组比较,P<0.01.
3 讨论
我国是乳腺癌多发的国家,其发病率及死亡率均呈上升趋势,目前乳腺癌主要的治疗策略是手术与辅助治疗相结合.作为临床常规使用的一线化疗药物,ADR可抑制细胞DNA和RNA的合成,并诱导不可逆的线粒体损伤毒性,引发严重而广泛的细胞损伤[10].乳腺癌细胞的耐药性会导致治疗失败和癌症相关死亡,但目前乳腺癌细胞耐药的相关机制尚未明确.本研究通过构建稳定SMS2过表达的乳腺癌MCF-7细胞,ADR诱导细胞损伤后,探讨SMS2过表达对MCF-7细胞的ADR毒性反应的相关影响.SMS2过表达后,MCF-7细胞对ADR的药物抗性增强,这提示SMS2与ADR所致的细胞损伤存在一定相关性.通过检测线粒体ROS水平和细胞内ATP含量以评估线粒体的功能性损伤程度,通过电镜观察线粒体超微结构改变,发现SMS2过表达可以减轻ADR对MCF-7细胞线粒体功能性及结构性的损伤作用.凋亡的一个标志是胱天蛋白酶的激活,而线粒体中细胞色素C的释放是胱天蛋白酶激活的关键步骤[11].应用Western blot检测线粒体细胞色素C释放水平及凋亡相关蛋白表达水平,发现SMS2过表达可以抑制线粒体细胞色素C的释放,抑制ADR诱导的细胞凋亡.因此,SMS2过表达可以减轻ADR对MCF-7细胞的线粒体损伤作用,抑制细胞凋亡,从而促进细胞存活,最终可能导致细胞耐药.
脂类代谢在肿瘤的发生发展中具有重要作用,神经酰胺触发多种肿瘤抑制和抗增殖细胞程序,例如激活凋亡或抑制增殖关键效应分子,导致自噬、衰老和坏死.癌症中神经酰胺生成和代谢的缺陷有助于肿瘤细胞存活和对化疗药物的耐药抗性.化疗药物可以诱导神经酰胺的内源性累积,促进癌细胞凋亡,已有证据表明脂质代谢的调节可能可有效改善肿瘤细胞对抗肿瘤药的敏感性[12-13].SMS2的主要功能是以神经酰胺为底物催化合成神经鞘磷脂,同时,神经鞘磷脂可以被鞘磷脂分解酶分解,重新生成神经酰胺.SMS2作为调控细胞内神经酰胺的关键酶之一,其表达量或者酶活性的改变可以直接影响胞内神经酰胺的含量,进而影响相应的下游生物学反应.神经酰胺在细胞凋亡信号通路中起着重要的第二信使作用.有研究提出改变SMS活性可以调节细胞内Cer的含量,进而调节肿瘤细胞的凋亡水平[14].抑制SMS2可导致神经酰胺的累积和鞘磷脂的增加,从而诱导线粒体功能障碍和氧化应激[15].有研究提出,SMS2与乳腺癌转移相关,SMS2可通过Cer相关通路抑制乳腺癌细胞凋亡从而提高肿瘤细胞增殖能力[8].
线粒体是内源性ROS产生的主要部位,线粒体和ROS参与决定细胞对内环境稳态破坏反应的多个信号途径[16].在正常的生理条件下,细胞存在协调良好且平衡的氧化还原系统;在存在重大压力的情况下,例如化学疗法和放射线,ROS应力会增加而破坏氧化还原平衡,导致癌细胞死亡[17-18].但不少研究提出ROS对于癌细胞的发生发展是一把“双刃剑”[19-20].有研究发现肺腺癌中线粒体的形态和功能异常及ROS水平升高与耐吉非替尼的H1650克隆相关[21].本研究结果表明,ADR处理后,SMS2过表达的MCF-7细胞产生的线粒体ROS较对照组减少,提示SMS2可能通过神经酰胺减少线粒体ROS的产生,维护氧化还原稳态,保护细胞存活. 而Kogot-Levin等[22]也提出,神经酰胺可抑制线粒体呼吸链活性,诱导ROS产生和氧化应激,破坏线粒体膜电位,诱导线粒体外膜通透性改变并导致细胞凋亡.有研究认为,线粒体可以作为癌症治疗的靶点之一[23].
凋亡是细胞的主动死亡过程,在细胞的发育和疾病的发生中具有重要作用[24].线粒体是细胞死亡途径的整合者和执行者,在调控细胞凋亡中发挥关键作用[25].神经酰胺可通过激活Bcl-2家族的促凋亡成员引发线粒体外膜通透性改变,线粒体间膜蛋白细胞色素C释放至胞质,激活胱天蛋白酶,进而引发细胞凋亡[26].本研究发现,经ADR处理后,SMS2过表达的MCF-7细胞线粒体损伤减轻,线粒体释放至胞质中的细胞色素C含量减少,同时促凋亡蛋白Cleaved-PARP、Cleaved-Caspase3、Bax的表达减少,抑制凋亡蛋白Bcl-2表达增加;这提示SMS2过表达后,可以通过减轻ADR对MCF-7细胞的线粒体损伤,抑制细胞凋亡,进而促进癌细胞存活,最终增强细胞对ADR的耐药性.
综上所述,SMS2的过表达可以减轻化疗药物ADR对乳腺癌细胞MCF-7线粒体功能性及结构性的损伤作用,减少线粒体ROS的产生,提高细胞ATP含量;同时减少细胞色素C的释放,抑制细胞凋亡,促进细胞在化疗毒性作用后的存活,最终导致癌细胞获取耐药性;这可能与SMS2减少细胞内的神经酰胺含量相关.越来越多的研究报道脂质代谢与癌症的发生发展具有密切关系,靶向脂质代谢是一个有发展前途的治疗策略[27].本研究认为,SMS2可通过调节神经酰胺水平进而影响乳腺癌细胞的ADR耐药性,这可以为癌症耐药研究提供新的思路方向,SMS2可能成为乳腺癌耐药研究中具有潜力的作用靶点.
作者贡献声明
冯海湛:提出研究思路和框架,设计并实施实验方案;游紫聪:构建稳定过表达SMS2的乳腺癌MCF-7细胞株;翁俊彦:细胞培养;梁佩乔:细胞内ATP水平检测;史福军:统计分析数据,撰写并修改论文.
利益冲突声明
本研究未受到企业、公司等第三方资助,不存在潜在利益冲突.

