伊沙佐米联合地塞米松治疗难治复发轻链型淀粉样变性的临床观察
徐维玮 郭锦洲 任贵生 赵 亮 陈文萃 刘志红 黄湘华
目前以硼替佐米为主的第一代蛋白酶体抑制剂是暂无法行自体外周血干细胞移植(ASCT)的系统性轻链(AL)型淀粉样变性的首选治疗方案[12]。硼替佐米需静脉或皮下注射给药,且神经毒性发生率高达30%~60%,因周围神经病变停药的比例为18%~30%[3-4]。第二代蛋白酶体抑制剂伊沙佐米,为口服制剂,其对蛋白酶体胰凝乳蛋白酶β5亚单位的高选择性和高抑制活性与硼替佐米相似[5]。研究表明,伊沙佐米联合地塞米松或伊沙佐米联合来那度胺及地塞米松对初治及复发难治、干细胞移植后的多发性骨髓瘤(MM)具有可靠疗效,且耐受性[6-7]。但目前关于伊沙佐米治疗AL型淀粉样变性的研究较少[8],国内缺少相关研究。本文观察18例难治复发的AL型淀粉样变性患者使用伊沙佐米联合地塞米松(ID)方案的疗效及安全性。
对象和方法
研究对象本研究纳入2018年7月至2020年9月间在国家肾脏疾病临床医学研究中心使用ID方案的难治性(16例)和复发性(2例)AL型淀粉样变性患者,共18例。复发和难治性AL型淀粉样变性均参照《系统性淀粉样变性诊断和治疗指南(2021年修订)》诊断标准。
治疗方案所有患者均接受ID方案治疗,标准用法[9]为口服伊沙佐米4 mg/d,第1天(d1)、第8天(d8)、第15天(d15);口服地塞米松40 mg/d,d1、d8、d15、d22,d28为1个周期。估算的肾小球滤过率(eGFR)<30 ml/(min·1.73m2)的患者伊沙佐米的起始剂量为3 mg/周,地塞米松的剂量可根据患者的副反应调整。所有患者纳入不良反应观察,治疗3疗程以上患者纳入疗效分析。
观察指标观察患者起病时以及ID治疗前后临床及实验室指标,包括血游离轻链、血清免疫固定电泳、血常规(血红蛋白、白细胞、中性粒细胞、淋巴细胞、血小板)、血生化(血清肌酐、尿素氮、血清白蛋白、碱性磷酸酶、谷丙转氨酶、谷草转氨酶、eGFR)、24h尿蛋白定量、N端前脑钠肽(NT-proBNP)、肌钙蛋白T(TnT)等。超声测肝右肋下最大斜径、心脏超声测室间隔厚度。根据以上指标评估疗效。
相关标准及定义AL型淀粉样变性的诊断、器官受累标准以及血液学和器官反应标准根据中国系统性轻链型淀粉样变性诊断和治疗指南[10],并按照《Mayo 2012分期系统》将患者分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期,主要疗效评价根据血液学反应和器官反应。血液学反应分为严格意义的完全缓解(sCR)、完全缓解(CR)、较好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。器官(肾脏、心脏肝脏)反应分为缓解、SD和PD。
总体生存期:从ID治疗开始至任何原因导致的死亡时间(月)。总体生存率:从ID治疗开始至研究节点生存的概率(%)。无进展生存期:从ID治疗开始至血液学或器官进展或任何原因导致的死亡时间(月)。无进展生存率:从ID治疗开始至研究节点未出现血液学或器官进展或任何原因导致死亡的概率(%)。不良反应评价根据不良反应常见术语标准《CTCAE v4.0》。
统计学分析采用《SPSS 26》统计软件进行分析,符合正态分布的计量资料以均数±标准差表示,以t检验进行组间对比,不符合正态分布的计量资料以中位数(四分位间距)表示。患者生存时间采用Kaplan-Meier生存曲线评估。Mann-Whitney检验进行组间对比,P<0.05为差异有统计学意义。
结 果
一般资料18例患者一般资料和ID治疗前基线资料如表1所示。根据Mayo 2012分期,起病时的心脏受累情况为:Ⅰ期7例(38.89%)Ⅱ期3例(16.67%),Ⅲ期4例(22.22%),Ⅳ期2例(11.11%),2例患者缺失起病时心脏受累数据。1例入组时为Ⅲ期患者在ID治疗起始的数据缺失。1例患者在前期治疗过程中从Ⅰ期进展至Ⅱ期。

表1 18例患者一般情况及ID治疗前基线资料
疗效分析
血液学反应 入组的18例患者中,1例治疗不到1疗程即失访,2例患者在ID方案治疗不到1疗程即死亡,其中1例有风湿性心脏病,心脏瓣膜病病史,因心脏瓣膜疾病死亡,另1例患者透析后猝死。其余15例患者疗效分析如下:3例起病时血游离轻链< 20 mg/L,且在接受ID治疗后无进展,无法判定血液学反应情况,未列入血液学疗效统计,另12例血液学反应如图1所示。其中血液学反应sCR 1例、PR 1例、PD 1例、SD 9例。2例患者前期治疗未使用过蛋白酶体抑制剂, 有1例经ID治疗后获得sCR,血液学反应率50%。3例曾对硼替佐米治疗血液学有反应的患者中,有1例接受ID方案1周期后曾短暂出现受累轻链下降,但次月再次出现进展,其余2例均未获得血液学反应。而硼替佐米治疗无效的7例患者中,有1例在ID方案治疗后血液学PR。
器官反应 15例患者中有10例心脏受累,14例肾脏受累(3例在开始ID治疗时已达到终末期肾病),4例肝脏受累。ID治疗后器官反应如图1所示。

图1 伊沙佐米联合地塞米松治疗器官反应率sCR:严格意义的完全缓解;CR:完全缓解;VGPR:较好的部分缓解;PR:部分缓解;SD:疾病稳定;PD:疾病进展
存活及进展情况使用ID治疗后总体生存率及血液学无进展生存率如图2所示,尚未达到中位总体生存期及中位无进展生存期,1年总体生存率和无进展生存率分别是71.4%和71.8%。对出现血液学或器官进展患者和病情稳定患者ID治疗周期以及治疗基线各项指标进行对比(表2),虽然疾病进展患者ID治疗周期略短,开始ID治疗前受累轻链、心脏及肾脏受累指标均较疾病无进展患者略高,但无统计学差异。

图2 15例纳入疗效分析的患者总体生存率(A)及无进展生存率(B)曲线图
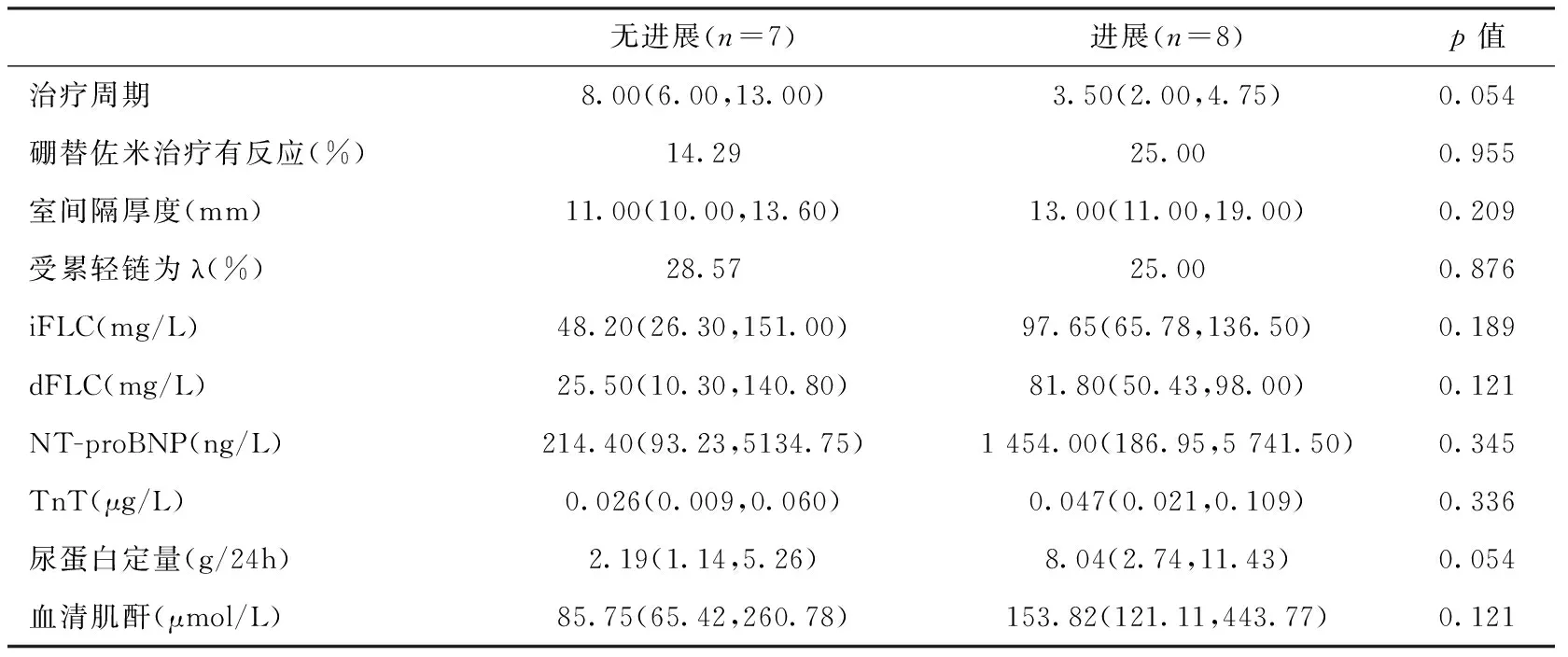
表2 ID治疗后无进展和进展患者基线指标
不良反应18例患者在接受ID方案治疗中总体不良反应发生率低,安全性良好(表3)。其中,血液学不良反应以贫血常见,非血液学不良反应以胃肠道反应较常见。1例在病程中出现哮喘,与治疗之间的关系不明确,1例出现水肿,未观察到周围神经病变。2例患者发生3/4级不良反应。
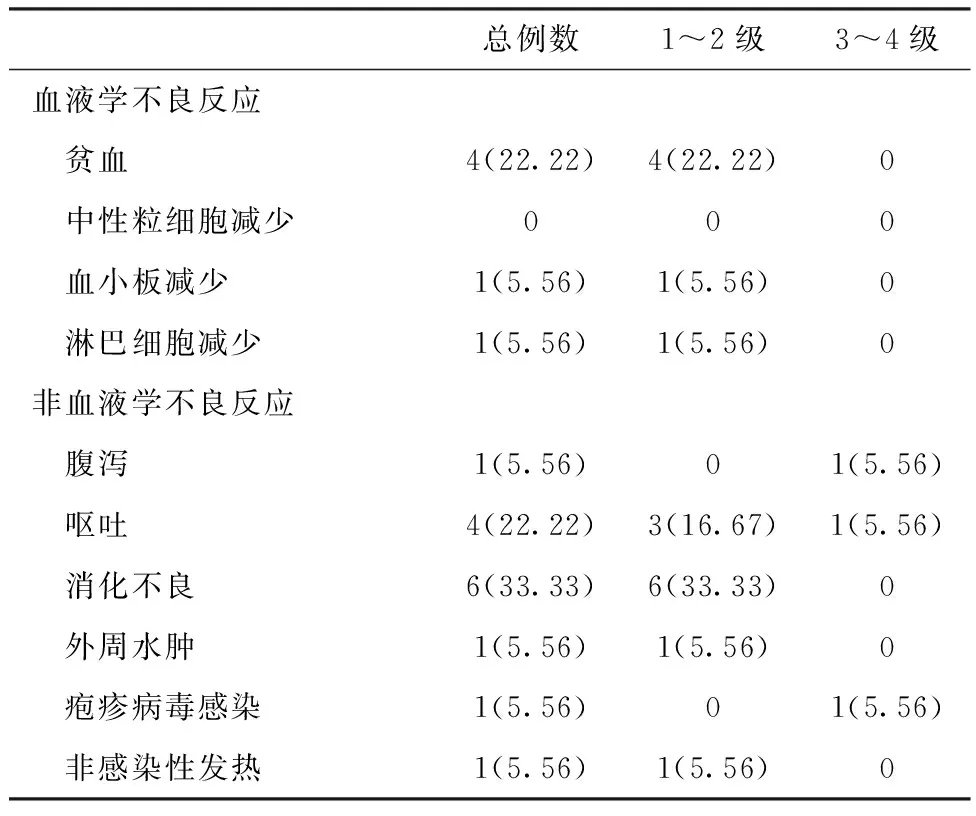
表3 伊沙佐米联合地塞米松方案相关的不良反应[n(%)]
讨 论
伊沙佐米作为第二代蛋白酶体抑制剂,在MM和AL型淀粉样变性的治疗中均表现出可靠的疗效。TOURMALINE-MM系列研究分别对新诊断、复发难治以及ASCT后使用伊沙佐米维持治疗的MM患者进行了研究,证实伊沙佐米联合来那度胺及地塞米松组较安慰剂联合来那度胺及地塞米松组均有更好的疗效[11-14]。表4概括了为本研究及其他伊沙佐米治疗AL型淀粉样变性研究,伊沙佐米治疗均可达到一定的血液学及器官反应率,疗效确切[9,15]。此外,有ID方案治疗复发性AL型淀粉样变性的3期临床研究因未达主要终点提前结束,但可观察到血液学反应率达53%[9]。
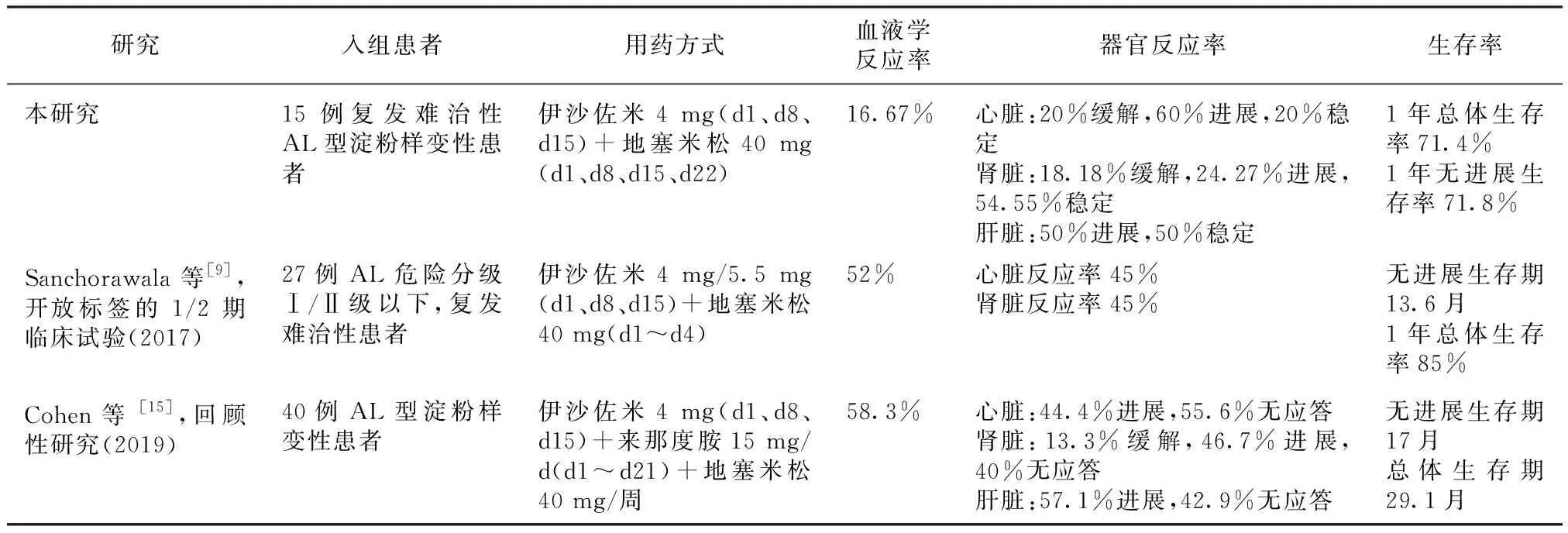
表4 伊沙佐米治疗系统性轻链(AL)型淀粉样变性研究对比
本研究观察了我中心18例接受ID方案治疗的难治复发性AL型淀粉样变性患者,血液学反应率16.67%,75%血液学维持稳定,心脏及肾脏反应率为20%及18.18%,分别有20%及54.55%患者维持心脏及肾脏情况稳定,且发现疾病进展组较无进展组心脏及肾脏基线指标较差、血游离轻链高,但数据无统计学意义。已有研究证实NT-proBNP、iFLC、TnT高,eGFR低,尿蛋白水平>5 g/24h等为预后相关危险因素,与总体生存期更差有关[16]。推测危险因素少的患者使用ID更可能获益,需增加不同危险分层患者入组分析验证。此外,研究表明难治性AL型淀粉样变性较复发性预后更差[17-18],而本研究入组病例有88.89%为难治性,11.11%为复发性,难治性患者比例高可能为治疗反应率低的原因。有文献表明未使用过蛋白酶体抑制剂的患者对伊沙佐米治疗反应率更高[9],但本研究未使用硼替佐米患者仅2例,后续需增加入组病例,比较前期治疗方案中有无蛋白酶体抑制剂的患者治疗反应。此外,本研究中对硼替佐米有反应者ID治疗后死亡率33.3%(1/3),无反应者死亡率42.86%(3/7)。但由于硼替佐米有反应患者仅3例,且ID治疗反应不一,未分析硼替佐米疗效与伊沙佐米疗效的相关性。
ID治疗不良反应发生率较低,程度均较轻,3/4级不良反应发生率16.67%,未见神经毒性。有2例患者使用ID方案治疗不到1周期即死亡,其中1例死于心脏瓣膜病,另1例起病时Mayo分期为Ⅲ期,加用ID方案时已开始透析,在透析后猝死,当时未做检查,死因不明确。有文献报道蛋白酶体抑制剂可导致心肌细胞蛋白酶体活性降低,影响心肌细胞的蛋白质降解,从而引起心脏毒性,导致心功能下降[19],也有ID导致心力衰竭的个案报道[20]。该患者起病时即心脏受累较严重,尚不能确定ID与患者死亡的关系,但后续使用中应增加对ID心脏毒性的观察。已有研究也均观察到,ID治疗的不良反应相对在可耐受及可控范围内,大部分可以通过对症治疗缓解。相较硼替佐米,ID对神经细胞HtrA2/Omi无明显抑制作用,因此神经毒性发生率极低,文献报道的1~2级神经毒性发生率约27%,3~4级约2%,与对照组均相似[13,21]。本研究前期有16例患者使用硼替佐米,其中有1例因外周神经病变3级而调整治疗方案,2例外周神经病变1~2级,这些患者在使用ID治疗后均未出现神经毒性。
本研究ID有效率不及文献报道,可能因为入组患者风险因素较多。入组患者中Mayo分期Ⅲ期以上者达37.5%,而Sanchorawala等[9]的研究中仅4%,且本研究尿蛋白、血清肌酐水平均高于文献治疗组基线水平。在对ASCT治疗后MM予ID维持治疗的研究中也观察到,ID的主要治疗效果在于降低了疾病进展及死亡风险,延长ASCT后PFS时间。本研究也观察到大部分患者在ID治疗后可维持无进展生存,出现进展的患者占53.5%。本研究观察时间有限,病例数较少,ID治疗周期少,后续需进行前瞻性研究,对入组患者根据危险因素分组后进一步比较ID对于疾病缓解及前期疗效的维持作用。
综上所述,本研究表明ID治疗AL型淀粉样变性有一定疗效,尤其在维持病情稳定上有着较为明显的效果。ID治疗的不良反应大部分可耐受及可控。此外,伊沙佐米的口服剂型及低神经毒性也可提高患者的依从性。因此,有神经系统受累或出现硼替佐米神经毒性以及需要口服药物治疗患者均可选择ID方案。而无蛋白酶体抑制剂使用史者在ID治疗后获得反应的可能更大,危险因素较多者在ID治疗后出现进展或死亡的概率更高。可在中国人群中对ID疗效进一步研究,分析ID在AL型淀粉样变性长期生存及病情进展的作用及影响ID疗效的因素,将 ID方案更好的应用在治疗AL型淀粉样变性中。

