符合慢加急(亚急)性肝功能衰竭病理特征大鼠模型的构建
张 涛,刘先姜,江 澄,孙克伟
(湖南中医药大学第一附属医院,国家中医(肝病)临床研究基地,长沙 410007)
慢加急(亚急)性肝功能衰竭(acute-on-chronic liver failure,ACLF)是我国肝衰竭中的主要类型,它是在慢性肝病病理损伤(包括慢性炎症损伤、肝纤维化、肝硬化)基础上,发生新的程度不等的肝细胞坏死性病变[1],如何模拟符合其病理特征的动物模型仍是难点[2]。 本研究通过改进目前国内公认经典ACLF 动物造模法,模拟在肝组织纤维化免疫损伤基础上,肠源性内毒素血症对肝的二次打击,所导致的肝细胞大片状坏死性病变的病理特性。 从肝与肠组织的病理与形态学评判该模型是否符合人类慢加急性肝功能衰竭病理特征,为临床研究构建动物模型。
1 材料和方法
1.1 实验动物
选取健康、成年清洁级SD 雄性大鼠85 只,体重(180±10) g,8 周龄,购自长沙市天勤生物科技有限公司[SCXK(湘)2019-0004],饲养于湖南中医药大学第一附属医院实验动物中心[SYXK(湘)2020-0010],研究方案经湖南中医药大学动物伦理委员会批准(ZYFY20190215),并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
牛血清白蛋白(Bovine Serum Albumin,BSA,批号:B150402),购自北京博尔西科技有限公司;脂多糖每支10 mg(SigmaL2880,批号:20170702)购自合肥博美生物科技有限公司;D-半乳糖胺盐酸盐每瓶1 g(RuibioG7219,批号:20170812)购自合肥博美生物科技有限公司;完全福氏佐剂F5881、不完全福氏佐剂F5506(批号:SLBL9742V)购自美国Sigma 公司;多聚赖氨酸(批号:SL24191402)购自上海甘源实业有限公司;10%福尔马林溶液(批号:180601)、二甲苯Ⅰ、Ⅱ(批号:061204)、 苏木精(批号:180301)、2.5%戊二醛(批号:180328)、丙酮(批号:00120727)及硝酸铅(批号:20180722)购自南昌雨露实验器材有限公司。 超薄切片机(厂家:德国莱卡(Leica),型号:EM UC-7);日立透射电镜(厂家:日立高新技术公司,型号:HT7700);电子显微镜(CX21 FSI 日本奥林巴斯公司);病理图像分析仪(美国Ewgle Eye Ⅱ型USA)。
1.3 实验方法
1.3.1 生活条件
保持温度24℃~28℃(最大日温差距<4℃),相对湿度60%~75%环境,换气次数:每小时>15 次,动物笼具处气流速度:≤0.2 m/s,噪声:≤60 dB/(A),普通光照:最低工作照度≥200 lx,定期紫外杀菌,昼夜明暗交替时间为12/12 h。 SPF 级颗粒饲料,大鼠灭菌刨花垫料(长沙市天勤生物科技有限公司);饮水为湖南中医药大学第一附属医院动物房纯净用水。
1.3.2 溶液及药品配制
(1)牛血清白蛋白乳化液
牛血清白蛋白5 g+0.9% Nacl 5 mL,混匀配制为1000 mg/mL。 取0.5 mL 加入30.75 mL 的0.9%Nacl,配成31.25 mL。 乳化:取牛血清白蛋白液20 mL(320 mg),与20 mL 的福氏不完全佐剂置烧杯内,超声波细胞粉碎机上乳化,成乳化液(含牛血清白蛋白8 mg/mL)。
(2)D-氨基半乳糖+脂多糖液(D-Gal+LPS)制备
称取D-Gal 4000 mg 溶于80 mL 的0.9%的无菌生理盐水中,然后用pH 值为6.8 的1 mol/L 氢氧化钠溶液调节。 精确称量LPS 2000 μg,加入D-Gal液中,混匀,生理盐水调总容积为100 mL,负压吸引泵过滤,用孔径0.22 μm 滤纸过滤除菌,处理后的溶液放入无菌瓶中备用,现用现配,腹腔注射剂量为0.5 mL/100 g。 以上操作均在超净台中完成。
1.3.3 造模
(1)免疫致敏阶段
85 只8 周龄SD 雄性大鼠适应性喂养1 周后,随机分为空白对照大鼠10 只,正常喂食、饮水,余75 只纳入造模组,开始实验动物造模实验。 选异体牛血清用无菌生理盐水稀释(与福氏佐剂乳化),参照Blackwell[3]实验方法,大鼠免疫致敏阶段(34 d),每次0.5 mL 乳化液(内含白蛋白4 mg)皮下多点注射。 皮下注射具体时间:为第1 次(实验第1天):20%牛血清白蛋白+等体积完全福氏佐剂;第2次(实验第14 天):20%牛血清白蛋白+等体积不完全福氏佐剂;第3 次(实验第24 天):20%牛血清白蛋白+1/2 体积不完全福氏佐剂;第4 次(实验第34天):20%牛血清白蛋白不加佐剂。 第4 次注射后10 d,大鼠尾静脉取血,琼脂双向扩散法检测牛血清白蛋白抗体。
(2)免疫攻击阶段
取有阳性抗体的大鼠,尾静脉注射牛血清白蛋白,2 次/周,每次0.2 mL。 牛血清白蛋白从每次0.5 mg,渐加到每次2 mg,最后至每次5 mg,维持此剂量,共6 周(次)。 6 周末处死2 只大鼠模型,取肝组织做病理观察,评价肝纤维程度,以临床相关指南中有关标准为参考,达到肝纤维化S3-S4 级[4],来判定免疫型肝纤维化造模是否成功。
(3)急性攻击阶段
肝纤维化造模成功后,在此模型基础上采用一次性腹腔注射LPS+D-Gal 构建ACLF 大鼠模型,给药剂量为:LPS100 μg/kg+D-Gal 200 mg/kg。 随机抽取4 只ACLF 大鼠模型及4 只空白对照大鼠,进行肝病理切片,HE 染色,光镜下观察肝的病理变化,镜下每个样本随机选取5 个10×20 倍视野,输入北航病理图片分析系统测量肝坏死面积、计算比值,取其平均值。 根据有关ACLF 肝组织病理学标准:肝细胞广泛坏死、溶解坏死≥1/2 肝实质[1],评判造模是否符合人类肝衰竭病理特征。
1.3.4 检测指标及方法
(1)一般情况
各大鼠每天分别称重,按相应体重调整饮食及饮水量,在给予相应饲料后,每天观察动物进食、饮水、行为、活动、精神状态、毛发及二便等情况。
(2)肝组织病理检测
分离大鼠肝,取距离肝边缘0.5 cm 处肝左叶组织小块,大小0.5×0.5×0.5 cm,PBS 涮洗后,于10%福尔马林溶液中固定12~24 h,石蜡包埋、切片。
(3)肠组织病理检测
在不中断血液供应时用手术剪迅速剪下约1 cm 肠管,将其对半剪成两半,并剪开肠管,用生理盐水冲洗,放在EP 管中,在戊二醛中固定,4℃保存。
(4)HE 染色病理检测
取材组织标本,4%多聚甲醛中固定,脱水、透明、浸泡、包埋制成石蜡组织块,超薄切片机切成4~6 μm 薄片。 进行常规HE 染色,观察大鼠肝及肠道在光学显微镜下的表现。
(5)透射电镜观察肠粘膜超微结构
肠粘膜组织经2.5%戊二醛经磷酸缓冲液配制固定、脱水、浸泡、包埋、固化,切片50~100 nm,3%醋酸铀以及硝酸铅双染色,日立HT7700 透射电镜观察、拍片。
1.4 统计学方法
HE 染色和电镜图片均通过Image J 图像分析软件分析。
2 结果
2.1 免疫致敏阶段
75 只实验大鼠,其中66 只尾静脉血清标本产生沉淀线,成功率为88%,与牛血清白蛋白抗体组对照所产生的沉淀线吻接成一线,与文献[3]相符。
2.2 免疫攻击阶段
使用牛血清白蛋白尾静脉攻击6 周后,2 只大鼠肝组织评估均达到肝纤维化S3-S4 级。 与正常大鼠比较,形成肝纤维化的大鼠在体重、毛发光泽度、摄食、对外界刺激反应灵敏度等方面无明显差异。 经免疫攻击造后,大鼠肝组织HE 染色光镜下观察,可见肝细胞排列紊乱,部分炎性细胞浸润,肝细胞索破坏,肝细胞呈片状坏死,大量纤维间隔形成,分隔并破坏肝小叶至小叶结构异常,部分标本可见假小叶形成,如图1A。 正常大鼠形态如图1B。
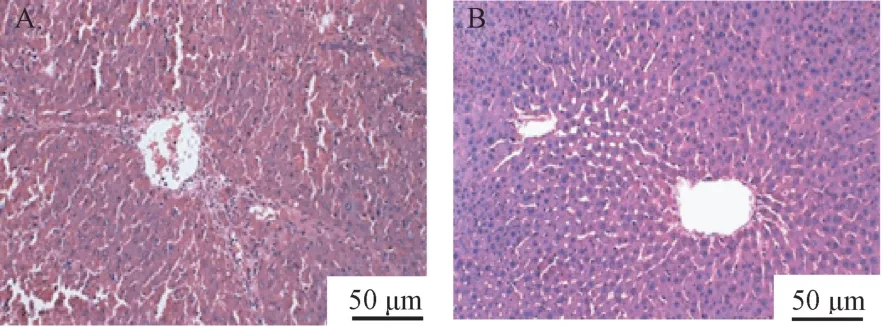
图1 肝纤维化HE 染色病理图片Note. A, Arrangement of hepatocytes was irregular, a little fibrous tissue hyperplasia could be seen around the sinuses,linear short fibrous septa could be seen in the portal area,separated hepatocyte masses showed different degrees of regeneration and pseudolobular formation. B, Arrangement of hepatocytes was regular, the morphology of hepatocytes was normal, the size of hepatocytes was uniform,the hepatic venules and portal areas were normal, and there was no obvious inflammatory infiltration.Figure 1 Pathological picture of hepatic fibrosis with HE staining
2.3 ACLF 大鼠模型评价
2.3.1 大鼠死亡情况
75 只纳入模型组实验大鼠,在免疫致敏阶段死亡2 只,模型组大鼠与正常组大鼠在体重、活动度、毛发光泽度等一般情况方面无明显差异。 至免疫攻击阶段完成,处死2 只大鼠用于病理评判,死亡5只;6 周末成模59 只,大鼠肝纤维化成模率,与文献报道[5]相近。 再予以一次性腹腔注射LPS+D-Gal急性攻击后,大鼠可见精神萎靡,活动度逐渐减低,部分大鼠有肢体扭曲,呈衰弱貌。 12 h 后,处死4 只大鼠用于病理评判,死亡15 只。 故ACLF 大鼠模型造模成功时,总体死亡率为29.3%(22/75)。
2.3.2 肝组织病理学评估
肝组织病理结果显示,与正常大鼠比较,模型大鼠肝组织出现肝细胞广泛性坏死、溶解坏死(≥2/3 肝小叶),肝小叶结构已完全破坏,可以判定肝衰竭造模成功,如图2A、图2B。
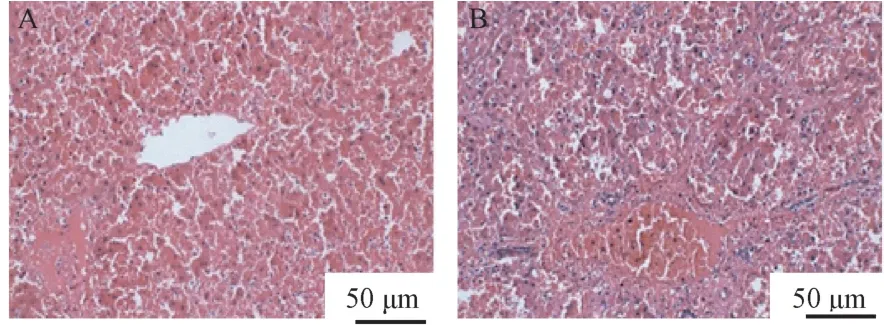
图2 肝衰竭大鼠肝HE 染色病理图片Note. A, Extensive necrosis and dissolution of hepatocytes with a range of more than 2/3, destruction of hepatic cord and diffuse infiltration of red blood cells. B, Disordered arrangement of hepatocytes, extensive fusion necrosis and formation of pseudolobules. A large number of red blood cells with partial inflammatory cell infiltration were found in the portal area.Figure 2 HE staining pathological picture of liver in rats with liver failure
2.3.3 肠粘膜组织光镜下评估
大鼠肠粘膜组织HE 染色光镜下观察,可见肠粘膜结构破坏,细胞广泛溶解坏死,大量炎性细胞浸润,如图3A。 正常大鼠形态,如图3B。
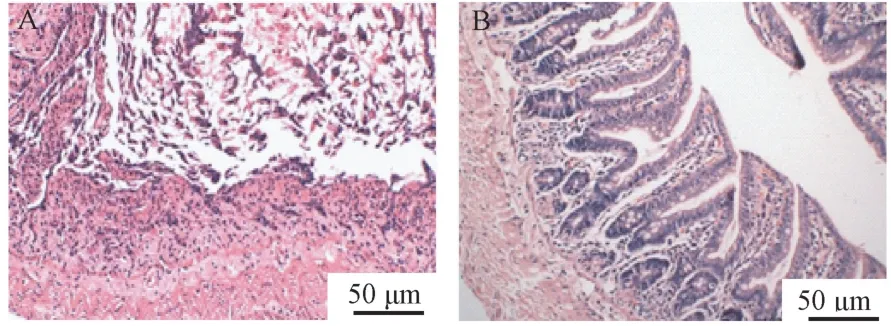
图3 肝衰竭大鼠肠粘膜组织HE 染色Note. A, Structure of intestinal mucosa is seriously damaged,cells are widely dissolved and necrotic, and a large number of inflammatory cells are infiltrated. B, Structure of intestinal mucosa is intact, cells are arranged in order, scattered goblet cells can be seen, intestinal glands are rich, and lumen is regular. No obvious inflammatory cell infiltration is found.Figure 3 HE staining of intestinal mucosa in rats with liver failure
2.3.4 透射电镜评估小肠粘膜超微结构
大鼠肠粘膜结构明显破坏,肠微绒毛排列紊乱,甚至断裂,细胞质染色变浅,细胞间隙增宽、线粒体肿胀、基质变浅、部分形成空泡,嵴减少、内质网扩张、甚至部分裂解,如图4。
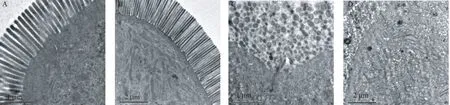
图4 大鼠肠粘膜透射电镜病理图片Note. Normal group (A/B), Intestinal mucosal hairs were arranged orderly, dense, without defect, with complete cell connection, different shapes of mitochondria, endoplasmic reticulum and other organelles. Liver failure model group (C/D), Intestinal mucosal cell structure was destroyed, microvilli arranged disorderly or even fell off, intercellular space widened, cells lost normal structure, mitochondria swelled, matrix became shallow, part of the formation of vacuoles, cristae decreased, or not developed, endoplasmic reticulum expanded, or even partially disintegrated.Figure 4 Pathological images of transmission electron microscopy of intestinal mucosa in rats
3 讨论
近年来的“肠-肝轴”理论,认为肠粘膜组织功能受损及其所导致的易位细菌介导的免疫反应加剧了ACLF 病情进展[6]。 故在着重于肝组织靶脏器本身变化过程的同时,肠道粘膜组织病理改变亦成为研究ACLF 动物模型的新关注点。
目前国内公认经典ACLF 大鼠造模方法,是刘旭华等[5]在人血白蛋白诱导免疫型肝纤维化大鼠基础上,一次性腹腔注射LPS 100 μg/kg+D-Gal 400 mg/kg 联合诱导建立的大鼠模型,该模型较好地模拟了在肝组织慢性炎症、纤维化免疫损伤基础上,肠源性内毒素血症对肝的二次打击所导致的肝细胞大片状坏死性病变的病理特性,故是目前国内最主要的ACLF 大鼠造模方法。 然而,该造模方法在完成LPS+D-Gal 的急性攻击后12 h 死亡率可高达90%,平均存活时间为(16.1±3.7) h,限制了在长期药物干预实验中的应用[7]。 同时该动物模型的评估着眼于肝组织病理生理过程,缺乏对其肠粘膜组织学评估。
本实验研究借鉴刘旭华等[5]的造模方法,大鼠34 d 内间断经皮下多点注射牛血清白蛋白乳化液后,88%产生牛血清抗体,予以尾静脉进一步注射6周后,肝组织病理学证实形成明显肝纤维化表现;再将Gal 由400 mg/kg 减至200 mg/kg,联合一次性腹腔注射LPS 100 μg/kg 加以急性攻击的造模方法,12 h 死亡率降至为29.3%。 通过病理组织学检测,光镜下肝组织呈现大块、亚大块坏死,肝小叶结构不清,肝窦明显扩张并充血,肝细胞出现大量坏死、甚至凋亡;肠粘膜出现绒毛断裂、脱落或相互融合,上皮细胞变性、坏死、脱落,并伴有炎症细胞浸润。 运用透射电镜观察肠粘膜组织超微结构,显示肠粘膜上皮结构破坏严重,微绒毛排列紊乱、脱落、甚至坏死,细胞间隙增宽,细胞质溶解,线粒体肿胀,嵴紊乱并模糊、部分空泡状等;肝与肠组织的病理与形态学表现与ACLF 患者病理表现接近,较好地模拟肝衰竭病理变化过程[8]。 同时,本实验ACLF 大鼠造模方法简便易于操作、成模率高、死亡率低,值得进一步应用推广。

