一种小鼠后肢针灸固定装置的制作与使用
苑功名,刘兴星,公一囡,王洋洋,杨静雯,徐 媛,郭永明
(天津中医药大学实验针灸学研究中心,天津 301617)
在针灸实验研究中,小鼠是应用较多的实验动物,但其体型小,天性活跃,不易抓取和固定,使针灸操作面临困难,一些实验采用气体麻醉、注射麻醉等方法使小鼠处于安静状态后再进行针灸操作。尽管这类方式能够减少挣扎活动对针灸效果的干扰,但麻醉药物的使用会对小鼠生命活动指标以及针灸感传效应产生影响,继而使得针灸机制的研究受到影响。 因此,能够在小鼠清醒状态下进行针灸干预是针灸实验研究者首要解决的问题。 然而在清醒状态下,如果操作者固定不当常会激惹小鼠,被其咬伤或抓伤;并且小鼠在固定过程中为了挣脱束缚,常常挣扎导致其受伤或死亡,造成样本脱落,影响实验的开展。 布制鼠衣固定是针刺实验中常用的小鼠固定方法之一,本文将介绍一种在布制鼠衣基础上进行改良的小鼠后肢固定器,可将小鼠较长时间固定且后肢不易脱出,从而提高实验操作安全性,保证实验干预效果。 该固定器可方便应用于小鼠后肢部的针刺、电针、艾灸等干预,以及足部注射、尾部取血、尾静脉注射等操作。
1 材料和方法
1.1 实验动物
SPF 级BALB/c 雄性小鼠,体重18~22 g,7周龄,共42 只,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011]。 饲养条件:12 h 光照周期,室温23℃~ 25℃,湿度45% ~50%,可自由摄食饮水,动物饲养于天津中医药大学实验动物中心[SYXK(津)2020-0005]。 实验经过天津中医药大学实验动物伦理委员会批准(TCM-LAEC2019062),并按实验动物使用的3R 原则给予人道关怀。
1.2 主要试剂与仪器
固定器制作:50 mL 离心管、曲别针、剪刀、钢锯条、酒精灯、止血钳、珍珠棉泡沫板、橡皮筋、砂纸;小鼠针刺:规格为0.16 mm×7 mm 的一次性无菌针灸针(北京中研太和医疗器械有限公司);碘伏、75%乙醇、透明胶带;行为学评价:足底热痛测试仪(Ugo,37370);旷场实验设备、高架十字迷宫设备、动物行为分析系统(上海吉量软件科技有限公司)。
1.3 实验方法
1.3.1 小鼠后肢固定器的制作与使用
(1)小鼠后肢固定器的制作
①呼吸孔:用钢锯条切掉离心管管底,做成直径0.5~0.7 cm 的圆孔,供小鼠呼吸。
②管体:沿图1 虚线,先用钢锯条在距离呼吸孔5 cm 处纵向切开,深度1.4 cm,再由管口水平横切至此处。

图1 呼吸孔及管体尺寸Figure 1 Size of breathing hole and tube
③后肢固定孔:将曲别针扳直,再参照图2 尺寸弯折成后肢固定孔的形状(如图3),止血钳夹住曲别针,用酒精灯烧热曲别针,在管体左右两侧相对应的位置烫出固定孔。
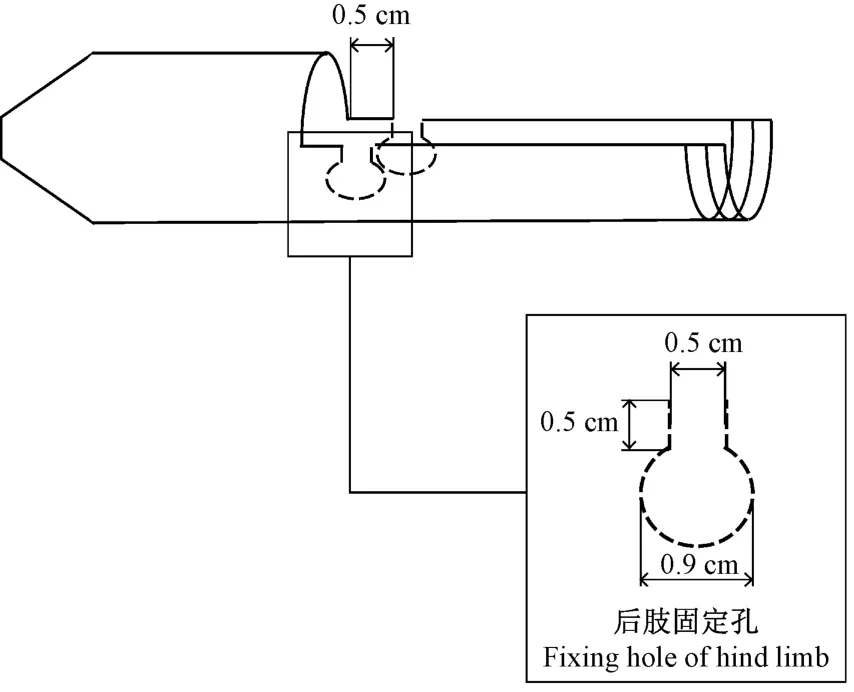
图2 后肢固定孔尺寸Figure 2 Size of fixing hole of hind limb
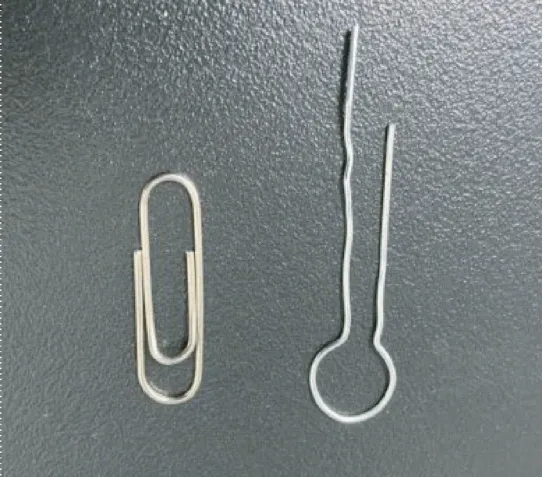
图3 弯折曲别针制作后肢固定孔Figure 3 Bending paper clip to make fixing hole of hind limb
④珍珠棉泡沫垫:用剪刀按照3 cm×3 cm×1 cm的尺寸剪裁即成。
⑤用砂纸磨平因剪切形成的锋利毛刺,以防固定器对小鼠造成皮肤破损。 小鼠后肢固定器各部分组件如图4 所示。

图4 小鼠后肢固定器实物图Figure 4 Physical picture of the mice hind limb fixator
(2)小鼠后肢固定器的使用
操作时一人即可完成操作。 轻柔抓取小鼠尾部,借助小鼠喜好钻洞探索的天性,将小鼠轻轻推入固定器管体。 一手拇指挡住小鼠尾部防止退出,另一手从后肢固定孔轻轻掏出小鼠后肢至自然伸展状态。 用泡沫垫挡在小鼠尾部,并用橡皮筋绑扎泡沫垫固定(如图5)。 每次实验结束后,清理粪便并用乙醇喷涂擦拭,祛除异味。
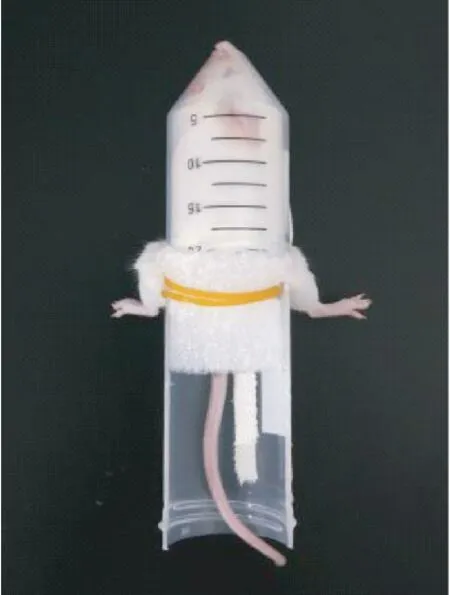
图5 小鼠后肢固定器的使用Figure 5 Use of the mice hind limb fixator
1.3.2 小鼠的足三里穴位针刺
将小鼠仰卧位固定,选择双侧足三里穴进行针刺,足三里穴位定位:于小鼠膝关节后外侧,腓骨小头下方约3 mm 处。 碘伏、75%乙醇对穴位局部常规消毒,使用规格为0.16 mm×7 mm 的一次性无菌针灸针,直刺进针,深度约3 mm,注意避开周围血管和神经,留针时长为30 min。 使用布制鼠衣或小鼠后肢固定器固定针刺如图6、图7 所示。
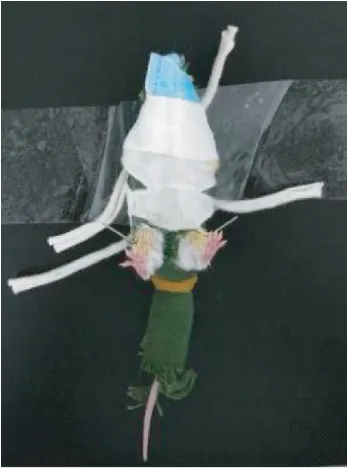
图6 布制鼠衣固定小鼠针刺Figure 6 Fix and acupuncture with cloth mice clothing

图7 小鼠后肢固定器固定小鼠针刺Figure 7 Fix and acupuncture with the mice hind limb fixator
1.3.3 小鼠行为学测试
(1)热辐射痛阈检测
采用足底热痛测试仪对小鼠右侧足底热辐射痛阈进行检测。 以小鼠对红外热刺激的最大耐受时间即PWTL(paw withdrawal thermal latency, 热刺激缩足潜伏期)作为热辐射痛阈值。 每次测量前将小鼠放入热辐射痛测试板格中适应30~40 min 直至安静,每只小鼠每隔5 min 测量1 次,取3 次测量的平均值。 对足底热辐射痛阈检测者实施盲法。
(2)旷场实验
旷场实验设备由隔音箱(含视频追踪摄像头、白灯、红外灯)、组件、主控箱、画面分割器、配套电脑组成。 隔音箱能营造一个相对封闭的稳定环境,减少实验人员对小鼠行为的干扰。 实验期间保持安静,室温23℃~25℃,湿度50%~60%,实验前需适应实验室环境1 h。 实验时先打开视频采集摄像头,再将小鼠头朝侧壁迅速放入底部正中央区域,记录小鼠的实时运动轨迹。 以小鼠触碰任意侧壁的时刻为起始点,记录5 min 内的活动轨迹。 每只小鼠完成实验后,需清理粪便并用乙醇喷涂擦拭,以防异味对后续小鼠造成影响。 实验结束后导出总路程、平均速度、中央区活动路程、中央区活动时间作为结果指标进行统计分析。
(3)高架十字迷宫实验
高架十字迷宫实验设备由开放臂、闭合臂、视频追踪摄像头、主控箱、配套电脑组成。 开放臂、闭合臂尺寸为65 cm×5 cm,距地面高45 cm。 实验环境要求同旷场实验,实验时先打开视频追踪摄像头,再将小鼠头朝开放臂迅速放入正中央区域(所有小鼠均朝向同一开放臂放入),以小鼠放入中央区的时刻为起始点,记录5 min 内的活动轨迹。 每只小鼠完成实验后,需清理粪便并用乙醇喷涂擦拭,以防异味对后续小鼠造成影响。 实验结束后导出进入开放臂次数、进入闭合臂次数、开放臂停留时间、闭合臂停留时间,将进入开放臂次数百分比(即进入开放臂次数与进入开放臂、闭合臂总次数之比)、开放臂停留时间百分比(即开放臂停留时间与开放臂、闭合臂停留总时间之比)作为结果指标进行统计分析。
1.4 统计学方法
本研究数据以平均数±标准差(±s)表示,统计学分析采用SPSS 19.0 统计软件完成。 小鼠固定所需时间、后肢回缩次数、针具脱落次数采用t检验比较差异;小鼠体重以及热辐射痛阈采用重复测量资料的方差分析比较差异;旷场实验、高架十字迷宫实验各指标符合正态分布时,采用单因素方差分析,不符合正态分布时,使用非参数检验。 以P<0.05 为有统计学差异,以P<0.01 为有显著统计学差异。
2 结果
2.1 小鼠后肢固定器与布制鼠衣的固定针刺应用比较
考虑到针刺实验通常会实施多次干预,因此选取同一批小鼠,将12 只小鼠按随机数字表法分为布制鼠衣组和小鼠后肢固定器组,每组6 只;为排除单一实验员操作熟练度对实验结果的影响,则招募4位实验员A、B、C、D 参与实验;为避免同一天实验会对小鼠造成损伤继而抗拒固定针刺影响实验结果,则安排这4 位不同的实验员分别在第1 天、第3天、第5 天、第7 天使用布制鼠衣或小鼠后肢固定器固定小鼠并针刺,共计4 次。 留针期间4 位实验员固定小鼠操作时间、小鼠后肢的回缩次数和针具脱落次数(每只小鼠后肢回缩或针具脱落1 次计为1,否则计为0)、每次固定针刺后的体重结果如下。
2.1.1 小鼠固定所需时间的比较
表1 结果显示,与使用布制鼠衣相比,4 位实验员使用小鼠后肢固定器固定1 只小鼠的平均用时均更短(P<0.01)。 表明使用小鼠后肢固定器能显著提高小鼠固定操作的效率。
表1 各实验员固定1 只小鼠的平均用时(±s,n=6)Table 1 Average time of each experimenter to fix a mouse
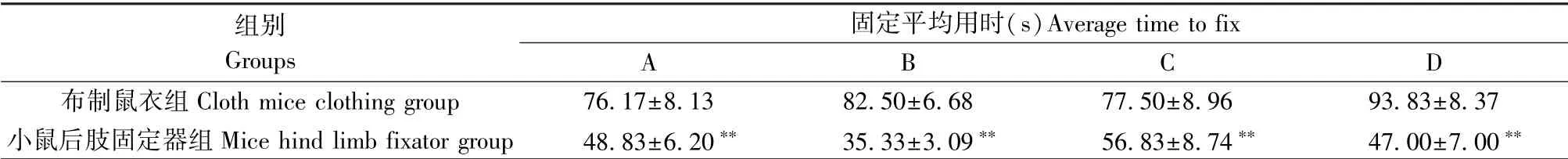
表1 各实验员固定1 只小鼠的平均用时(±s,n=6)Table 1 Average time of each experimenter to fix a mouse
注:与布制鼠衣组比较,∗∗P<0.01。Note. Compared with the cloth mice clothing group, ∗∗P<0.01.
组别Groups固定平均用时(s)Average time to fix A B C D布制鼠衣组Cloth mice clothing group 76.17±8.13 82.50±6.68 77.50±8.96 93.83±8.37小鼠后肢固定器组Mice hind limb fixator group 48.83±6.20∗∗ 35.33±3.09∗∗ 56.83±8.74∗∗ 47.00±7.00∗∗
2.1.2 后肢回缩次数
对两组小鼠留针期间后肢出现回缩的次数进行计次统计分析,结果如表2 所示,4 位实验员使用布制鼠衣或小鼠后肢固定器固定小鼠,其后肢回缩的平均次数比较无统计学差异(P>0.05),但从4 位实验员各自的固定情况看,使用小鼠后肢固定器时后肢回缩次数相对较少,说明该装置对小鼠后肢的固定效果一定程度上优于布制鼠衣。
表2 后肢回缩平均次数(±s,n=6)Table 2 Average number of hind limb retraction

表2 后肢回缩平均次数(±s,n=6)Table 2 Average number of hind limb retraction
组别Groups回缩平均次数(次)Average number of retraction A B C D布制鼠衣组Cloth mice clothing group 0.50±0.50 0.33±0.47 0.17±0.37 0.17±0.37小鼠后肢固定器组Mice hind limb fixator group 0.17±0.37 0.00±0.00 0.17±0.37 0.00±0.00
2.1.3 针具脱落次数
对两组小鼠留针期间针具出现脱落的次数进行计次统计分析,结果如表3 所示,4 位实验员使用两种方法固定小鼠,其针具脱落的平均次数组间比较无统计学差异(P>0.05),而从4 位实验员各自针刺效果看,使用布制鼠衣固定小鼠,其挣脱时更容易导致针具脱落,而使用小鼠后肢固定器能减少针具的脱落次数。
表3 针具脱落平均次数(±s,n=6)Table 3 Average number of needle shedding

表3 针具脱落平均次数(±s,n=6)Table 3 Average number of needle shedding
组别Groups脱落平均次数(次)Average number of shedding A B C D布制鼠衣组Cloth mice clothing group 0.33±0.47 0.17±0.37 0.17±0.37 0.00±0.00小鼠后肢固定器组Mice hind limb fixator group 0.00±0.00 0.00±0.00 0.17±0.37 0.00±0.00
2.1.4 两种固定针刺方法对体重的影响
表4 的体重结果显示,两组小鼠在实验前的基础体重以及四次固定针刺后的体重无明显差别(P>0.05),表明无论使用何种固定针刺方法,其对小鼠的体重均无明显影响。
表4 对小鼠体重的影响(±s,n=6)Table 4 Effect of mice body weight

表4 对小鼠体重的影响(±s,n=6)Table 4 Effect of mice body weight
组别Groups小鼠体重(g)Mice body weight基础体重Basic body weight第一次First time第二次Second time第三次Third time第四次Fourth time布制鼠衣组Cloth mice clothing group 21.00±0.52 21.40±0.23 20.92±0.51 21.10±0.78 21.07±0.57小鼠后肢固定器组Mice hind limb fixator group 21.08±0.27 21.18±0.49 20.82±0.42 20.62±0.82 20.80±0.75
2.2 不同固定方法对小鼠痛阈、认知、情绪等影响的比较
在比较小鼠后肢固定器与布制鼠衣的使用情况基础上,采用热辐射痛阈检测、旷场实验、高架十字迷宫实验进一步评估不同固定方法对小鼠痛阈、认知、情绪等指标的影响。 将30 只小鼠按随机数字表法分为对照组、布制鼠衣组和小鼠后肢固定器组,每组10 只;安排一位实验员分别在第1 天、第3天、第5 天、第7 天对小鼠进行固定,共计4 次,每次时长30 min;对照组正常饲养不固定,布制鼠衣组使用布制鼠衣固定,小鼠后肢固定器组使用小鼠后肢固定器固定。 于第一次固定前和每次固定后进行热辐射痛阈检测,于第四次固定后进行旷场实验、高架十字迷宫实验。 实验结果如下。
2.2.1 不同固定方法对痛阈的影响
表5 的热辐射痛阈结果显示,三组小鼠的基础热辐射痛阈以及四次固定后的热辐射痛阈无统计学差异(P>0.05),表明不同固定方法对小鼠痛阈的影响无明显差别。
表5 对小鼠痛阈的影响(±s,n=10)Table 5 Effect of mice pain threshold

表5 对小鼠痛阈的影响(±s,n=10)Table 5 Effect of mice pain threshold
组别Groups小鼠热辐射痛阈(s)PWTL of mice基础热辐射痛阈Basic PWTL第一次First time第二次Second time第三次Third time第四次Fourth time对照组Control group 12.92±1.08 11.91±1.15 12.38±0.69 12.58±0.49 12.56±0.58布制鼠衣组Cloth mice clothing group 13.00±0.91 12.66±0.70 12.09±1.13 12.91±0.86 12.62±0.93小鼠后肢固定器组Mice hind limb fixator group 12.86±0.98 12.23±0.83 12.86±0.56 12.13±0.99 12.54±0.52
2.2.2 不同固定方法对旷场实验各项指标的影响
表6 的旷场实验结果显示,三组小鼠5 min 内的总路程、平均速度、中央区活动路程、中央区活动时间组间比较均无统计学差异(P>0.05),表明不同固定方法对小鼠认知、情绪的影响无明显差别。
表6 旷场实验结果(±s,n=10)Table 6 Results of open field test
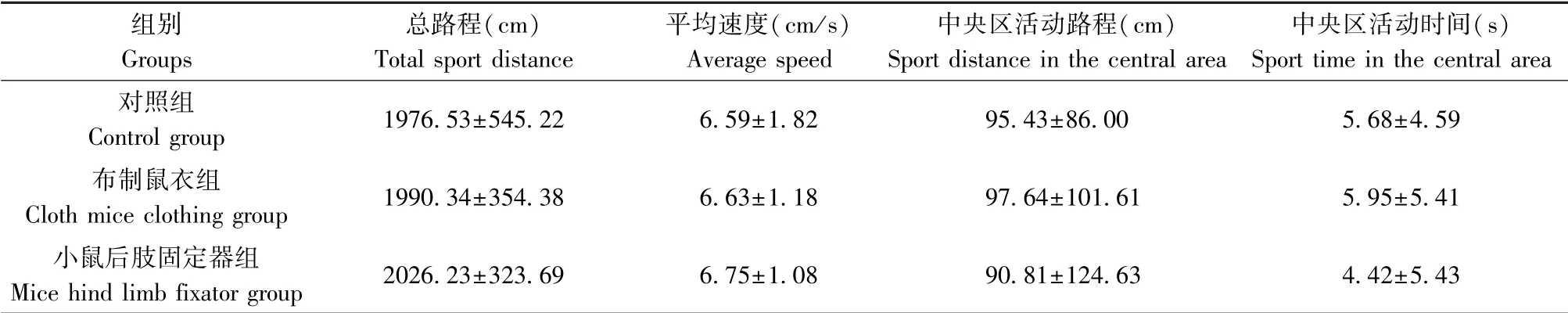
表6 旷场实验结果(±s,n=10)Table 6 Results of open field test
组别Groups总路程(cm)Total sport distance平均速度(cm/s)Average speed中央区活动路程(cm)Sport distance in the central area中央区活动时间(s)Sport time in the central area对照组Control group 1976.53±545.22 6.59±1.82 95.43±86.00 5.68±4.59布制鼠衣组Cloth mice clothing group 1990.34±354.38 6.63±1.18 97.64±101.61 5.95±5.41小鼠后肢固定器组Mice hind limb fixator group 2026.23±323.69 6.75±1.08 90.81±124.63 4.42±5.43
2.2.3 不同固定方法对高架十字迷宫实验各项指标的影响
表7 的高架十字迷宫实验结果显示,三组小鼠5 min 内进入开放臂次数百分比、开放臂停留时间百分比组间比较无统计学差异(P>0.05),表明不同固定方法对小鼠情绪的影响无明显差别。
表7 高架十字迷宫实验结果(±s,n=10)Table 7 Results of elevated cross maze test

表7 高架十字迷宫实验结果(±s,n=10)Table 7 Results of elevated cross maze test
组别Groups进入开放臂次数百分比(%)Percentage of open arm entry开放臂停留时间百分比(%)Percentage of open arm time对照组Control group 44.93±22.38 45.73±30.21布制鼠衣组Cloth mice clothing group 58.95±21.78 55.51±30.78小鼠后肢固定器组Mice hind limb fixator group 44.68±24.50 48.17±29.93
3 讨论
不同于针灸临床试验,针灸动物实验能够进行原本在人体上无法实现的研究,为解开针灸理论与技术的奥秘、解读针灸作用原理及规律提供了更多可能[1]。 为了保证针灸动物实验结果的客观性和可信度,实验动物固定方法的选择尤为重要。 文献中用于小鼠固定的方法主要有手固定法、捆绑法、器具固定法三种[2],不论何种固定方法,其目的都是为了在实验操作中尽可能地减少实验动物与操作者双方因素的叠加影响,因此固定方法应该满足以下要求:第一,减低应激反应。 固定方法会引起实验动物的应激反应,如紧张、恐惧等情绪,当前多采用各组同等固定的方式来平衡组间的差异性,合适的固定方法一方面能减少应激反应的产生,减少动物的痛苦,另一方面能够尽量减少组间的差异[3-5]。 第二,保持合适的体位。 不同穴位的针灸操作对体位的选择有一定的要求,正确的固定能较好控制动物的体位,减少不必要的刺激,进而保证个体间和组间针刺深度、针刺方向以及行针操作的一致性。 第三,有助于穴位选取。 只有正确的取穴才能准确反映针效,针灸取穴是否精准与固定方法直接相关,实验动物接受固定后,任何的挣扎、挣脱动作都会导致腧穴定位出现偏差,影响针灸干预的疗效[6]。 第四,保证安全。 针灸动物实验必须注意实验动物和操作者的安全,不当的固定方法不仅会使实验动物受伤甚至死亡,导致样本脱落,而且如若造成动物激惹,操作者会有被咬伤的风险[7]。 第五,固定方法的选择要考虑实验成本、操作的简便性等因素,提高实验效率亦是选择合适固定方法的目的之一。
本研究对常用的传统的鼠衣固定法和新研制的小鼠固定器做了多方面比较,虽然二者对于小鼠的体重、认知、痛阈都没有影响,但相较于布制鼠衣固定,小鼠后肢固定器所用固定时间及针具脱落次数都有降低,除此之外,小鼠后肢固定器还有以下优势:一是在小鼠固定期间,布制鼠衣无法判断小鼠状态,而透明的小鼠后肢固定器能随时观察小鼠,一旦小鼠由于挣扎出现窒息危险,能及时进行解救。 二是柔软的布制鼠衣在固定小鼠时不易控制松紧度,太松小鼠容易挣脱,太紧则增加小鼠出现应激反应的强度,小鼠后肢固定器则能统一控制固定的松紧程度,以达到平衡组间差异的作用。 三是布制鼠衣不易清洁,为减少残留气味对小鼠的影响,每次使用后需清洗晾干才能再次使用,而小鼠后肢固定器使用乙醇喷涂擦拭后即可。 四是实际应用发现,布制鼠衣固定时小鼠的撕咬使得鼠衣损耗较大,而小鼠后肢固定器制作材料易得,制作简单,损耗极少,从节省实验成本的角度考量,小鼠后肢固定器更优。
总之,实验结果和实际应用表明,该小鼠后肢固定器制作简单,成本低廉,实用耐久,在提高实验安全性和效率方面优势明显,可最大限度地减少固定本身对小鼠的干扰,减少对实验结果的影响,能够为针灸实验研究提供便利,推荐使用。 然其尺寸、样式并不唯一,使用者可根据不同研究的具体需求,如小鼠体重、取穴部位等进行相应的改良,以达到最佳的使用效果。

