去氢木香内酯诱导胃癌细胞自噬和凋亡及氧化应激
邵玉普,刘 斌,李伟明,邵喜灵,陈巧格
(1.河南医学高等专科学校 基础医学实验中心,河南 新郑 451191;2.河南中医药大学第三附属医院 肿瘤科,郑州 450008;3.河南医学高等专科学校 护理系实训中心,河南 新郑 451191;4.河南医学高等专科学校人体解剖学教研室,河南 新郑 451191)
胃癌是一种与环境、饮食生活、基因遗传等多种因素有关的消化道恶性肿瘤,在我国的发病率仅次于肺癌,死亡率仅次于肝癌和肺癌[1]。 胃癌患者早期通常表现为非特异性的消化道症状,随病情恶性进展,可出现上腹疼痛、食欲下降、吞咽困难、消瘦等,临床主要采用手术联合化疗[2]。 然而,胃癌患者术后易发生复发和转移,且长期化疗的毒副作用较多,部分患者往往因无法耐受化疗而被迫终止治疗,严重影响了治疗的效果[3]。 寻找新的有效药物,辅助临床治疗,受到了研究者们的广泛关注。去氢木香内酯(dehydrocostus lactone,DHCL)来源于天然植物药物菊科云木香属植物木香Aucklandia lappa Decne.的干燥根,具有抗氧化、抗炎、抗肿瘤等多种生物学活性[4]。 既往研究显示,DHCL 可以抑制喉癌[5]、胶质瘤[6]、肺癌[7]等多种肿瘤细胞的增殖活性,诱导肿瘤细胞凋亡,有望应用于临床抗肿瘤治疗。 但DHCL 对胃癌细胞的作用尚不明确,且其具体的作用机制尚不清楚。 因此,本研究探讨了DHCL 对胃癌细胞自噬、凋亡和氧化应激的影响,以期了解DHCL 可能的抗胃癌作用机制,为临床治疗提供一定的理论依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
30 只雄性BALB/C 裸鼠,SPF 级,鼠龄4~5 周,体重(20±2)g,均购自河南省实验动物中心[SCXK(豫)2017-0001]。 饲养于河南中医药大学实验动物中心[SYXK(豫)2020-0004]。 所有实验动物均遵循3R 原则,经动物实验伦理审查通过(审批号IACUC-20200703)。
1.1.2 细胞
人胃癌SGC-7901 购自美国典型物种保藏中心。
1.2 主要试剂与仪器
DHCL 购自南京春秋生物工程有限公司,质量分数≥98%,批号20191206;DCFH-DA 探针购自北京百奥莱博科技有限公司;胎牛血清、RPMI-1640培养基均购自上海沪震生物科技有限公司(批号分别为20200508 和20190704);CCK-8 检测试剂盒购自上海经科化学科技有限公司,批号20200915;兔抗人LC3-Ⅰ、LC3-Ⅱ、Beclin 1、自噬相关蛋白7(autophagy associated protein 7,ATG7)、p62、B 细胞淋巴瘤2(B-cell lymphoma 2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)、BH3 相互作用域死亡激动剂(BH3 interaction domain death agonist,Bid)、截短型Bid(truncated Bid,tBid)、半胱氨酸天冬氨酸蛋白酶8(Caspase-8)、Caspase-9、Caspase-3、裂 解 的 Caspase-8 ( cleaved Caspase-8)、 cleaved Caspase-9、cleaved Caspase-3、β-actin 单克隆抗体购自美国CST 公司(批号分别为20200812、20200612、20200615、 20191215、 20200624、 20200815、20200621、 20200704、 20200715、 20200902、20191118、 20191215、 20200713、 20200714、20200812、20200905);辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔IgG 购自北京中杉金桥生物技术公司, 批号101964; 二喹啉甲酸(bicinchoninic acid disodium,BCA)蛋白定量试剂盒和Annexin V-FITC/PI 细胞凋亡检测试剂盒购自北京索莱宝科技有限公司(批号分别为20191116 和20191205);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒均购自南京森贝伽生物科技有限公司(批号分别为20200712、20200916、20200608)。
实验仪器IX73 型荧光显微镜购自日本Olympus 公司;多功能酶标检测仪(iMark680)购自美国Bio-Rad 公司;DXFLEX 流式细胞检测仪购自美国贝克曼库尔特公司。
1.3 实验方法
1.3.1 CCK8 实验筛选DHCL 剂量
将胃癌细胞SGC-7901 接种于含有10%胎牛血清的RPMI-1640 培养液,培养过夜。 取培养至对数生长期的细胞制成单细胞悬液,调整细胞密度为5×104/mL,继续培养,加入100 μL 不同浓度的DHCL(终浓度分别为0、0.6、1.25、2.5、5、10、20、40、80、160、320 μmol/L),孵育24 h 后,严格按照试剂盒说明采用CCK-8 法检测细胞的增殖活性,检测450 nm波长下的吸光度值,计算细胞的存活率。 根据细胞的增殖曲线,设置DHCL 0 μmol/L 组、DHCL 10 μmol/L 组、DHCL 20 μmol/L 组和DHCL 40 μmol/L 组。
1.3.2 Western blot 检测细胞自噬相关蛋白表达的影响
取各组与相应浓度药物孵育24 h 的细胞,提取总蛋白并且进行蛋白定量,经电泳、转膜、室温封闭2 h,加一抗p62(1 ∶1000)、Beclin1(1 ∶1000)、LC3Ⅱ(1 ∶1000)、LC3 Ⅰ(1 ∶1000)、ATG7(1 ∶1000),βactin(1 ∶500)为内参,4℃孵育过夜,洗膜加二抗(1 ∶5000)室温孵育2 h,显影,分析各蛋白相对内参的表达量。
1.3.3 免疫荧光检测细胞自噬活性
取各组与相应浓度药物孵育48 h 的细胞,弃培养基,采用质量分数为4%的甲醛固定10 min,加入200 μL 的Triton-X 作用30 min,采用3%牛血清蛋白封闭,加入LC3 一抗孵育过夜,加入荧光耦联二抗,37℃孵育1 h 后封片,荧光显微镜下观察LC3 荧光斑点数。
1.3.4 流式细胞仪分析细胞凋亡
取各组与相应浓度药物孵育48 h 的细胞,调整细胞浓度约为1×105个/孔,预冷PBS 洗涤2 次,严格按照凋亡试剂盒说明采用Annexin V-FITC/PI 双染法进行染色,上流式细胞仪分析细胞的凋亡率。
1.3.5 Western blot 检测Bax、Bcl-2、Bid、Caspase-8、Caspase-9、Caspase-3 蛋白表达
取各组与相应浓度药物孵育24 h 的细胞,检测
Bax(1 ∶1000)、Bcl-2(1 ∶1000)、Bid(1 ∶1000)、tBid(1∶1000)、Caspase-8(1 ∶1000)、cleaved Caspase-8(1 ∶1000)、Caspase-9(1 ∶1000)、cleaved Caspase-9(1 ∶1000)、Caspase-3(1 ∶1000)和cleaved Caspase-3(1 ∶1000)蛋白表达,具体方法同1.3.2。
1.3.6 ELISA 法检测细胞上清液中氧化应激因子水平
取各组与相应浓度药物孵育24 h 的细胞,离心(2000 r/min,2 min),取上清,采用ELISA 法检测细胞上清液中SOD、GSH-Px 和MDA 水平,严格按试剂盒说明操作。
1.3.7 DCFH-DA 探针检测细胞内ROS 水平
取各组与相应浓度药物孵育24 h 的细胞,以1×105个/孔接种于24 孔板,PBS 洗3 次,加入DCFH-DA 探针,37℃孵育1 h,PBS 洗3 次,加入新鲜培养基,荧光显微镜下观察ROS 水平。
1.3.8 裸鼠移植瘤模型建立
30 只裸鼠预饲养7 d,随机分为对照组和DHCL组,每组15 只。 所有裸鼠均采用背部尾侧皮下种植0.2 mL 对数生长期SGC-7901 细胞悬液每毫升1×107个复制移植瘤模型,肉眼可见皮下成瘤,即为造模成功。 造模第2 天,DHCL 组腹腔注射20 mg/(kg·d) DHCL,连续注射2 周,对照组腹腔注射等体积生理盐水。 末次给药后第2 天,迅速处死大鼠,剥离移植瘤组织并称重。
1.4 统计学方法
采用SPSS 20.0 进行统计学数据处理,满足正态分布且方差齐的计量资料均以平均数±标准差(±s)表示,采用两样本独立t检验比较两组间差异,单因素方差分析比较多组间差异性,SNK-q比较多组内两两间差异,P<0.05 表示差异有统计学意义。
2 结果
2.1 DHCL 抑制SGC-7901 细胞增殖
CCK-8 结果显示(图1),DHCL 对胃癌细胞的抑制作用呈药物浓度依赖性,随着DHCL 浓度增加,DHCL 浓度≥20 μmol/L 时,细胞存活率下降(P<0. 05)。 因此设置DHCL 低剂量、中剂量、高剂量组的浓度分别为10 μmol/L、20 μmol/L、40 μmol/L。 DHCL 40 μmol/L 组 和DHCL 20 μmol/L 组细胞存活率低于DHCL 0 μmol/L 组(P<0. 05)。
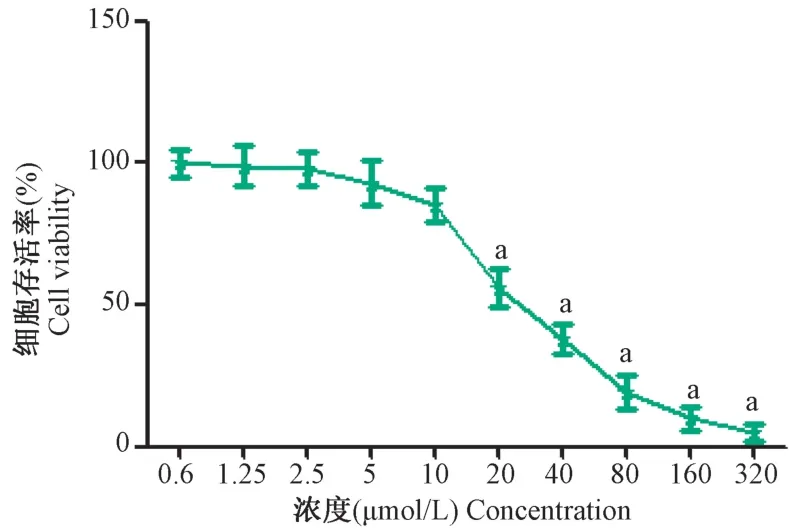
图1 DHCL 抑制SGC-7901 细胞增殖Note. Compared with 0 μmol/L DHCL, aP<0.05.Figure 1 DHCL inhibited the proliferation of SGC-7901 cells
2.2 DHCL 促进SGC-7901 细胞自噬相关蛋白表达
Western blot 结果显示(图2),DHCL 40 μmol/L组和DHCL 20 μmol/L 组细胞p62 蛋白表达低于DHCL 0 μmol/L 组(P<0.05),Beclin1、LC3Ⅱ/LC3Ⅰ和ATG7 蛋白表达高于DHCL 0 μmol/L 组(P<0.05)。
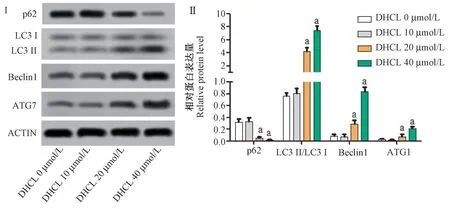
图2 DHCL 促进SGC-7901 细胞自噬相关蛋白表达Note. Ⅰ, Expression of autophagy-related proteins in each group. Ⅱ, Relative protein level of autophagy-related proteins. Compared with DHCL 0 μmol/L group, aP<0.05.Figure 2 DHCL promoted the expression of autophagy-related proteins in SGC-7901 cells
2.3 DHCL 增强SGC-7901 细胞自噬活性
免疫荧光实验检测结果显示(图3),DHCL 40 μmol/L 组和DHCL 20 μmol/L 组细胞LC3 荧光斑点数高于DHCL 0 μmol/L 组。
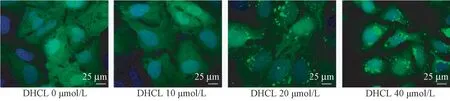
图3 DHCL 增强SGC-7901 细胞自噬活性Figure 3 DHCL enhanced autophagy activity of SGC-7901 cells
2.4 DHCL 促进SGC-7901 细胞凋亡
流式细胞仪检测结果显示(图4),DHCL 40 μmol/L 组和DHCL 20 μmol/L 组细胞凋亡率高于DHCL 0 μmol/L 组(P<0.05)。
2.5 DHCL 促进SGC-7901 细胞凋亡相关蛋白表达
Western blot 检测结果显示(图5),DHCL 40 μmol/L 组和DHCL 20 μmol/L 组细胞Bax/Bcl-2、tBid/Bid、 cleaved Caspase-8/Caspase-8、 cleaved Caspase-9/Caspase-9 和cleaved Caspase-3/Caspase-3蛋白表达高于DHCL 0 μmol/L 组(P<0.05)。

图5 DHCL 促进SGC-7901 细胞凋亡相关蛋白表达Note. Ⅰ, Protein expression detected by Western blot. Ⅱ, Relative protein level. Compared with DHCL 0 μmol/L group, aP<0.05.Figure 5 DHCL promoted the expression of apoptosis-related proteins in SGC-7901 cells
2.6 DHCL 抑制SGC-7901 细胞抗氧化酶表达
ELISA 检测结果显示(图6),DHCL 40 μmol/L组和DHCL 20 μmol/L 组细胞SOD 和GSH-Px 水平低于DHCL 0 μmol/L 组(P<0.05),MDA 水平高于DHCL 0 μmol/L 组(P<0.05)。
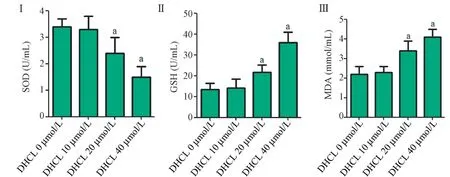
图6 DHCL 抑制SGC-7901 细胞抗氧化酶表达Note. Ⅰ, SOD. Ⅱ, GSH-Px. Ⅲ, MDA. Compared with DHCL 0 μmol/L group, aP<0.05.Figure 6 DHCL inhibits the expression of antioxidant enzymes in SGC-7901 cells
2.7 DHCL 促进SGC-7901 细胞内ROS 生成
DCFH-DA 探针检测结果显示(图7),DHCL 40 μmol/L 组和DHCL 20 μmol/L 组细胞内ROS 水平高于DHCL 0 μmol/L 组。
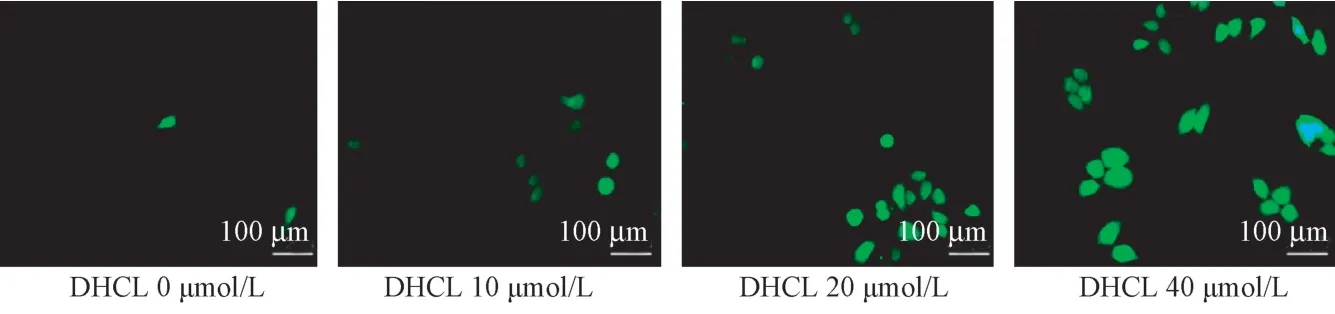
图7 DHCL 促进SGC-7901 细胞内ROS 生成Figure 7 DHCL promotes ROS production in SGC-7901 cells
2.8 DHCL 抑制裸鼠移植瘤生长
裸鼠移植瘤结果显示(图8),DHCL 组裸鼠移植瘤的质量低于对照组(P<0.05)。
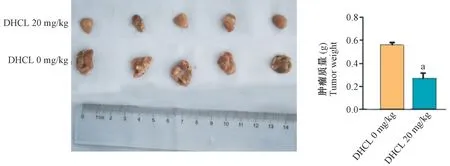
图8 DHCL 抑制裸鼠移植瘤生长Note. Compared with DHCL 0 mg/kg group, aP<0.05.Figure 8 DHCL inhibited the growth of xenograft tumor in nude mice
3 讨论
木香是一种草本植物药材,味苦,性温,归脾及胃,常用于治疗腹胀、消化不良、呕吐腹泻等消化道疾病[8]。 DHCL 是从云木香根中分离的一种天然倍半萜类化合物,具有抗肿瘤、抗氧化、抗炎、改善胃肠道功能等多种生物学作用,可以抑制多种肿瘤细胞的生长,发挥抗肿瘤作用[9]。 本研究探讨了DHCL 对胃癌细胞生长的影响,发现DHCL 对SGC-7901 细胞的抑制作用呈药物浓度依赖性,且当DHCL 浓度≥20 μmol/L 时,SGC-7901 细胞存活率明显下降,提示DHCL 可以以浓度依赖性的方式抑制SGC-7901 细胞增殖。 本研究中,DHCL 40 μmol/L 组和DHCL 20 μmol/L 组细胞p62 蛋白表达低于DHCL 0 μmol/L 组,Beclin1、LC3Ⅱ/LC3Ⅰ和ATG7蛋白表达和LC3 荧光斑点数高于DHCL 0 μmol/L组。 Beclin1 是一种自噬相关的抑癌基因,在自噬启动阶段发挥重要作用,在Bcl-2 等多种细胞因子作用下,可以与磷脂酞肌醇3 激酶结合,促进初期自噬吞噬小泡的形成[10]。 ATG7 具有泛素E1 样酶活性,可以参与形成前自噬体结构,还可以活化LC3-I,并将其转运至ATG3,催化形成LC3-II[11]。 LC3是一种自噬体标志蛋白,当细胞自噬发生时,LC3-I经过细胞内经泛素样加工修饰,再与磷脂酞乙醇胺结合,可以形成LC3-II,其LC3-II/LC3-I 比值可以敏感反映细胞的自噬活性[12],提示DHCL 可以呈剂量依赖性的增强SGC-7901 细胞自噬活性。 p62 是自噬过程的特异性降解底物,当细胞发生自噬时,p62 可以结合泛素化蛋白,再与膜LC3-II 蛋白结合形成复合物,最终通过自噬溶酶体途径降解,其表达水平与自噬活性呈反比[13]。 已有多项研究显示[14-15],自噬参与了肿瘤形成和死亡的各个阶段,早期自噬可以通过降解细胞内蛋白质和细胞器为肿瘤细胞提供能量资源,但持续增强的自噬可以抑制肿瘤细胞增殖,诱导细胞死亡,提示DHCL 可能通过增强SGC-7901 细胞自噬活性,发挥抗肿瘤作用。
本研究中,DHCL 40 μmol/L 组和DHCL 20 μmol/L 组细胞凋亡率高于DHCL 0 μmol/L 组,Bax/Bcl-2、 tBid/Bid、 cleaved Caspase-8/Caspase-8、cleaved Caspase-9/Caspase-9 和cleaved Caspase-3/Caspase-3 蛋白表达高于DHCL 0 μmol/L 组,且高剂量DHCL 诱导的细胞凋亡率略高于低剂量。 Bax/Bcl-2 是一组调控线粒体凋亡途径的蛋白,生理状态下,Bcl-2 位于线粒体膜表面,一旦细胞接收到凋亡信号刺激,细胞内的Bax 会转位至膜上与Bcl-2 结合,破坏线粒体结构,导致线粒体细胞色素C 释放入胞浆,激活Caspase 凋亡级联反应[16]。 tBid/Bid是一组连接内源性和外源性凋亡途径的凋亡蛋白。Caspase-8 主要调节外源性细胞凋亡途径,Caspase-9主要介导内源性细胞凋亡途径,均可以激活细胞凋亡效应蛋白Caspase-3 入核,降解细胞内的关键蛋白,诱导细胞凋亡[17]。 Huang 等[18]研究显示,外源性凋亡途径激活Caspase-8 后,活化的Caspase-8 可以促进Bid 剪切裂解为tBid,tBid 可以移位到线粒体中调节细胞色素C 释放,参与线粒体途径促进细胞凋亡,提示DHCL 可以以剂量依赖性的方式,调节细胞凋亡相关蛋白的表达,诱导胃癌细胞凋亡。
本研究中,DHCL 40 μmol/L 组和DHCL 20 μmol/L 组细胞SOD 和GSH-Px 水平低于DHCL 0 μmol/L 组,MDA 和ROS 水平高于DHCL 0 μmol/L组。 SOD 和GSH-Px 是细胞内重要的抗氧化酶,可以清除过多的ROS,维持细胞内氧化/抗氧化系统平衡[19]。 MDA 是脂质过氧化的中间产物,可以反映细胞内ROS 水平[20]。 ROS 是细胞内的一类具有高度氧化作用的小分子量物质,具有细胞毒性,可以破坏线粒体膜结构,激活Bax/Bcl-2 介导的线粒体凋亡途径,诱导肿瘤细胞凋亡[21]。 已有大量研究显示[22-23],线粒体内大量的ROS 还可以激活自噬,促进自噬活性,诱导Beclin1 表达,此外细胞内大量的ROS 还可以通过调节mTOR、MAPK 等信号通路表达,调节自噬过程,诱导肿瘤细胞的自噬性死亡。Cai 等[24]研究显示,DHCL 可以增加ROS 的产生,破坏线粒体膜结构,诱导人慢性髓系白血病细胞凋亡和自噬,提示DHCL 可能通过促进SGC-7901 细胞氧化应激活性,诱导胃癌细胞自噬和凋亡。 本研究中,DHCL 组裸鼠移植瘤的质量低于对照组,提示DHCL 可以抑制胃癌移植瘤的生长,发挥抗肿瘤作用。 Chen 等[25]研究显示,天然的生物活性化合物Celastrol 可以在体内外增加ROS 水平,导致癌细胞凋亡,发挥抗肿瘤作用。 Zhang 等[26]研究发现,DHCL 可以诱导喉癌细胞凋亡,对人正常喉上皮细胞HBE 的毒性作用较小,且在裸鼠体内器官未见明显毒性迹象。 结合本研究结果说明,DHCL 可能通过抗氧化作用,降低胃癌细胞ROS 水平,诱导胃癌细胞的凋亡,有望应用于临床治疗。
综上所述,DHCL 可以呈剂量依赖性的抑制SGC-7901 细胞增殖,促进细胞内ROS 产生,诱导细胞自噬性死亡和凋亡,抑制胃癌移植瘤的生长,有望应用于临床胃癌患者的治疗。 然而本研究尚处于基础研究阶段,尚需大量的临床试验来验证。

