两种造模方法建立大鼠冠脉微循环障碍模型比较研究
李 磊,孟红旭,付建华,金 龙,马彦雷,史 跃,刘建勋
(中国中医科学院西苑医院基础医学研究所,国家中医心血管病研究中心,中药药理北京市重点实验室,北京 100091)
冠心病是严重威胁现代人类生命和健康、危害极大的疾病,随着我国社会经济迅速发展,人口老龄化及城镇化进程加速,我国冠心病发病人数持续增加。 长期以来,冠状动脉主干狭窄所致的心肌供血不足被认为是冠心病的主要病因,经皮冠脉造影检查被认为是诊断冠心病的“金标准”,然而约20%~30%因胸痛接受冠脉造影检查的患者并无明显的冠状动脉主干和主要分支狭窄或闭塞,这种胸痛被认为与冠状动脉微血管功能异常有关,故称为微血管性心绞痛或心脏X 综合征[1]。 虽然经皮冠状动脉介入治疗(PCI)可以重建心外膜冠状动脉血流供应,明显改善急性心肌梗死降低冠心病死亡率,但是PCI 术后常伴随出现冠脉缓慢血流(slow flow)或无复流(no reflow),临床观察这部分患者并未从PCI 治疗中受益,梗死区域冠状动脉微血管病变被认为是心肌无法恢复正常血液灌注的主要限制因素[2]。 在对微血管性心绞痛、PCI 术后无复流现象以及肥厚性心肌病等疾病研究的深入,研究者发现这类疾病的共同发病机制与冠状动脉微循环功能障碍(coronary microvascular dysfunction,CMD)密切相关[3]。 冠状动脉微循环障碍通常是指发生于直径小于300 μm 心脏血管的结构和功能改变[4]。 目前,CMD 发病机制仍然没有完全被阐明,一般认为血管内皮损伤、血管平滑肌功能异常,机械性压迫、冠脉微栓塞以及缺血再灌注损伤等与CMD 的发生密切相关。 不论何种原因导致的CMD,最终也会和心外膜冠脉狭窄一样导致心肌耗氧的供需失衡,引起临床症状并影响心血管疾病的诊疗和预后[5]。
冠状动脉微循环障碍模型动物是研究冠状动脉微循环障碍类疾病发展转归及评价药物治疗作用必不可少的工具。 根据冠脉微循环障碍的类型不同和实验操作的可能,冠脉微循环障碍动物模型的建立常见的方法有在冠脉内或心室内注射微栓塞剂、缺血再灌注损伤、糖尿病或高血压等心肌病伴随微循环障碍等[6-7]。 栓塞剂注射法具有治病因素单一、可控的优势,常常用于建立急性期的冠脉微循环障碍动物模型,根据栓塞剂的不同可分为微球机械性栓塞法、自体微血栓法和化学损伤内皮法[8]。 化学损伤法一般在大鼠上应用,通过心室内或主动脉根部注射月桂酸钠,由于月桂酸钠具有强烈的内皮损伤作用,能够诱发血小板黏附、聚集、形成微血栓,而较大动脉内无明显血栓形成[9]。 微球栓塞法多在小型猪、犬等大动物上应用,多在介入造影辅助下,采用超选择性冠脉内注射微球[10-11]。自体血栓栓塞法由于制备过程较复杂,发病机理较复杂,使用并不是很广泛。 目前,应用大鼠建立冠脉微循环障碍模型的报道较少,月桂酸钠损伤法与微球栓塞法建立模型比较研究尚未见报道。 因此,本研究旨在比较月桂酸钠损伤内皮法与微球栓塞法冠脉微循环障碍模型的差异,确定病变程度适合的造模条件,为疾病发生过程及治疗药物作用机理研究提供实验基础。
1 材料和方法
1.1 实验动物
健康SPF 级雄性SD 大鼠30 只,体重(340±20)g,由斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010]提供。 动物实验操作及饲养均在中国中医科学院西苑医院实验动物中心进行[SYXK(京)2018-0018]。 实验动物及实验步骤符合国家实验动物管理条例。 该研究经中国中医科学院西苑医院动管理委员会批准实验(2020XLC007-2),实验动物处置均符合国家科委2011 年修订的《实验动物管理条例》,并遵循:“减少、替他和优化”3R原则给予人道的关怀。
1.2 主要试剂与仪器
月桂酸钠购于美国SIGMA 公司;40~120 μm栓塞微球购于美国Merit Medical 公司;肌酸激酶(CK)、肌酸激酶MB 同工酶(CK-MB)以及乳酸脱氢酶(LDH)测定试剂盒购于和光纯耀(上海)化学有限公司;硫酸阿托品注射液购买于上海禾丰制药有限公司;肝素钠注射液购于常州千红生化制药股份有限公司;本实验其他药物及器材均为实验室常规器材。
DW-3000S 型双通道小动物呼吸机,安徽正华生物仪器设备有限公司;Visual Sonics Vevo2100 系高分辨率小动物超声影像系统、MS-201 高频线阵探头(Fujifilm,日本)公司;MP-150 型多导生理记录仪、TSD104 型血压换能器、 DA100C 放大器及AcqKonwleage 4.1 数据采集软件(BioPac,美国);LABOSPECT003 型全自动生化分析仪(Hitachi,日本)。
1.3 实验方法
1.3.1 动物模型制备
30 只SD 雄性大鼠,随机分为假手术组、月桂酸钠组和微球栓塞组,每组10 只动物。 大鼠常规麻醉后胸前区备皮。 为防止分泌物对呼吸管影响,于术前10 min 腹腔硫酸注射阿托品注射液。 大鼠取仰卧位固定于手术板上,把头颈部拉直固定,先将手术板底部固定,将大鼠头部侧上台至45°倾角并固定,用小儿麻醉咽喉镜(压舌板前段切去一半宽度)观察大鼠声门,用心血管介入用导引钢丝趁大鼠吸气声门打开时插入气管,在导引钢丝的导引下将气管插管送入起到气道,退出导引钢丝。 将一面小镜子放于气管插管口,若见镜面上随大鼠呼吸运动有水雾出现,则为插管在气道内,将气管插管与小动物呼吸机连结。
于左前外侧沿胸骨左侧缘纵向切开皮肤,钝性分离肌层,打开大鼠胸腔,暴露第4 肋中部并纵向剪断,以垂直肋骨方向放置大鼠开胸器,轻轻剪开心包膜的心脏部位充分暴露[9]。 仔细分离主动脉弓,并在其下穿一棉线,令大鼠稳定10 min 后,将棉线两端提起并用血管夹夹闭主动脉,迅速以注射器从心尖部直接向左心室注射0.2 mL 的栓塞微球(微球直径40~120 μm,约含1000 个微球)或月桂酸钠(1 g/L,生理盐水溶解),注射前要回抽血以确保针尖在心腔中,夹闭20 s 后,松开血管夹,待呼吸心跳稳定后,彻底止血、逐层缝合肌肉和皮肤,最后关闭胸腔,见图1。 拔除气管插管,术毕腹腔注射80 万单位青霉素,普通饲养。 假手术组手术过程采用同样的操作,区别仅在于心室内注射0.2 mL 生理盐水。 术后24 h 再次麻醉动物测定相关指标处死取材。

图1 大鼠冠脉微循环障功能碍模型建立Figure 1 Establishment of rat model of coronary microcirculation dysfunction
1.3.2 超声心动图检测心功能
动物术后24 h,按1 mL/100 g 剂量腹腔注射0.3%戊巴比妥钠溶液麻醉,大鼠麻醉后取仰卧位固定。 当大鼠心律趋于持续性、稳定性时开始检测,在进行超声心动图检查时要注意观察大鼠的呼吸状态,如出现明显呼吸抑制应终止检查,进行呼吸支持。 以高频探头进行定位,在左室长轴及胸骨旁短轴各切面应用M 模式超声心动图观察心脏运动,选用左室长轴切面计算左室舒张末期内径(LVIDd)、左室收缩末期内径(LVIDs)、左室舒张末期容积(LVEDV)、左室收缩末期容积(LVESV)、左室射血分数(EF)、左室缩短率(FS),各项指标均选取连续测量5 个心动周期测量值的平均值[12]。
1.3.3 血流动力学检测
将麻醉稳定的大鼠仰卧位固定,颈部备皮,分离右颈总动脉,结扎远心端,动脉夹夹住近心端,经右颈动脉穿刺插入20 G 静脉留置针,撤去动脉夹,将肝素化留置针送入大鼠颈总动脉。 留置针连接压力换能器,经MP-150 型多导生理记录仪连接电脑,通过AcqKnowledge 软件实时显示压力变化曲线。 待大鼠状态稳定后,测定动脉收缩压(SBP)和舒张压(SDP),计算平均动脉(MAP)。 测定完动脉血压后,轻柔将留置针插入右心室腔,当留置针突然随心脏搏动抖动明显时,应减缓推送速度。 当软件显示由血压波变为下达0 mmHg 附近时,表明留置针已经通过主动脉瓣进入左心室腔内[13]。 记录心脏血流动力学指标:左室峰压(LVSP)、左室舒张末压(LVEDP)、左室内压最大上升速率(LV+dp/dtmax)、左室内压最大下降速率(LV-dp/dtmax)。 体表标准II 导心电图计算心率(HR)。
1.3.4 血清CK、CK-MB 和LDH 活性检测
大鼠测定完血流动力学指标及超声心动图之后,腹主动脉取血4 mL,室温静置1 h 后,2500 r/min,离心10 min,取上清,采用生化分析法检测肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)和乳酸脱氢酶LDH 活性。
1.3.5 病理HE 染色
取大鼠心脏组织于4 %多聚甲醛中固定24 h,石蜡包埋,连续切片(5 μm),苏木精-伊红染色,光镜下观察心肌组织改变。
1.4 统计学方法
实验数据采用平均数±标准差() 表示,应用SPSS 18.0 软件进行统计分析,采用One-way ANOVA(单因素方差分析)方法,方差齐性应用Student-Newman-Keuls(SNK)检验,方差不齐采用Tamhane’s T2 检验。P<0.05 为有统计学意义。
2 结果
2.1 对大鼠超声心动图的影响
与假手术组比较,微球栓塞组左室收缩末期内径(LVIDs)明显增加、LVIDs,左室收缩末期容积(LVESV)明显增加,每搏输出量(SV)显著减少(P<0.05),见表1;左室射血分数(EF)、左室缩短率FS显著降低约(P<0.01)。 提示经左心室注射40~120 μm 栓塞微球,造模24 h 后可以明显降低动物心功能。 与假手术组比较月桂酸钠组各项超声心动图指标未见明显统计学差异(图2、表1)。

表1 大鼠超声心动图指标的变化Table 1 Changes of echocardiography parameters in rats

图2 对大鼠超声心动图变化Note. A, Sham group. B, Laurate group. C, Microsphere group.Figure 2 Changes of echocardiography in rats
2.2 对大鼠心脏血流动力学的影响
月桂酸钠组和微球栓塞组大鼠动脉收缩压、舒张压及平均动脉压略低于假手术组,各组间未见统计学差异;大鼠心率在各组间未见明显差异(数据略)。 月桂酸钠组和微球栓塞组大鼠左室峰压略低于假手术组,各组间未见统计学差异;各组间左室舒张末压未明显差异;微球栓塞组左室内压最大上升速率明显低于假手术组,两组间比较有统计学差异,P<0.05,月桂酸钠组与假手术组未见明显差异。各组间左室内压最大下降速率未见统计学差异(图3、图4)。
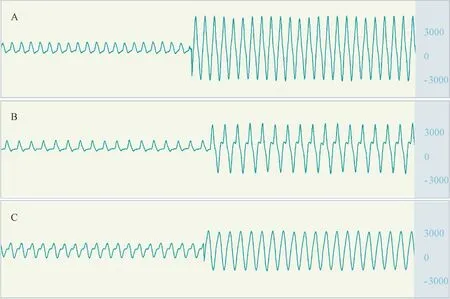
图3 大鼠左室内压变化速率Note. Anterior portion indicate the change rate of arterial blood pressure, posterior portion indicate the change rate of left ventricular internal pressure. A, Sham group. B, Laurate group.C, Microsphere group.Figure 3 Changes rate of left ventricular pressure in rats

图4 大鼠心室内压改变Note. A, Sham group. B, Laurate group. C, Microsphere group. Compared with the sham group,∗P<0.05.Figure 4 Changes of left ventricular pressure in rats
2.3 对大鼠血清CK、CK-MB 和LDH 的影响
与假手术比较,两种造模方法均可以升高大鼠血清CK、CK-MB、LDH 活性,然而月桂酸钠组与假手术组比较未见统计学差异。 微球栓塞组可以显著升高CK-MB 与LDH 活性与假手术比较有统计学差异(P<0.05),见表2。

表2 大鼠心肌酶的变化Table 2 Changes of myocardial enzymes in rats
2.4 对大鼠心肌HE 染色影响
HE 染色见假手术组大鼠心肌纤维排列整齐,心肌细胞胞浆丰富,细胞核形态规则。 月桂酸钠组大鼠心肌细胞均呈现不同程度的溶解、断裂;心肌间不同程度的淋巴细胞、嗜酸性粒细胞和中性粒细胞浸润,心肌内微血栓形成。 微球栓塞组心脏病变同月桂酸钠组相似,均出现不同程度的心肌溶解、断裂;心肌间淋巴细胞浸润和纤维组织增生,心脏外膜可见不同程度的充血,炎细胞浸润,并可见微球栓塞(图5)。

图5 大鼠心脏组织HE 染色变化Note. A, Sham group. B, Laurate group. C, Microsphere group. Black arrow indicates microthrombosis. Red arrow indicates microsphere embolism.Figure 5 Changes of HE staining in rat heart tissue
3 讨论
冠状动脉微栓塞是引起冠脉微循环障碍的重要原因,建立冠脉微栓塞的动物模型是探讨冠脉微循环障碍发生、发展病理生理过程、研究药物作用及机制的重要实验平台[14]。 本实验分别对两种不同造模方法建立的冠脉微循环障碍模型进行了研究,结果显示通过心室内注射月桂酸钠注射后可以损伤血管内皮形成微血栓,栓塞微球则直接以物理栓塞的方式导致微血管栓塞,两种造模方法均可以造成冠脉微循环障碍,对大鼠心脏功能有一定影响。 栓塞微球较月桂酸钠造模更加稳定,在模型建立后24 h 可见明显心功能降低、血流动力学改变及心肌酶升高。
制作冠脉微栓塞动物模型的栓塞剂(致栓剂)主要有月桂酸钠、栓塞微球、自体血栓等。 自体血栓虽然符合临床微血栓栓子特点,但制备相对复杂,且凝固后研磨成的颗粒状栓子的数量和大小不均,不能模拟血管内皮损伤后始动的病变,在实验研究中的应用并不多。 月桂酸钠可导致血管内膜损伤、脱落、穿孔,促进血小板粘附、聚集,形成闭塞性血栓造成冠脉微循环阻塞,而较大的动脉内无明显血栓形成,较自体血栓法更加接近实际病理发展过程[15];该法的主要缺点在于不是临床上冠脉微循环血栓形成的常见病因。 有文献报道,100 μg 月桂酸钠冠脉内注射时几乎形成不了冠脉微血栓,而200 μg 月桂酸钠在冠脉注射1 h 后即有微小动脉血栓形成,3 h 后达到高峰,在此后的12~24 h 逐渐降低[16]。 本研究采用的月桂酸钠剂量为200 μg,注射24 h 后在100 μm 以下的微血管可见微血栓形成,而模型24 h 时血流动力学、心功能及心肌酶等指标与假手术组比较未见明显差异,这可能与微血管血栓形成减少有关。
经冠脉内注射栓塞微球是建立大动物冠脉微循环障碍的常用方法,栓塞微球形成微栓塞机制与临床上冠脉血运重建术后微血栓、内皮细胞内皮脱落、动脉粥样硬化斑块破裂碎片脱落后,随血流至冠脉微血管致栓塞原理类似。 由于大鼠心脏较小无法使用临床心导管介入技术将栓塞微球超选择注射到冠脉里,通常使用心室内注射栓塞微球,暂短夹闭主动脉的方法建立冠脉微栓塞导致的冠脉微循环障碍模型[17-18]。 临床尸检显示心脏性猝死中微血管栓塞89%发生于小120 μm 的血管,在小于120 μm 的血管栓塞中39%发生于小于40 μm 的微血管,46%发生于40~80 μm 的微血管,15%发生于81~120 μm 的微血管[19]。 因此,冠脉微循环障碍动物模型通常采用42 μm 微球或40~120 μm 混合微球冠脉内注射模拟临床冠脉微血管栓塞,大鼠实验中常采用心室内注射1000~3000 个微球进行造模[20-21]。 本研究采用了40~120 μm 混合栓塞微球约1000 个进行了心室内注射造模,造模术后24 h后可见栓塞微球阻塞,与假手术比较可以明显降低左室内压最大上升速率、降低实验动物心功能降低超声心动图EF 和FS 值等,升高心肌损伤指标CKMB 和LDH。
与假手术组比较,月桂酸钠组与微球栓塞组动物心脏组织病理HE 染色,并未见大量的坏死心肌细胞、炎细胞浸润等严重的心肌组织受损,这可能与造模为微血管损伤并未损伤大血管的血供,组织可以从邻近的微血管获取血供,以及造模时间较短(24 h)有关,之后研究将进一步探索适合冠脉微循环障碍评价的病理染色方法。
综上所述,本研究所用的心室内注射月桂酸钠及栓塞微球两种造模方法均可以造成冠脉微循环障碍,对大鼠心脏功能有一定影响。 两种造模方式导致冠脉微循环障碍的程度有所不同,微球栓塞法较月桂酸钠法建立的动物模型关键指标更加稳定,可广泛应用于冠脉微循环障碍的发病机制、药物治疗作用等研究。

