基于NOS 通路探讨DAHP 对脑外伤大鼠的神经保护作用
倪礼礼,姚 佳,汪学猛,杜 煜
(1.洛阳职业技术学院食品与药品学院,河南 洛阳 471900;2.信阳职业技术学院药学院,河南 信阳 464000)
脑外伤属于临床常见颅脑损伤类型之一,通常会造成患者行为、精神、记忆学习等方面功能障碍,具有较高的致死率和致残率,严重影响患者生活质量[1]。 脑外伤机制较复杂,主要涉及神经损伤、脑水肿、血脑屏障等,目前尚未有统一定论。 一氧化氮(nitric oxide,NO)属于神经介质,正常状态下少量NO 可调节血流、扩张血管,而过量的NO 则会对神经细胞产生毒性[2]。 研究发现脑损伤后可激活一氧化氮合酶(nitric oxide synthase,NOS)生成大量的NO,进而加重神经损伤[3]。 2,4-二胺-6-羟基嘧啶(2,4-diamino-6-hydroxypyrimidine,DAHP)为三磷酸鸟苷环化水解酶 1 ( guanosine triphosphate cyclohydrolase 1,GCH1)抑制剂,可通过抑制GCH1的合成进而降低诱导型一氧化氮合酶(iNOS)的表达,影响NO 的合成,然而其在脑损伤中的作用研究不多[4]。 本研究通过复制脑外伤模型大鼠,并给予DAHP 干预,旨在探究其对脑外伤大鼠的神经保护作用及可能的作用机制。
1 材料和方法
1.1 实验动物
70 只SPF 级SD 健康大鼠,雄性,8 周龄,体重(200±20)g,由河南环宇康禾生物科技有限公司提供[SCXK(豫)2020-0004],动物饲养在洛阳职业技术学院食品与药品学院实验室[SYXK(豫)2020-0027],湿度(40±10)%,温度(22±3)℃,采用昼夜交替12 h 光照,期间大鼠自由饮食、饮水,一周后用于造模,实验遵循3R 原则。 本研究经洛阳职业技术学院伦理委员会批准(LDS2020024)。
1.2 主要试剂与仪器
DAHP(购自美国Cayman 公司,批号:81260-1);四氢生物蝶呤(tetrahydrobiopterin,BH4)(购自美国MCE 公司,批号:HY-107383);苏木素-伊红(HE)染色试剂盒(购自碧云天生物技术有限公司,批号:C0105);Tunel 细胞凋亡检测试剂盒(购自美国ROCHE 公司,批号:11684817910);NO 检测试剂盒(购自美国Solarbio 公司,批号:BC147);BCA 蛋白检测试剂盒(购自美国Thermo Scientific 公司,批号:23225);兔抗鼠神经型一氧化氮合酶(nNOS)、iNOS、β-肌动蛋白(β-actin)一抗(购自美国Sigma公司,批号:SAB4502010、SAB4502012、A5441);兔抗鼠核因子-κB(NF-κB)、肿瘤坏死因子-α(TNFα)、环氧化酶-2(COX-2)一抗(购自美国R&D 公司,批号:MAB5078、AF-425-PB、AF4198);兔抗鼠半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、B 淋巴细胞瘤-2 基因(Bcl-2)一抗、辣根过氧化物酶(HRP)标记二抗(购自英国Abcam 公司,批号:ab179517、ab185002、ab10032);光学显微镜(购自日本奥林巴斯公司,型号:IX51);荧光显微镜(购自舜宇光学科技集团有限公司,型号:CX40);酶标仪(购自美国BioTek 公司,型号:Synergy NEO2);凝胶成像仪(购自德国Royal 公司,型号:Gel IX Imager)。
1.3 实验方法
1.3.1 模型制备
随机挑选58 只大鼠进行造模,另选取12 只大鼠作为假手术组,参照改良Feeney 法制备脑挫伤大鼠[5],自制打击器,将打击器在大鼠脑表面上方垂直固定,将打击器沿着金属套管自30 cm 高度垂直落下打击大鼠头部,造成右侧脑半球脑挫裂伤。 造模后2 h,待大鼠清醒后根据Longa 等[6]神经功能缺损评定标准对大鼠神经功能进行评定,将评分2~3 分大鼠纳入模型,剔除操作不当、未成功大鼠,造模成功大鼠48 只。 假手术组仅打开骨窗不采取打击器打击。
1.3.2 动物分组与给药
将造模成功大鼠随机分为模型组、DAHP 组、NOS 激活剂组(BH4 组)、DAHP+BH4 组,每组12只。 DAHP 组:造模后2 h 尾静脉注射0.5 g/kg 的DAHP[7];BH4 组:造模后2 h 尾静脉注射0.3 mg/kg 的BH4[8],DAHP+BH4 组:造模后2 h 尾静脉注射0.5 g/kg 的DAHP 与0.3 mg/kg 的BH4;假手术组、模型组均注射等量生理盐水;注射体积均为10 mL/kg,各组每天给药1 次,连续处理1 周。
1.3.3 定位航行、空间探索实验评估大鼠行为学
末次处理后,评估大鼠行为学。 将水池4 象限中点作为入水点,将大鼠从随意象限放入水池面对池壁,记录大鼠寻找逃避平台的时间,为逃避潜伏期。 撤去逃避平台,将大鼠从原平台对侧放入水池中,连续记录游泳120 s 内在各象限所用时间,计算原平台象限游泳时间与逃避潜伏期比例,即为空间探索时间比例。
1.3.4 HE 染色观察大鼠脑组织形态学变化
行为学评估结束后,将大鼠处死,获取全脑组织,在4%多聚甲醛中过夜固定后,取损伤区,制备脑组织石蜡切片,厚度为3 μm,参考HE 染色试剂盒对切片进行染色,经乙醇脱水、二甲苯透明、树胶封片后,在光学显微镜下观察脑组织形态学变化。
1.3.5 Tunel 染色观察脑组织细胞凋亡
制备脑组织冰冻切片,添加蛋白酶K 溶液室温下孵育10 min,清洗后,添加TdT 缓冲液孵育20 min,避光添加Tunel 工作液孵育1 h,清洗后封片,置于荧光显微镜下观察细胞染色情况。 用Image-Pro 软件定量分析脑组织细胞凋亡率=绿色荧光细胞数/细胞总数×100%。
1.3.6 脑组织中NO 水平的测定
将脑组织剪切为碎块后,添加9 倍体积生理盐水,置于匀浆器内匀浆,采用Griess 法检测脑组织NO 水平。
1.3.7 免疫印迹法检测脑组织中蛋白表达
TRIzol 法提取脑组织总蛋白,BCA 法检测蛋白含量,统一定量30 μg 进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,将蛋白转移至PVDF 膜上,经5%脱脂奶粉封闭后加入nNOS、iNOS、NF-κB、TNF-α、COX-2、 Caspase-3、 Bcl-2、 β-actin 一 抗(均 为1 ∶1000),4℃过夜孵育后,用HRP 标记二抗(1 ∶5000)37℃孵育膜2 h,添加ECL 显色液曝光后,用凝胶成像系统采集图像,以β-actin 作为内参,定量评估各蛋白相对表达水平。
1.4 统计学方法
采用SPSS 21.0 软件进行数据统计分析,计量资料以平均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠行为学比较
与假手术组相比,模型组逃避潜伏期延长,空间探索时间比例降低(P<0.05);与模型组相比,DAHP 组逃避潜伏期缩短,空间探索时间比例升高,BH4 组逃避潜伏期延长,空间探索时间比例降低(P<0.05);DAHP+BH4 组逃避潜伏期短于BH4 组,空间探索时间比例高于BH4 组(P<0.05)。 见表1。
表1 各组大鼠逃避潜伏期、空间探索时间比例比较(±s,n=12)Table 1 Comparison of escape latency and proportion of space exploration time of rats in each group

表1 各组大鼠逃避潜伏期、空间探索时间比例比较(±s,n=12)Table 1 Comparison of escape latency and proportion of space exploration time of rats in each group
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与DAHP 组相比,cP<0.05;与BH4 组相比,dP<0.05。Note. Compared with sham operation group, aP<0.05. Compared with model group, bP < 0.05. Compared with DAHP group, cP < 0.05.Compared with BH4 group, dP<0.05.
组别Groups逃避潜伏期(s)Escape latency空间探索时间比例(%)Proportion of space exploration time假手术组Sham operation group 37.47±4.64 58.65±4.51模型组Model group 61.64±8.75a 37.18±3.46a DAHP 组DAHP group 45.24±4.68ab 44.89±3.42ab BH4 组BH4 group 72.16±7.43abc 29.87±3.41abc DAHP+BH4 组DAHP+BH4 group 62.58±8.13acd 36.11±4.38acd
2.2 DAHP 对大鼠脑组织形态学的影响
假手术组脑组织神经细胞形态正常,排列有序,细胞核着色均匀;模型组神经细胞发生肿胀、变形、细胞核固缩,着色加深,坏死细胞增多,伴有炎性细胞浸润;与模型组相比,DAHP 组神经细胞组织形态得到一定缓解,坏死细胞减少,炎性浸润程度减轻,BH4 组坏死神经细胞数量增多,细胞核固缩,染色变深,损伤程度加重,DAHP+BH4 组细胞形态变化不显著。 见图1。
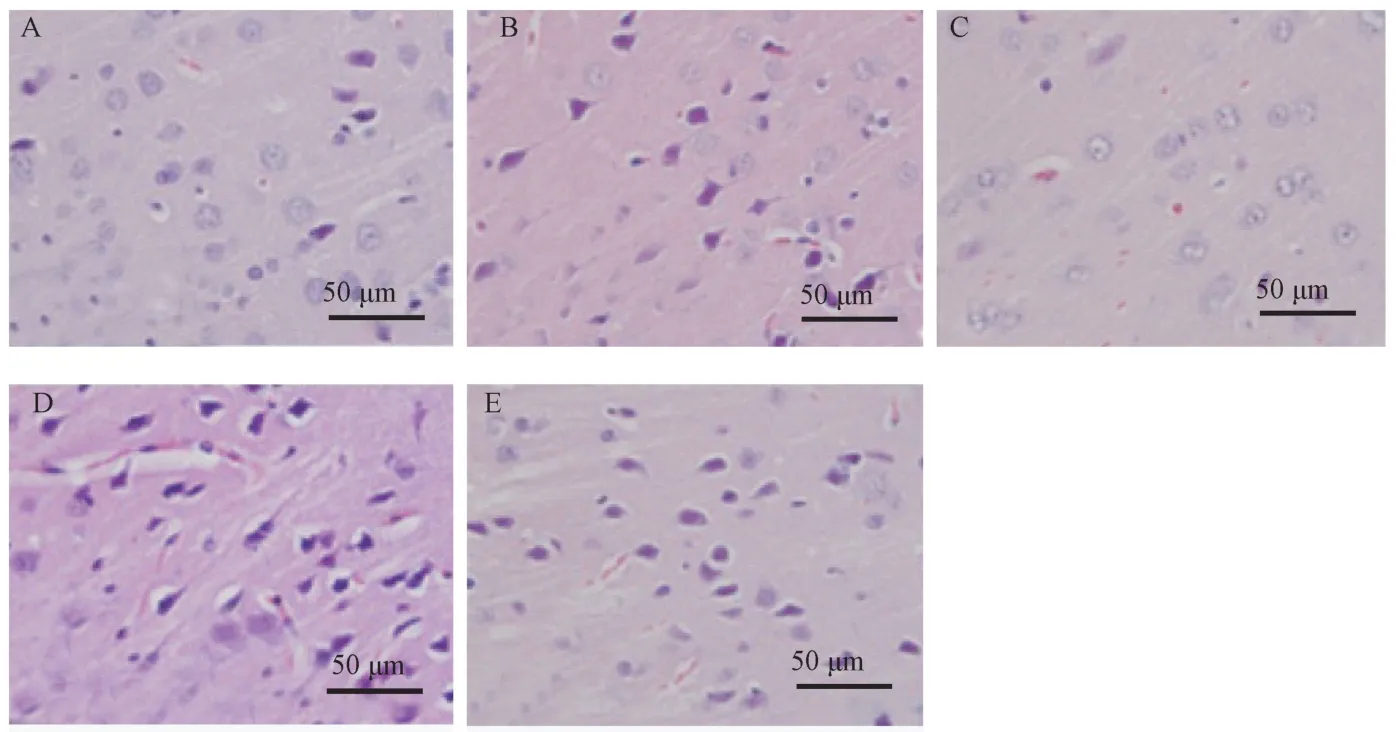
图1 HE 染色检测脑组织形态学变化Note. A, Sham operation group. B, Model group. C, DAHP group. D, BH4 group. E, DAHP+BH4 group.Figure 1 HE staining was used to detect the morphological changes of brain tissue
2.3 DAHP 对大鼠脑组织细胞凋亡的影响
与假手术组相比,模型组大鼠脑组织细胞凋亡率升高(P<0.05);与模型组相比,DAHP 组大鼠脑组织细胞凋亡率降低,BH4 组大鼠脑组织细胞凋亡率升高(P<0.05);DAHP+BH4 组大鼠脑组织细胞凋亡率低于BH4 组(P<0.05)。 见图2 和表2。

图2 Tunel 染色检测脑组织细胞凋亡情况Note. A, Sham operation group. B, Model group. C, DAHP group. D, BH4 group. E, DAHP+BH4 group.Figure 2 Tunel staining was used to detect apoptosis in brain tissue
表2 各组大鼠脑组织细胞凋亡率比较(±s,n=12)Table 2 Comparison of apoptosis rate of brain tissue in each group

表2 各组大鼠脑组织细胞凋亡率比较(±s,n=12)Table 2 Comparison of apoptosis rate of brain tissue in each group
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与DAHP 组相比,cP<0.05;与BH4 组相比,dP<0.05。Note. Compared with sham operation group, aP<0.05. Compared with model group, bP < 0.05. Compared with DAHP group, cP < 0.05.Compared with BH4 group, dP<0.05.
组别Groups 凋亡率(%)Apoptosis rate假手术组Sham operation group 0模型组Model group 38.19±4.36a DAHP 组DAHP group 27.87±3.64ab BH4 组BH4 group 47.64±4.97abc DAHP+BH4 组DAHP+BH4 group 38.73±4.13acd
2.4 DAHP 对大鼠脑组织NOS 通路的影响
与假手术组相比,模型组大鼠脑组织nNOS、iNOS 蛋白表达、NO 水平升高(P<0.05);与模型组相比,DAHP 组大鼠脑组织nNOS、iNOS 蛋白表达、NO 水平降低,BH4 组大鼠脑组织nNOS、iNOS 蛋白表达、NO 水平升高(P<0.05);DAHP+BH4 组大鼠脑组织nNOS、iNOS 蛋白表达、NO 水平低于BH4 组(P<0.05)。 见图3 和表3。
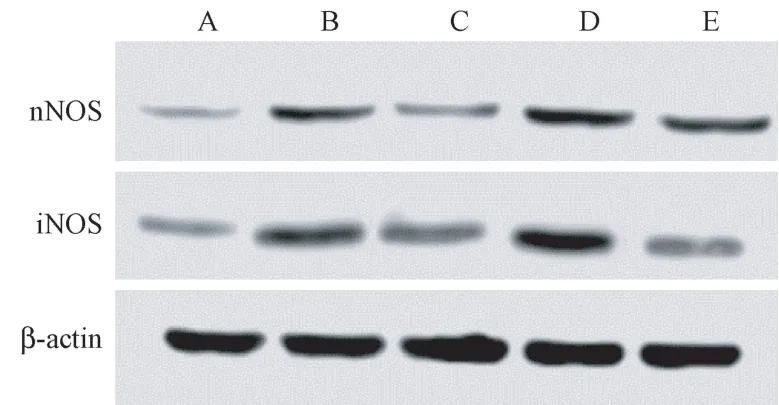
图3 免疫印迹法检测大鼠脑组织中nNOS、iNOS 蛋白表达Note. A, Sham operation group. B, Model group. C,DAHP group. D, BH4 group. E, DAHP+BH4 group.Figure 3 Western blot was used to detect the protein expression of nNOS and iNOS in rat brain
表3 各组大鼠脑组织中nNOS、iNOS、NO 水平比较(±s,n=12)Table 3 Comparison of nNOS, iNOS and NO levels in brain tissue of rats in each group

表3 各组大鼠脑组织中nNOS、iNOS、NO 水平比较(±s,n=12)Table 3 Comparison of nNOS, iNOS and NO levels in brain tissue of rats in each group
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与DAHP 组相比,cP<0.05;与BH4 组相比,dP<0.05。Note. Compared with sham operation group, aP<0.05. Compared with model group, bP<0.05. Compared with DAHP group, cP<0.05. Compared with BH4 group, dP<0.05.
组别Groups nNOS/β-actin iNOS/β-actin NO(μmol/L)假手术组Sham operation group 0.19±0.03 0.21±0.04 1.03±0.03模型组Model group 0.38±0.05a 0.82±0.08a 1.64±0.11a DAHP 组DAHP group 0.26±0.04ab 0.51±0.05ab 1.39±0.05ab BH4 组BH4 group 0.51±0.06abc 1.04±0.13abc 1.92±0.07abc DAHP+BH4 组DAHP+BH4 group 0.40±0.05acd 0.79±0.08acd 1.62±0.12acd
2.5 DAHP 对大鼠脑组织炎性因子NF-κB、TNFα、COX-2 的影响
与假手术组相比,模型组大鼠脑组织NF-κB、TNF-α、COX-2 蛋白表达升高(P<0.05);与模型组相比,DAHP 组大鼠脑组织NF-κB、TNF-α、COX-2 蛋白表达降低,BH4 组大鼠脑组织NF-κB、TNF-α、COX-2 蛋白表达升高(P<0.05);DAHP+BH4 组大鼠脑组织NF-κB、TNF-α、COX-2 蛋白表达低于BH4组(P<0.05)。 见图4 和表4。

图4 免疫印迹法检测脑组织中NF-κB、TNF-α、COX-2 蛋白表达Note. A, Sham operation group. B, Model group. C,DAHP group. D, BH4 group. E, DAHP+BH4 group.Figure 4 Western blot was used to detect the protein expression of NF-κB, TNF-α and COX-2 in brain tissue
表4 各组大鼠脑组织中NF-κB、TNF-α、COX-2 蛋白表达比较(±s,n=12)Table 4 Comparison of protein expression of NF-κB, TNF-α and COX-2 in brain tissue of rats in each group

表4 各组大鼠脑组织中NF-κB、TNF-α、COX-2 蛋白表达比较(±s,n=12)Table 4 Comparison of protein expression of NF-κB, TNF-α and COX-2 in brain tissue of rats in each group
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与DAHP 组相比,cP<0.05;与BH4 组相比,dP<0.05。Note. Compared with sham operation group, aP<0.05. Compared with model group, bP<0.05. Compared with DAHP group, cP<0.05. Compared with BH4 group, dP<0.05.
组别Groups NF-κB/β-actin TNF-α/β-actin COX-2/β-actin假手术组Sham operation group 0.16±0.03 0.15±0.03 0.16±0.03模型组Model group 0.95±0.09a 0.61±0.07a 0.66±0.09a DAHP 组DAHP group 0.33±0.04ab 0.28±0.05ab 0.43±0.08ab BH4 组BH4 group 1.14±0.11abc 0.89±0.12abc 0.87±0.07abc DAHP+BH4 组DAHP+BH4 group 0.97±0.07acd 0.63±0.09acd 0.68±0.06acd
2.6 DAHP 对大鼠脑组织凋亡蛋白表达的影响
与假手术组相比,模型组大鼠脑组织Caspase-3蛋白表达升高,Bcl-2 蛋白表达降低(P<0.05);与模型组相比,DAHP 组大鼠脑组织Caspase-3 蛋白表达降低,Bcl-2 蛋白表达升高,BH4 组大鼠脑组织Caspase-3 蛋白表达升高,Bcl-2 蛋白表达降低(P<0.05);DAHP+BH4 组大鼠脑组织Caspase-3 蛋白表达低于BH4 组,Bcl-2 蛋白表达高于BH4 组(P<0.05)。 见图5 和表5。
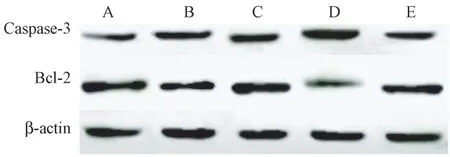
图5 免疫印迹法检测大鼠脑组织中凋亡蛋白表达情况Note. A, Sham operation group. B, Model group. C,DAHP group. D, BH4 group. E, DAHP+BH4 group.Figure 5 Western blot was used to detect the expression of apoptotic protein in rat brain
表5 各组大鼠脑组织中Caspase-3、Bcl-2 蛋白表达比较(±s,n=12)Table 5 Comparison of Caspase-3 and Bcl-2 protein expression in brain tissue of rats in each group
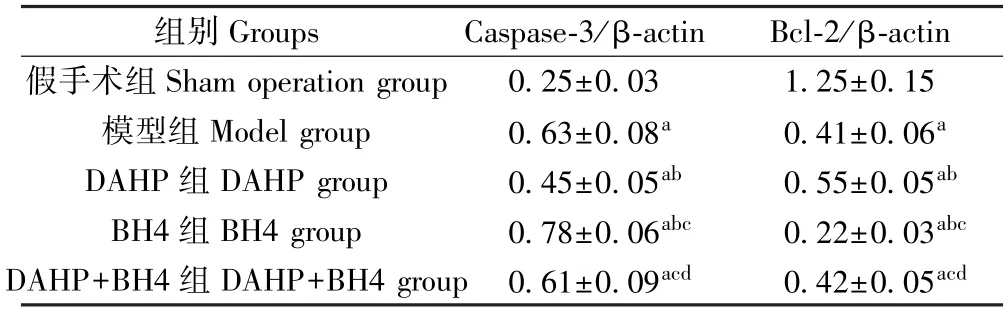
表5 各组大鼠脑组织中Caspase-3、Bcl-2 蛋白表达比较(±s,n=12)Table 5 Comparison of Caspase-3 and Bcl-2 protein expression in brain tissue of rats in each group
注:与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与DAHP 组相比,cP<0.05;与BH4 组相比,dP<0.05。Note. Compared with sham operation group, aP<0.05. Compared with model group, bP < 0.05. Compared with DAHP group, cP < 0.05.Compared with BH4 group, dP<0.05.
组别Groups Caspase-3/β-actin Bcl-2/β-actin假手术组Sham operation group 0.25±0.03 1.25±0.15模型组Model group 0.63±0.08a 0.41±0.06a DAHP 组DAHP group 0.45±0.05ab 0.55±0.05ab BH4 组BH4 group 0.78±0.06abc 0.22±0.03abc DAHP+BH4 组DAHP+BH4 group 0.61±0.09acd 0.42±0.05acd
3 讨论
继发性脑损伤后短时间内,脑组织中会出现的大量炎性细胞浸润,组织中炎症反应会进一步加重脑损伤程度,此外脑损伤后脑组织出现缺血、缺氧,造成细胞代谢异常,引发组织病理损伤,加速神经元死亡[9]。 本研究采用改良Feeney 法制备脑外伤模型大鼠,经定位航行与空间探索实验发现模型组大鼠逃避潜伏期要显著长于假手术组,而空间探索时间比例明显低于假手术组,提示脑外伤导致大鼠记忆功能障碍,神经功能受损。 HE 染色发现,模型组大鼠脑组织神经细胞发生肿胀、变形、细胞核固缩,着色加深,坏死细胞增多,伴有炎性细胞浸润,说明模型大鼠脑组织出现炎性损伤,神经细胞受损,这与以往脑外伤模型动物特征相似[10],提示模型大鼠脑组织受损,神经功能发生障碍,脑外伤大鼠模型制备成功。
NOS 信号通路与脑损伤的发生密切相关,其通过催化形成NO,发挥对脑组织神经的保护或损伤作用。 机体中的NOS 主要包括内皮型一氧化氮合酶(eNOS)、iNOS 及nNOS,过往研究发现在脑损伤早期eNOS 表达较高,通过催化生成NO 发挥对脑组织的神经保护作用,而在脑损伤中、后期nNOS、iNOS 大量表达则会释放对脑神经有害的NO[11]。Yong 等[12]研究发现缺血再灌注损伤大鼠脑组织中eNOS 水平降低,iNOS 水平升高,给予电针治疗后,能够显著上调eNOS,下调iNOS 水平,缓解神经功能缺损、神经元凋亡。 川芎嗪类似物CXC195 通过抑制NADPH 氧化酶和iNOS 的表达,发挥对大鼠脑缺血再灌注损伤的保护作用[13]。 本研究发现,与假手术组相比,模型组大鼠脑组织中nNOS、iNOS 蛋白表达、NO 水平升高,提示NOS 信号通路的激活与脑外伤的发生相关。
BH4 为炎性因子及神经递质合成的辅助因子,而GCH1 为BH4 合成主要限速酶,二者与神经损伤、疼痛的发生相关。 DAHP 为GCH1 抑制剂,可通过抑制GCH1 的合成进而降低BH4 合成,研究发现采用DAHP 能够抑制GCH1 的表达,进而降低iNOS的表达,影响NO 的合成[14]。 近期有研究显示DAHP 能够通过下调iNOS 表达,进而降低脑缺血再灌注损伤大鼠梗死面积,减轻脑水肿,发挥对脑组织的保护作用[15]。 Li 等[16]研究发现DAHP 通过抑制凋亡和激活磷脂酰肌醇-3 激酶(PI3K)/蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)通路对发挥对局灶性脑缺血的保护作用[16]。 本研究发现采用BH4 处理模型大鼠后,逃避潜伏期延长,空间探索时间比例降低,脑组织损伤程度加重;而采用BH4 联合DAHP 处理模型大鼠后,与BH4 组比较,大鼠逃避潜伏期缩短,空间探索时间比例升高,脑组织损伤程度有所缓解,提示DAHP 可通过抑制iNOS 信号通路的表达,进而缓解脑外伤大鼠脑组织神经损伤。 在脑损伤后过量炎症反映会导致COX-2、iNOS 表达升高,过往研究发现在脑损伤后24 h 内,COX-2 达到最大值,其水平与病情严重程度密切有关[17]。 此外脑损伤后NF-κB 表达大量升高,进一步刺激iNOS 合成大量的NO,上调促炎症因子TNF-α 表达,加重炎症损伤[18]。 本研究发现模型组大鼠脑组织中COX-2、NF-κB、TNF-α 蛋白表达明显升高,给予BH4 后能够进一步升高上述炎症因子的表达,联合DAHP 后则能抑制上述炎症因子的表达,提示DAHP 可能通过抑制NOS 表达进而缓解对脑外伤大鼠炎症损伤。
神经细胞凋亡参与脑损伤的发生、发展过程,细胞凋亡数量的多少,与损伤严重程度密切相关[19]。 本研究通过Tunel 染色检测发现,模型组大鼠脑组织中神经细胞凋亡率明显升高,给予BH4 处理后细胞凋亡加重,联合DAHP 处理后细胞凋亡降低,提示DAHP 可通过减轻神经细胞凋亡,保护脑组织。 Caspase-3 是细胞死亡的最终执行者,而Bcl-2 作为抗凋亡蛋白能够抑制Caspase-3 激活,阻断Bax 等凋亡蛋白的激活,研究发现脑损伤后24 h Caspase-3 表达达到最高峰,而Bcl-2 表达则最低[20]。 本研究发现模型组大鼠脑组织中Caspase-3蛋白表达升高,Bcl-2 蛋白表达降低,给予BH4 后能够Caspase-3 蛋白表达进一步升高,Bcl-2 蛋白表达进一步降低,联合DAHP 后Caspase-3 蛋白表达降低,Bcl-2 蛋白表达升高,提示DAHP 可能通过抑制凋亡蛋白激活,发挥抗凋亡作用,保护脑外伤大鼠神经功能。
综上所述,DAHP 能够缓解脑外伤大鼠脑组织神经细胞凋亡,降低炎性损伤,缓解神经功能障碍,其机制可能与抑制iNOS 信号通路有关。 然而本研究也存在不足,脑外伤机制较复杂,DAPH 是否还通过其他途径发挥对脑组织神经保护作用,尚待后续深入探究。

