神经母细胞瘤肾上腺原位移植瘤动物模型的建立
刘 波,苗佳宁,张斯萌,李志杰∗
(1.中国医科大学附属盛京医院实验研究中心,沈阳 110004;2.辽宁省环境与代谢疾病动物模型研究与应用重点实验室,沈阳 110004)
神经母细胞瘤(neuroblastoma,NB)是儿童常见的一种交感神经系统的恶性胚源性肿瘤,其起源于神经嵴,恶性度极高,预后极差,但具有自行消退和体外诱导分化成熟的特点[1-2]。 如何治愈NB 是目前肿瘤界研究的焦点问题,而动物模型是肿瘤疾病临床前研究的重要组成部分,其中小鼠移植瘤模型可模拟人肿瘤自然生长过程,是目前主流的研究NB的动物模型。 移植瘤模型可分为异位移植和原位移植模型,约60%的NB 原发于腹膜后,来源于肾上腺髓质或交感神经节,因此异位移植瘤模型并不能完全模拟NB 的生物学行为,而原位移植瘤模型在生物学特性上更贴近临床实际[3-4]。 本文旨在研究肾上腺原位移植NB 动物模型的造模方法及特点,对进一步研究NB 发生、发展及治疗奠定了良好的科研基础。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
实验动物选用SPF 级SCID-Beige 免疫缺陷小鼠,雌性,5 周龄,体重14~16 g,30 只购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。 无菌手术在中国医科大学附属盛京医院实验研究中心动物实验室屏障动物实验设施进行[SYXK(辽)2017-0004],本实验经中国医科大学附属盛京医院医学科研与新技术伦理委员会批准(2014PS48K),并按动物实验使用的3R 原则给予人道的关怀。
1.1.2 细胞
应用神经母细胞瘤SK-N-BE2(BE2)细胞系进行造模(BE2 细胞系由美国国立卫生研究院-国家癌症研究所-分子细胞生物实验室Dr.Carol.J.Thiele博士惠赠)。 用含10%胎牛血清、2 mmol/L 谷氨酰胺、100 U/mL 青霉素、100 μg/mL 链霉素的RPMI 1640 培养液,培养于37℃、5% CO2的孵箱内,2~3 d 传代一次,取对数生长期的细胞用于实验[5]。
1.2 主要试剂与仪器
10%胎牛血清、2 mmol/L 谷氨酰胺、100 U/mL青霉素、100 μg/mL 链霉素的RPMI 1640 培养液(以色列BI 公司);体式显微镜(宁波永新光学股份有限公司, 型号:NSZ-608T);小动物呼吸麻醉机(美国MATRX, 型号:MODLE3000)。
1.3 实验方法
1.3.1 注射细胞准备
肿瘤细胞接种实验当天将BE2 细胞用胰酶消化后,按照PBS ∶基质胶=1 ∶1的比例稀释BE2 细胞,制成2×106/50 μL 的细胞悬液用于肿瘤细胞接种。
1.3.2 NB 细胞接种
30 只SCID-Beige 小鼠随机分为两组,A 组为皮下异位移植组,B 组为肾上腺原位移植组,皮下异位移植瘤组9 只,原位移植瘤组21 只,标记编号并称量体重。 A 组动物在无菌条件下,将准备好的细胞悬液抽取50 μL 经皮下注射到小鼠右侧腋下位置,注射完毕后放回饲养笼内正常饲养。 B 组动物气体诱导麻醉后,小鼠右侧下肋部及上腹部备皮消毒,开腹后暴露右侧肾上腺及周围脂肪层,将准备好的细胞悬液抽取50 μL,体式显微镜下注射到肾上腺周围脂肪层内,关腹,免拆缝合线缝合并消毒创口,待小鼠苏醒后放回饲养笼内正常饲养[6-8]。
1.3.3 术后观察
BE2 肿瘤细胞接种后第2 天开始每天记录小鼠体重变化。 接种肿瘤细胞后第14、21、28 天比较A、B 两组成瘤情况及肿瘤大小。 肿瘤大小测量:记录肿瘤最长径a 和最短径b,采用公式V=a×b2/2 计算肿瘤体积,皮下异位移植瘤肿瘤大小每周测量3 次,肾上腺原位移植瘤肿瘤大小测量取材后肿瘤组织大小。 组织形态学检查:A 组取完整肿瘤标本、B 组将肿瘤、左肾及肾周脂肪一并取出,于4%多聚甲醛内固定,行HE 染色,观察镜下病理改变[9]。
1.4 统计学方法
应用软件GraphPad Prism 8 进行统计分析。 计量资料以平均数±标准差(±s)表示,两组间均数比较使用t检验;成瘤率采用Fisher 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 神经母细胞瘤肾上腺原位移植模型建立
无菌条件下使用异氟烷,通过小动物呼吸麻醉机诱导麻醉并将流量控制在氧气流量200 mL/min,异氟烷浓度3%持续麻醉,常规备皮消毒后的左侧上腹部隐约可见小鼠脾位置,在脾尾端及肋缘下部交界处横向行0.5~1 cm 切口并逐层切开至腹腔,镜下用无损显微镊轻柔的将脾拨向头侧并在皮层挤压下固定脾,暴露手术所需视野,此时可见脾覆盖下的左侧肾上级部分,用无菌棉签将肾轻柔向小鼠尾侧拨动,此时将暴露肾上腺及周围脂肪层,将准备好的NB 细胞悬液50 μL 抽入针尖型号为28 G的注射器内,镜下左手用棉签固定肾上腺脂肪位置,右手持注射器,在肾上腺周围脂肪处尽量平行进针,注意针尖不可触碰到肾上腺,针尖不可穿透脂肪层,确定针尖斜面全部进入脂肪层后缓慢注射细胞悬液,注射后可见脂肪层快速形成丘状隆起,确认细胞悬液全部注射入脂肪层后快速拔出注射器的同时左手棉签抵住入针位置1~2 min 避免漏液。 而后恢复脾位置,逐层缝合肌肉层及皮层,缝合处消毒并停止异氟烷麻醉,待小鼠苏醒后放回饲养笼内正常饲养[10-13]。 (图1)
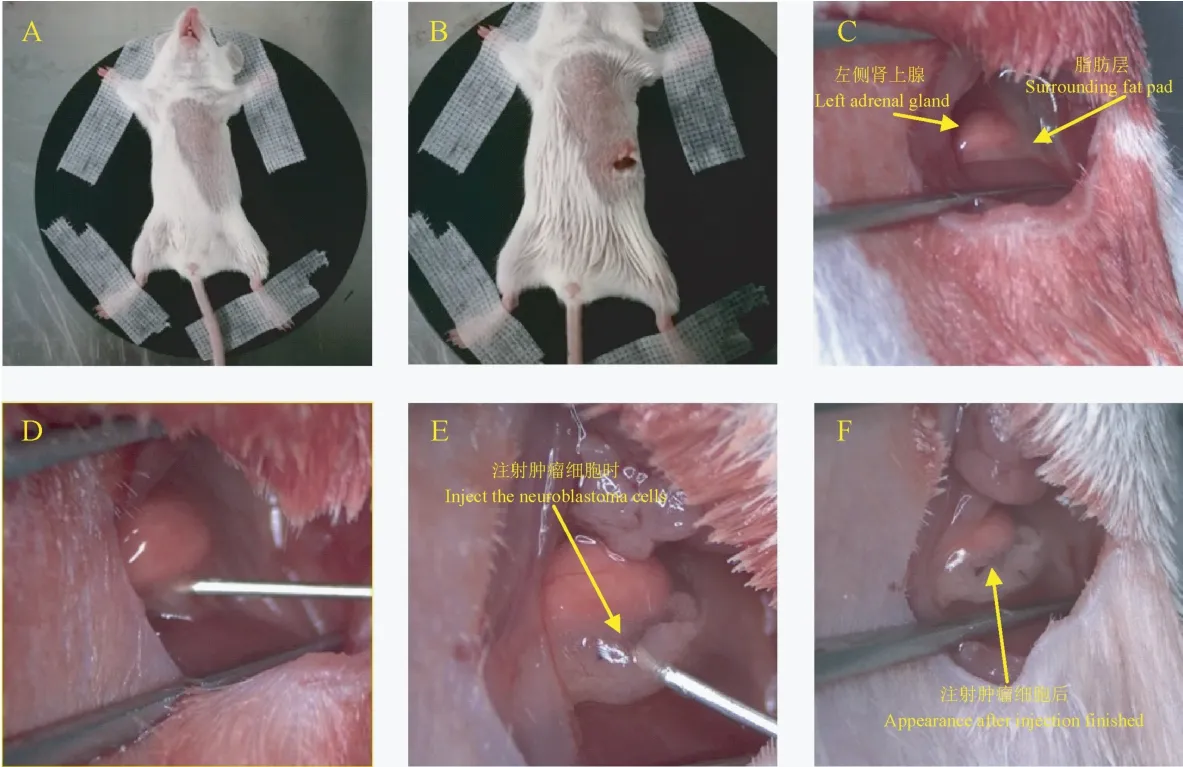
图1 神经母细胞瘤肾上腺原位移植动物模型的制作Note. A, Fix the mouse supine and prepare the skin for the operation. B, Make the incision on the skin. C, Expose the left adrenal gland and the surrounding fat pad. D, Stab into the fat pad. E,Inject the neuroblastoma cells. F,Appearance after injection finished.Figure 1 Establishment of the orthotopic neuroblastom xenograft model
2.2 肾上腺原位移植瘤与皮下异位移植瘤组间成瘤情况比较
在接种相同数量肿瘤细胞的情况下,分别在14、21、28 d 比较两组小鼠的成瘤率(表1)、平均肿瘤体积(表2)及肿瘤生长情况(图2)。 如表1 所示,接种相同数量肿瘤细胞后,原位移植瘤与皮下异位移植瘤成瘤率相比具有统计学差异(P=0.0114)。 结果提示,原位移植瘤的成瘤率高,且成瘤明显早于皮下异位移植瘤。 28 d 内动态观察并记录肿瘤大小。 皮下异位移植瘤组共9 只小鼠,分别在14、21、28 d 时测量肿瘤大小;肾上腺原位移植瘤组共21 只小鼠,分别在14、21、28 d 各处死7 只,取出肿瘤组织测量肿瘤大小。 如表2 所示,与皮下移植瘤相比,原位移植瘤生长速度更快,肿瘤体积更大,差异具有统计学意义(14 d 时P<0.05,21 d及28 d 时P<0.001)。
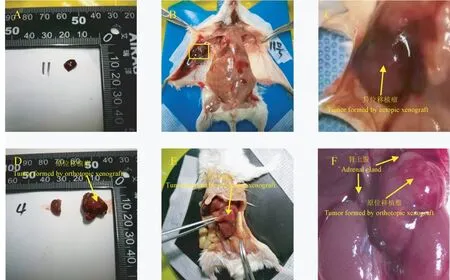
图2 两种不同成瘤方式肿瘤生长情况Note. A, Tumor formed by ectopic xenograft. B,Tumor formed in situ by ectopic xenograft. C,High magnification for the tumor formed by ectopic xenograft. D, Tumor formed by orthotopic xenograft, with reference to the bilateral adrenal glands. E, Tumor formed in situ by orthotopic xenograft, the arrow pointed to the position of the tumor formed. F, High magnification for the tumor formed by ectopic xenograft.Figure 2 Situation of tumor growing by the orthotopic xenograft and ectopic xenograft

表1 皮下异位移植瘤组和肾上腺原位移植瘤组接种肿瘤细胞后各时间点的成瘤率比较(%)Table 1 Tumor formation rate by the orthotopic xenograft and ectopic xenograft at the different time points

表2 皮下异位移植瘤组和肾上腺原位移植瘤组肿瘤细胞接种后不同时间点肿瘤体积比较Table 2 Volume of tumor formed by the orthotopic xenograft and ectopic xenograft at the different time points
2.3 两种不同成瘤方式肿瘤组织病理特点
与皮下异位移植瘤相比,接种细胞后相同时间点的肾上腺原位移植瘤的肿瘤体积更大(图3A、3D)。HE 染色可见,原位移植瘤的肿瘤细胞相比与皮下异位移植瘤肿瘤细胞略显致密,细胞分布更均匀(图3B、3E)。 原位移植瘤肿瘤细胞的形态与皮下异位移植瘤肿瘤细胞形态相同,呈均质蓝染(图3C、3F)。

图3 两组不同成瘤方式肿瘤组织形态及组织学形态照片Note. A, Gross appearance of the tumors formed by the ectopic xenograft. B, HE staining of the tumors formed by the ectopic xenograft. C, HE staining of the tumors formed by the ectopic xenograft. D,gross appearance of the tumors formed by the orthotopic xenograft. E,HE staining of the tumors formed by the orthotopic xenograft. F, HE staining of the tumors formed by the orthotopic xenograft.Figure 3 Gross appearance and the histology of the tumors formed by the orthotopic xenograft and ectopic xenograft
3 讨论
NB 是一种起源于神经嵴的儿童颅外恶性实体肿瘤,大部分发生于腹部,最常见于肾上腺,也可发生于交感神经系统存在的任何部位,包括脊柱旁的交感神经节,是儿童肿瘤死亡的最主要原因之一。高危的NB 细胞具有高致瘤性和侵袭性,早期转移多,约60%~70%的病例发生转移,成为神经母细胞瘤患者的主要死因[3,6,14]。 因此,NB 的动物模型制备对研究NB 的发生、发展及治疗奠定了良好的科研基础,NB 动物移植瘤模型是NB 研究不可或缺的工具。 NB 皮下异位移植瘤动物模型因其操作简单易行,广泛用于NB 的研究,但有其局限性,临床中约有60%的NB 原发于腹膜后,来源于肾上腺髓质或交感神经节,原位移植瘤动物模型的生物学特性更贴近临床实际[15]。 目前肾上腺原位移植瘤模型越来越多地成为主流的NB 移植瘤形式,但未见详细的操作流程作为方法学方面的指导,常规建立标准的NB 移植瘤模型较为困难。 本文详细介绍了NB 肾上腺原位移植瘤动物模型的造模方法,为今后更加准确、高效的复制此动物模型提供细致和标准化的实验方案。 对未来进一步研究NB 发生、发展及治疗提供了科学的研究工具。
我们在本研究中发现,与皮下异位移植瘤模型相比,肾上腺原位移植模型成瘤速度快、细胞需求量小、肿瘤体积大的优点。 更符合临床患儿体内NB生长的特点,我们在本研究中观察到小鼠肾上腺原位移植肿瘤局限于特定位置而且在短期内未发现有转移形成,更符合NB 在人体内的生长特点,是研究NB 的理想动物模型。 相较于皮下异位移植瘤模型,原位移植瘤模型成瘤率更高,各时间点成瘤率均为100%,肿瘤生长速度快、实验周期短,在实验研究中优于皮下异位移植瘤模型[16-17]。
肾上腺原位移植造模方式可行性强,在模型建立过程中需注意:(1)麻醉方式最好选择气体麻醉,本实验在拥有一定操作熟练度的情况下,每只鼠需要麻醉时间短,常规麻醉小鼠苏醒慢、对机体影响较大,气体麻醉是目前对于短时间麻醉和反复多次麻醉时首选的麻醉方式。 (2)原位移植时需要注意对脾和肾的保护,由于脾与肾均为质地较脆的实质性器官,不当的操作会对其造成损伤,影响小鼠术后状态甚至成活率。 尽量使用棉签一类的柔性物体来触碰。 (3)保护肾上腺,注射细胞时针尖位置要确保不会碰到肾上腺实质,以免造成小鼠术中死亡。 (4)防止肿瘤细胞漏液,在脂肪层注射细胞时要做到进针既稳又准,注射器针尖不能刺穿脂肪层,尽量使针尖前端多进入脂肪层一段距离,注射时注射位置要能看到皮丘状隆起,拔针的同时要迅速用棉签抵住针眼防止漏液。 (5)术后要勤观察小鼠状态,原位移植后肿瘤发展迅速,对小鼠生理状态影响极大,每天称量体重,观察毛色等外观变化。
本研究聚焦NB 原位移植瘤模型造模方法,为准确高效地复制该动物模型提供一种标准化实验方案,为NB 的研究奠定了良好的科研基础。

