放射诱导多倍体乳腺癌细胞衰老和自噬
孟繁杰 阎英 熊婵 王丽丽 赵松 邢思宁 于卉影
作者单位:110016 沈阳 1北部战区总医院基础医学实验室;2北部战区总医院放疗科;3中国医科大学北部战区总医院研究生培养基地
乳腺癌是全球常见的恶性肿瘤,也是绝经后妇女的主要死亡原因之一[1]。放射治疗是乳腺癌的重要治疗手段,而放射抵抗是乳腺癌放射治疗的主要障碍[2]。近年来,乳腺癌治疗研究已经取得了很大进展,但仍有部分浸润性癌易转移且具有放射抵抗性,而治疗引起的细胞衰老现象可能是放射抵抗的原因之一。放射治疗诱导癌细胞的衰老现象会对预后产生不良影响,而放射治疗诱导的多倍体现象可能与癌细胞衰老的可逆性有关[3]。细胞自噬和细胞衰老被认为是肿瘤休眠机制,可使癌细胞躲避死亡,而多倍体巨细胞也可能通过细胞自噬和细胞衰老发生去倍化增殖。自噬是一个溶酶体降解的过程,涉及营养物质和细胞器的自我降解循环,这对细胞平衡具有重要作用。自噬功能障碍与多种人类疾病有关,包括神经退行性疾病、炎症性疾病和癌症[4-5]。本研究旨在分析放射治疗诱发的多倍体乳腺癌细胞的衰老和自噬现象,以探讨多倍体肿瘤细胞在放疗抵抗及肿瘤复发中的潜在作用。
1 材料与方法
1.1 主要材料与试剂
乳腺癌MDA-MB-231细胞株为本实验室保存。Leibovitz′s L-15培养基购自上海源培生物科技股份有限公司;新生牛血清购自天津康源生物技术有限公司;兔抗人PARP抗体、兔抗人PLK1抗体、兔抗人Rb抗体、兔抗人LC3A/LC3B抗体、兔抗人Lamin B1抗体、抗兔IgG(H+L)、β-半乳糖苷酶检测试剂盒、F(ab′)2Fragment(Alexa Fluor 488 Conjugate)抗体均购自美国Cell Signaling Technology公司,兔抗人E2F-1、兔抗人E2F-2抗体购自美国Santa cruz公司,Super Signal West Pico化学发光底物购自美国Pierce Biotechnology公司,兔抗人GAPDH抗体购自美国Sigma公司,Annexin V/PI试剂盒购自江苏凯基生物技术股份有限公司。
1.2 细胞培养及照射条件
MDA-MB-231细胞用含10%的新生牛血清的L-15培养液于37℃、饱和湿度的培养箱中培养,于80%融合时进行传代,取对数生长期细胞用于后续实验。
MDA-MB-231细胞以3×104/cm2密度,置于T75培养瓶中培养,将未经过放射处理并正常培养的乳腺癌MDA-MB-231细胞设为对照组,在6 MV X射线模式下,经前期预实验确定采用7 Gy剂量照射,并分别于第3天、5天、7天、11天和19天观察细胞形态变化,依次记为对照组(Control)、Day 3组、Day 5组、Day 7组、Day 11组和Day 19组。
1.3 流式细胞术检测MDA-MB-231细胞倍性
收集未经过放射处理的乳腺癌MDA-MB-231细胞组和放射处理后的各组细胞,根据Annexin V/PI试剂盒中的检测方法,每组取5×105个细胞,在80%冰甲醇中于-20℃固定24 h,每管加入550 μL PI染液,室温避光染色30 min,流式细胞术分析细胞倍性。
1.4 Western blot法检测自噬和衰老相关蛋白的表达水平
收集各组细胞,离心,裂解后,提取细胞总蛋白,BCA试剂盒测定各组细胞的蛋白浓度,进行SDS-PAGE凝胶电泳,将蛋白样本转印至硝酸纤维素膜上,脱脂奶粉室温封闭2 h,4℃一抗在摇床上孵育过夜,TBST洗膜后,用辣根过氧化物酶标记的二抗在摇床上室温孵育2 h,再用TBST洗涤,加入ECL发光底物试剂,X光片显影、定影。以GAPDH作为内参,应用Image J软件检测蛋白灰度值进行分析。
1.5 β-半乳糖苷酶染色检测细胞衰老现象
使用β-半乳糖苷酶染色试剂对衰老细胞进行染色鉴定。β-半乳糖苷酶染色试剂盒以X-Gal为底物,在衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物,光学显微镜下易观察到变成蓝色的表达β-半乳糖苷酶的细胞。细胞用β-半乳糖苷酶染色固定液室温固定10 min,加入用β-半乳糖苷酶染色液A、β-半乳糖苷酶染色液B、β-半乳糖苷酶染色液C和X-gal按照比例混合的染色工作液,37℃孵育4 h,普通光学显微镜下观察、拍照。
1.6 GEPIA工具分析PLK1在乳腺组织和乳腺癌组织中的表达情况
为了研究PLK1在乳腺癌中的表达情况及多倍体细胞损伤应答是否与自噬相关,利用GEPIA(http://gepia.cancer-pku.cn)工具,在Expression DIY中选择Boxplot方法,应用TCGA和GTEx数据库对乳腺组织和乳腺癌组织中的PLK1表达进行差异分析;并且在Correlation中选择TCGA Tumor数据库,观察乳腺癌组织中PLK1与自噬相关蛋白表达的相关性。
1.7 统计学方法
应用SPSS 22.0软件处理数据。计量资料以均数±标准差()表示,多组间细胞的倍性比较采用单因素方差分析,若组间差异有统计学意义,则采用Dunnett′s检验进行多重比较;放射处理组与未经处理组细胞衰老和自噬相关蛋白的比较采用独立样本t检验。PLK1表达水平在正常乳腺组织和乳腺癌组织中的比较采用单因素方差分析。PLK1与自噬相关蛋白LC3B的表达水平相关性采用Pearson相关分析。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 放射诱导的MDA-MB-231细胞形态和DNA含量变化
MDA-MB-231细胞经7 Gy照射后,与对照组相比,Day 3组、Day 5组和Day 7组细胞体积明显增大,且Day 5组的大细胞周围开始出现许多“触角”样结构,见图1。流式细胞术检测结果显示,Day 3组、Day 5组和Day 7组多倍体细胞亚群(DNA含量>4 N)比例均明显高于对照组,差异均有统计学意义(均P<0.0001),以上实验结果说明放射成功诱导生成多倍体MDA-MB-231乳腺癌细胞。Day 11组和Day 19组细胞多倍体细胞比例恢复至正常水平,与Day 3组比较差异均有统计学意义(均P<0.0001)。见图2。
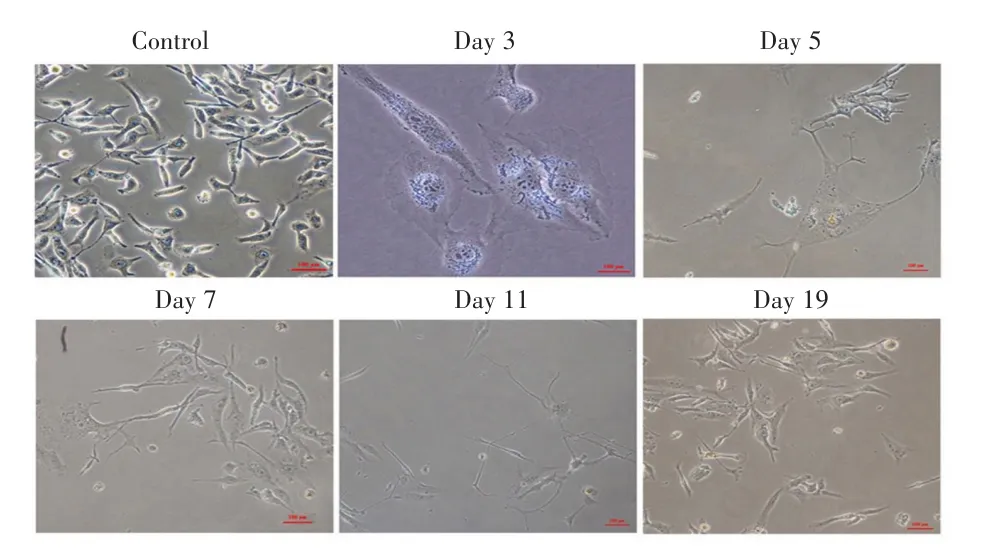
图1 经7 Gy照射后MDA-MB-231细胞的形态学变化(×200)Fig.1 Morphological changes of MDA-MB-231 cells after 7 Gy irradiation(×200)
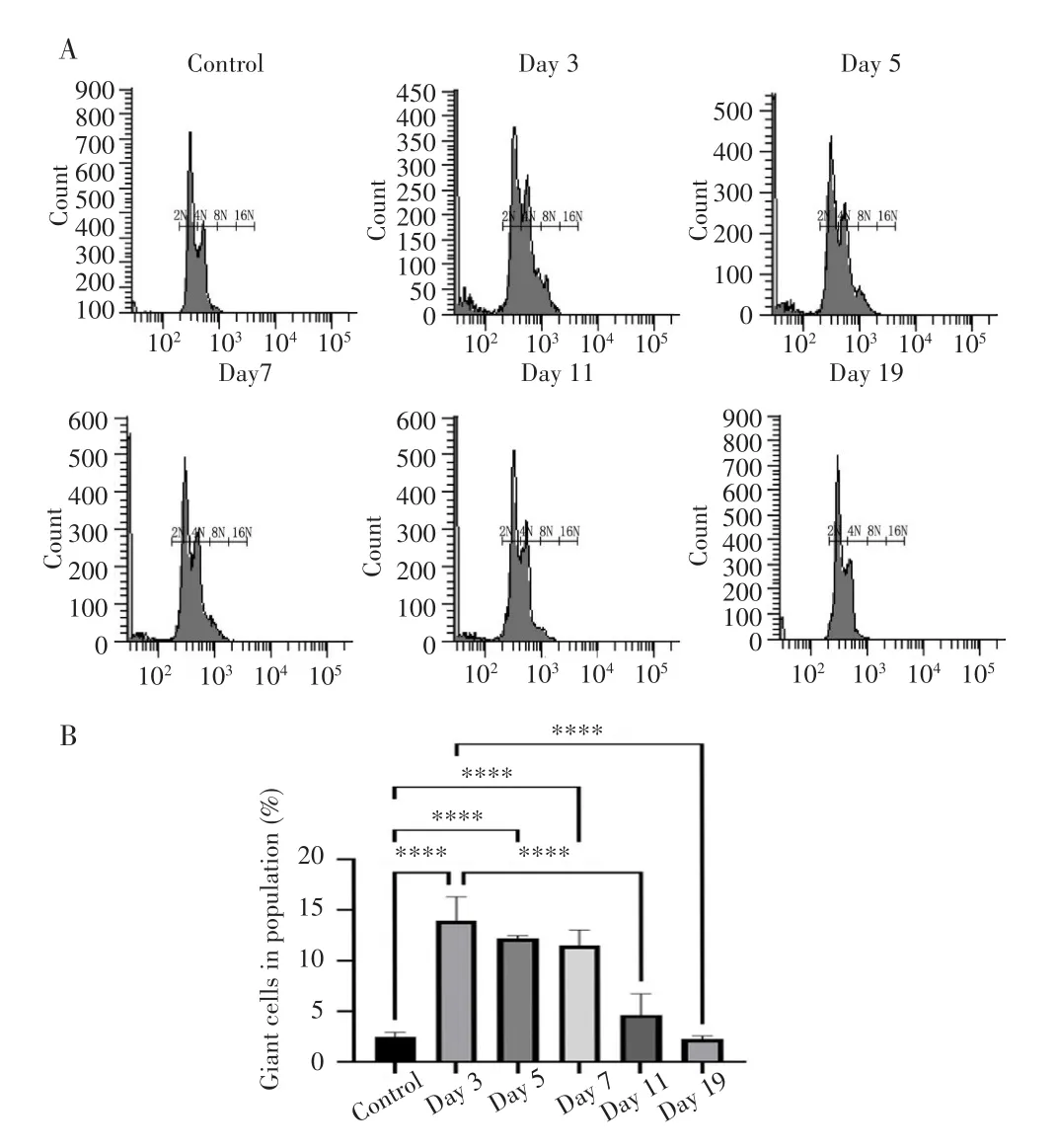
图2 经7 Gy照射后MDA-MB-231细胞的倍性变化Fig.2 Ploidy changes of MDA-MB-231 cells after 7 Gy irradiation
2.2 β-半乳糖苷酶染色法检测放射诱导的多倍体乳腺癌细胞衰老现象
β-半乳糖苷酶染色法检测结果显示,Day 3组、Day 5组和Day 7组与对照组相比,多数细胞内生成蓝色产物,证明细胞内衰老相关β-半乳糖苷酶活性提高,放射治疗诱导的多倍体MDA-MB-231细胞发生衰老现象,见图3。
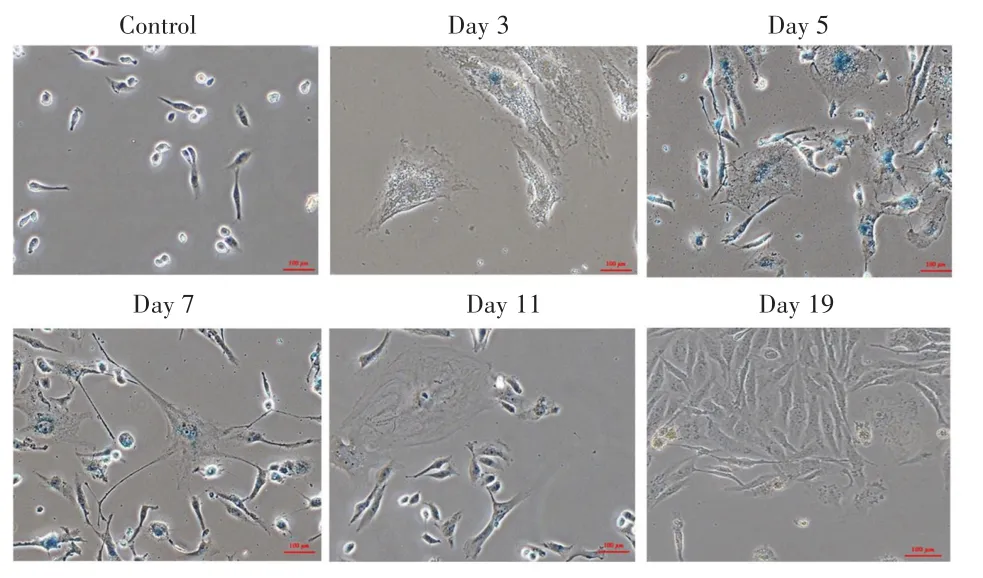
图3 经7 Gy照射后MDA-MB-231细胞衰老的变化(β-半乳糖苷酶×200)Fig.3 Senescence changes of MDA-MB-231 cells after 7 Gy irradiation(β-galactosidase×200)
2.3 放射诱导的多倍体乳腺癌细胞中自噬和衰老相关蛋白的表达
Western blot检测结果显示,与对照组比较,Day 3组、Day 5组和Day 7组中DNA损伤修复蛋白PARP表达下调(P=0.0384,0.0204,0.019),DNA合成相关蛋白Rb(P=0.048,0.011,0.021)和 E2F-1(P=0.006,0.002,0.004)表达也下调;而自噬相关蛋白LC3B/LC3A比值显著升高(P=0.012,0.049,0.027)。与对照组比较,Day 3组和Day 5组核膜完整性相关蛋白Lamin B1表达下调(P=0.025,0.011),DNA合成相关蛋白E2F-2表达也下调(P=0.037,0.002);而Day 3组、Day 5组、Day 7组和Day 11组DNA损伤应答相关蛋白PLK1表达上调(P=0.017,0.002,0.009,0.013),见图4。
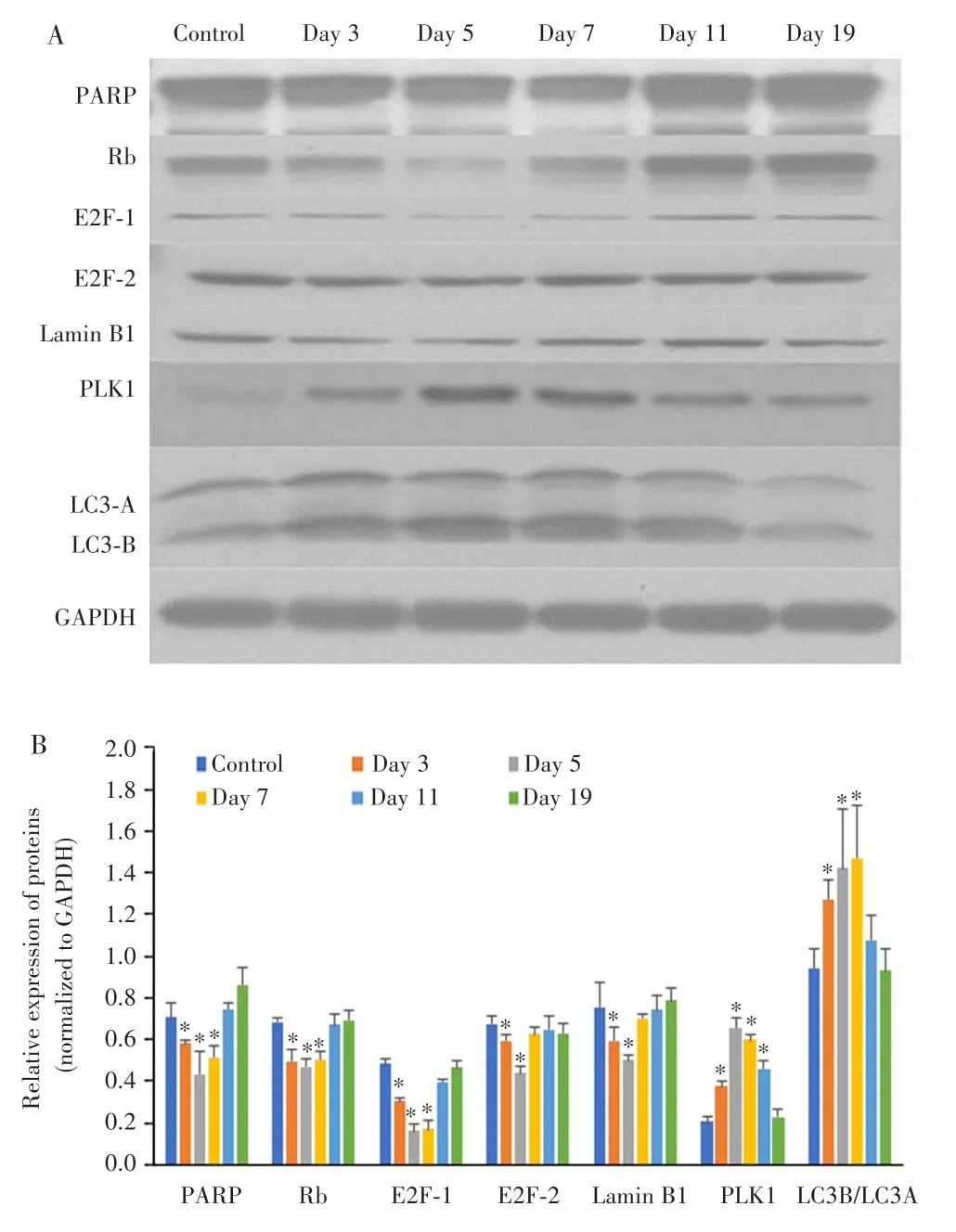
图4 经7 Gy照射后MDA-MB-231细胞衰老和自噬相关蛋白的表达Fig.4 Expression of MDA-MB-231 cell senescence and autophagy-related protein after 7 Gy irradiation
2.4 GEPIA工具验证PLK1在乳腺癌组织中的表达水平
与正常乳腺组织(n=291)相比,PLK1在乳腺癌组织(n=1085)中高表达,差异有统计学意义(P=0.010),见图5A;PLK1与自噬相关蛋白LC3B的表达水平无显著相关性(r=0.065,P=0.034),见图5B。
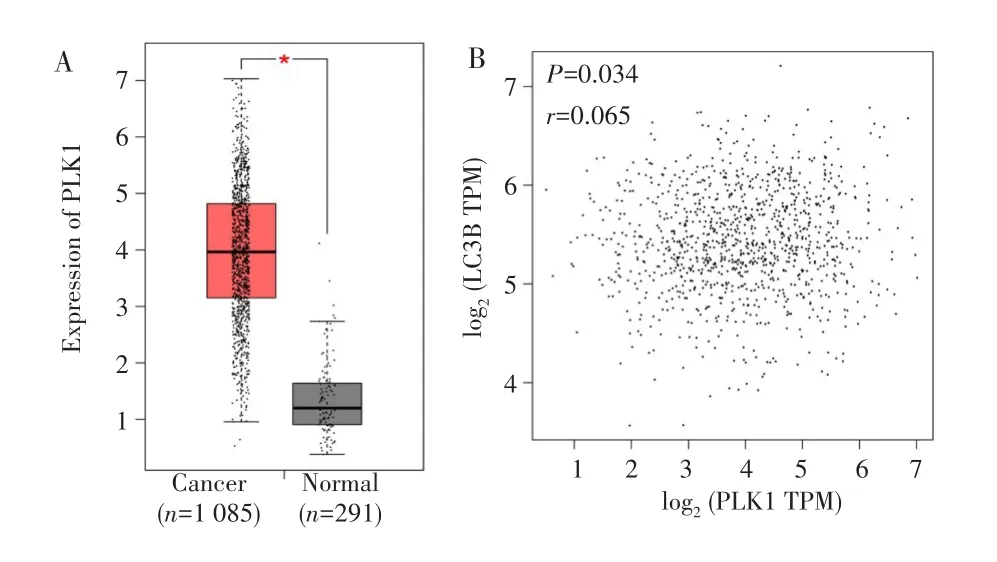
图5 GEPIA工具验证PLK1在乳腺癌组织中的表达Fig.5 Expression of PLK1 in breast cancer tissue verified by GEPIA website
3 讨论
放疗主要是通过破坏癌细胞DNA,将分裂迅速的癌细胞杀死。但是放疗也会对正常组织造成损害,从而导致肾毒性、神经毒性、骨髓抑制和周围神经病变等不良反应[6]。为了平衡放疗所产生的不良反应,放疗间隔期往往较长,这也为癌细胞在治疗间隔重新修复提供了机会[7]。关于抗癌治疗诱导多倍体巨细胞及其在肿瘤转移中的作用已有报道[8],但是,多倍体细胞衰老问题却鲜有研究[9-11]。与治疗诱导的多倍体化类似,许多抗癌治疗在体内和体外诱发的细胞衰老也对治疗效果产生潜在影响[12]。有研究表明控制细胞大小对调节细胞营养分布以及多细胞生物体的器官大小和功能至关重要,其中最佳细胞功能需要维持最适合的细胞核质比(nuclear-cytoplasmic ratio,N/C)。当细胞发生多倍体化时,细胞核变大,为了维持细胞核质比例会导致细胞质变大[13]。NEUROHR等[14]推测为了抵消不利的N/C比例,癌细胞启动衰老程序,随后多倍体肿瘤巨细胞发生不对称分裂而产生正常或接近正常染色体数量的后代。此外,自噬在抗癌治疗中可能发挥对癌细胞的保护作用,而激活自噬可能有助于癌细胞的抗辐射作用[15]。有研究报道高比例的多倍体肿瘤巨细胞是无复发生存率较低的独立影响因素[16],说明多倍体可能与肿瘤再生及癌症复发有关。
本研究发现经放射处理后的MDA-MB-231细胞分别在第3天、5天和7天都出现很多体积变大的细胞,且在Day 5组的大细胞周围开始出现许多“触角”样结构,这可能在为多倍体不对称分裂成二倍体细胞做准备。Day 7组的大细胞周围也聚集许多小细胞,但在Day 11组和Day 19组大细胞逐渐减少,同时小细胞增多。流式细胞术实验进一步证实了Day 3组、Day 5组和Day 7组出现DNA含量大于四倍体的多倍体细胞,并随着时间延长多倍体细胞比例逐渐下降。上述结果表明照射后的MDA-MB-231细胞过渡性产生大量多倍体细胞后逐渐恢复到二倍体状态。本研究还发现,在Day 3组、Day 5组和Day 7组多倍体细胞的形成中伴随细胞内衰老相关β-半乳糖苷酶活性增强,DNA损伤修复蛋白PARP和DNA合成蛋白相关Rb、E2F-1、E2F-2及核膜完整性相关蛋白Lamin B1表达下调,而DNA损伤应答相关蛋白PLK1表达上调。提示尽管多倍体细胞发生衰老现象,但衰老的多倍体细胞并不是趋向细胞死亡,而是对损伤的DNA进行积极修复并帮助多倍体细胞摆脱细胞分裂阻滞而进入积极的增殖状态[13]。目前越来越多的证据也支持细胞可以逃离衰老的论点[17-19]。LEIKAM等[20]报道在黑色素瘤细胞发生衰老时会产生具有高度侵袭性的干细胞特性的多倍体肿瘤细胞。以上研究也支持衰老可能不是癌症发展的障碍而是驱动力这一观点。
马球状激酶1(polo-like kinase 1,PLK1)是一种参与DNA复制、损伤应答,并且参与各种应激反应过程的蛋白激酶[21]。既往研究显示,PLK1在结肠癌、肺癌、宫颈癌等癌症中表达过度,且PLK1高表达与不良预后有关[22]。乳腺癌细胞中,有研究报道PLK1高表达可以降低细胞在体内和体外对放疗的敏感性,从而导致放疗后的肿瘤复发[14]。本研究的生信分析结果也发现PLK1在乳腺癌组织中呈表达增高状态,但PLK1与自噬相关蛋白LC3B表达水平的相关性并不明显。同时发现Day 3组、Day 5组中PLK1和自噬相关蛋白LC3B/LC3A比值显著升高,说明自噬被激活。这意味着自噬可能与PLK1协同作用而降低乳腺癌细胞对放疗的敏感性,进而导致放疗后肿瘤复发。自噬在癌症中起重要作用,最近也有研究表明自噬参与DNA损伤修复过程[23],而自噬的减少会影响对DNA的修复,从而使癌症对辐射敏感[14],但其作用机制仍不清楚。
综上所述,放射诱导乳腺癌MDA-MB-231细胞发生衰老和自噬现象,可能为多倍体细胞的形成和去倍化增殖提供有利条件。然而,放射治疗乳腺癌细胞诱导的多倍体化和去倍增殖机制尚不明确,综合本研究结果,推测可能是由于照射后的MDA-MB-231细胞发生DNA损伤从而形成多倍体巨细胞,并且通过衰老和自噬现象去修复受损的多倍体巨细胞,而多倍体巨细胞中含有细胞废物和受损的DNA碎片,功能性自噬的激活可能为多倍体巨细胞的去倍化增殖提供了有利条件。后续将进一步研究阻断自噬能否增强放射对MDA-MB-231细胞的杀伤作用,以提高乳腺癌细胞的放射敏感性及降低肿瘤复发。

