轴突导向因子G1在肝细胞癌患者血清和组织中的表达及其临床意义
高星 叶甲舟 朴雪岷 李永强 林燕 梁嵘
作者单位:530021 南宁 广西医科大学附属肿瘤医院1化疗一科,2肝胆胰外科
肝细胞癌是全球第六大常见癌症,也是导致癌症患者死亡的第三大主要原因[1]。早期肝细胞癌经过规范治疗后,5年生存率可达60%~80%。然而肝细胞癌起病隐匿,约2/3的患者初诊时已达临床晚期,无法手术,生存期往往不足1年[2]。目前肝细胞癌筛查主要还是依赖血清甲胎蛋白(alpha fetoprotein,AFP)检测,但临床上有近1/3的患者AFP阴性;而且急性病毒肝炎活动期及胃癌等疾病也常出现AFP升高。因此,寻找新的早期肝细胞癌标志物尤为重要。
轴突导向因子G1(netrin-G1,NTNG1)位于1号染色体1p13.3区,编码539个氨基酸,由10个外显子组成,大小约为60.5 kDa,属于神经突起生长导向因子Netrins家族的一员[3]。NTNG1最早于2000年在小鼠的中脑和后脑中被发现,属于Netrin家族中的膜结合蛋白型,在其C末端具有糖基磷脂酰基醇锚(glycosylphosphatidylinositol,GPI),通过结合GPI实现与细胞膜结合[4]。生理状态下,NTNG1主要在脑组织表达,在轴突导向具有重要作用,在肿瘤发生发展中也起重要的调控作用。目前NTNG1已被发现在胰腺、肺和乳腺等多脏器中表达,并调节多种生理过程,如细胞介导、黏附、迁移和血管生成等[5-6]。HAO等[7]基于数据挖掘和深层生物学信息分析发现,NTNG1在肺腺癌低表达,而在肺鳞状细胞癌中高表达,但均与较差的生存率呈正相关。FRANCESCONE等[8]也报道NTNG1在胰腺癌组织中高表达,而与生存时间呈负相关;在裸鼠体内敲低NTNG1表达后成瘤能力削弱。然而,NTNG1与肝细胞癌的关系鲜见报道。本研究通过检测NTNG1在肝细胞癌患者血清及其组织中的表达,并分析其临床意义,以期寻找新的肝细胞癌标志物和治疗靶点。
1 资料与方法
1.1 研究对象
收集2019年7月至2019年10月本院收治的26例肝细胞癌患者,以及同期于本院门诊就诊的4例肝炎患者、19名健康受试者、41例其他肿瘤患者(结直肠癌14例,卵巢癌10例,胰腺癌10例,膀胱癌7例)血清,平均年龄(52.02±13.30)岁,男性63例,女性27例。纳入标准:⑴肝癌患者均经术后病理诊断均为肝细胞癌,术前未经化疗、放疗及靶向治疗;⑵肝炎患者符合乙型病毒性肝炎诊断标准;⑶健康受试者肝功能生化指标正常;⑷其他恶性肿瘤患者均经术后病理学检查明确诊断。排除标准:血清标本溶血、脂血。所有研究对象均签署知情同意书。
收集2018年7月至2019年12月本院手术切除的63例肝细胞癌组织及其相应邻近癌旁组织(距离癌组织2 cm以上)。纳入标准:⑴初治且接受肝切除术治疗;⑵经术后病理诊断为肝细胞癌,无其他恶性肿瘤疾病史;⑶术前均未接受化疗、放疗或靶向治疗。排除标准:⑴因肝细胞癌破裂出血行急诊手术者;⑵病历资料不完整或围手术期死亡者;⑶随访时间<3个月者;⑷合并严重心、肺、肝、肾、脑等疾病者。本研究方案经广西医科大学附属肿瘤医院伦理与研究委员会批准,获得患者书面知情同意。
1.2 资料收集与随访
查阅病历收集患者性别、年龄、饮酒史、吸烟史以及乙型肝炎病毒(hepatitis B virus,HBV)感染情况、BCLC分期、TNM分期、HBsAg、AFP、病理性微卫星灶、微血管侵犯、肿瘤大小、肿瘤数目、是否合并肝硬化、有无癌栓等临床资料。出院后2年内每3个月电话随访1次,之后每6个月随访1次,随访截至2021年7月2日。研究终点为总生存期(overall survival,OS),OS定义为手术日至患者死亡或末次随访的时间。失访或末次随访仍未死亡的病例作为截尾事件。
1.3 ELISA法检测血清中NTNG1的表达
抽取患者清晨空腹静脉血10 mL,室温凝集30 min,4 000× g离心20 min后,所得血清置于-80℃冰箱保存、备用。将试剂DLCN20(美国R&D公司)复温,每孔中加入100 μL稀释液后,分别放入等量的标准品和实验血清样品,4℃孵育2 h,加入200 μL偶联试剂,4℃孵育2 h,用洗涤液清洗后加入200 μL底物溶液,室温孵育30 min后加入终止液,检测波长450 nm处的吸光度(OD)值。通过标准样品计算血清中NTNG1的浓度。
1.4 Western blot实验检测组织中NTNG1的表达
分别取100 mg新鲜肝细胞癌及癌旁组织,加入RIPA裂解液(北京索莱宝科技有限公司)提取组织蛋白,严格按照BCA试剂盒(上海碧云天生物技术有限公司)说明书操作检测蛋白浓度。每孔加入30~50 μg标准化蛋白样品,在加满Tris-Glycine电泳液的垂直电泳槽内,浓缩胶在80 V恒压下电泳至分离胶界面时,调至120 V继续电泳至溴酚蓝分离胶底部。转移至聚PVDF膜,加入一抗NTNG1(ab153834,1∶1 500)4 ℃孵育过夜,洗膜后,加入二抗(ab205719,1∶10 000)室温孵育1 h;取出PVDF膜,洗膜后滴加ECL工作液反应 2~5 min;于暗室内压片、显像。以Image J软件检测条带灰度值,以目标条带灰度值与β-actin(ab179467,1∶5 000)条带灰度值的比值代表各组织中NTNG1蛋白表达水平。
1.5 统计学方法
采用SPSS 19.0软件分析实验数据,使用GraphPad Prism 8.0对实验数据进行图形处理。计量资料若符合正态分布,则采用独立样本t检检,以均数±标准差表示;若不符合正态分布,采用中位数(上、下四分位数)表示。采用配对设计的Wilcoxon符号秩检验比较肝细胞癌组织及其癌旁正常组织中NTNG1蛋白表达水平的差异,并采用χ2检验NTNG1蛋白与临床病理参数间的关系。用Kaplan-Meier法计算总生存率并绘制生存曲线,组间差异比较采用Log-rank检验。采用单因素Cox回归分析影响患者OS的相关因素,将差异有统计学意义的因素纳入多因素Cox回归模型。血清中NTNG1表达水平不符合正态分布,首先采用Kruskal-Wallis H检验,组间差异有统计学意义,继而进行Bonferroni检验。诊断试验的评价采用受试者工作特征(receiver operating characteristic,ROC)曲线,并根据约登指数的最大值确定最佳临界值。以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 NTNG1在肝细胞癌组织及癌旁组织中的表达
Western blot检测结果显示,NTNG1蛋白在肝细胞癌组织和癌旁组织中均有不同程度表达,见图1A。NTNG1蛋白在肝细胞癌组织的平均表达量为1.0164,在癌旁组织中为0.6088,肝细胞癌组织中NTNG1蛋白表达水平明显高于癌旁组织,差异有统计学意义(Z=-3.374,P=0.001),见图1B。结果说明NTNG1蛋白在肝细胞癌组织中呈现高表达。
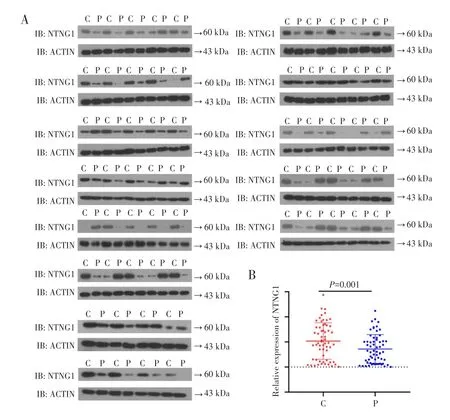
图1 63例肝细胞癌患者癌组织及其癌旁组织中NTNG1蛋白的表达Fig.1 Expression of NTNG1 protein in carcinoma and adjacent tissues of 63 patients with hepatocellular carcinoma
2.2 NTNG1蛋白表达水平与肝细胞癌患者临床病理特征的关系
肝细胞癌组织中NTNG1表达与患者年龄、门脉高压、腹水、AFP、白细胞水平、总胆红素水平、包膜侵犯及微血管密度相关(均P<0.05);与性别、BCLC分期、分化程度等无关(均P>0.05)。见表1。
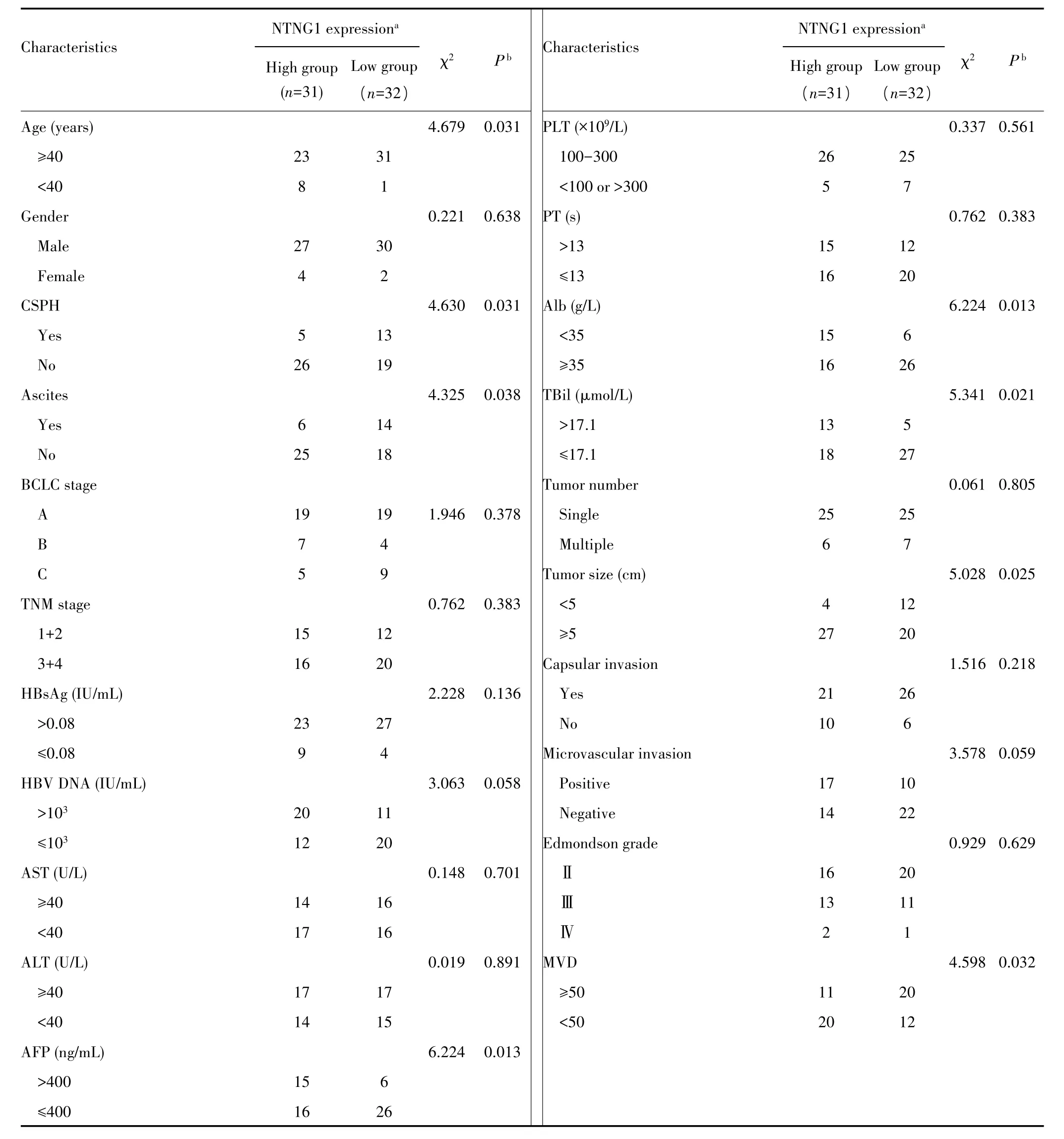
表1 NTNG1表达与63例肝细胞癌患者临床病理特征的相关性Tab.1 Correlation between NTNG1 protein expression and the clinicopathological characteristics in 63 hepatocellular carcinoma patients
2.3 NTNG1表达水平与肝细胞癌患者OS的关系
63例患者随访截至2021年7月,中位随访22个月(范围:2~27个月),其中死亡17例。Kaplan-Meier生存分析及Log-rank检验结果显示,NTNG1低表达组的总生存率高于NTNG1高表达组(χ2=6.715,P=0.010)。见图2。
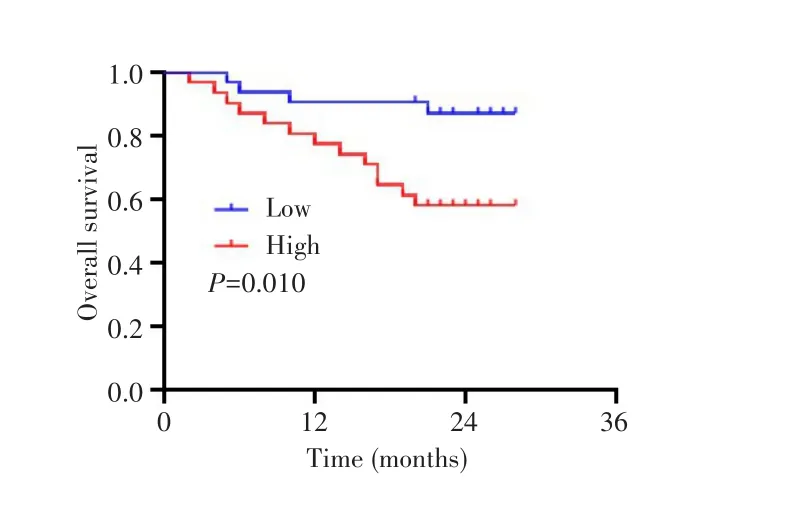
图2 NTNG1高表达与低表达肝细胞癌患者的生存曲线Fig.2 Survival curves of hepatocellular carcinoma patients with high and low expression of NTNG1
2.4 影响肝细胞癌患者预后的单因素和多因素分析
单因素分析结果显示,性别、BCLC分期、TNM分期、肿瘤大小、NTNG1表达水平与预后相关(均P<0.05)。
多因素分析结果显示,NTNG1高表达是肝细胞癌患者术后预后不良的独立危险因素(HR=3.715,95%CI=1.207~11.439,P=0.022),男性是肝细胞癌患者术后预后不良的独立保护因素(HR=0.180,95%CI=0.057~0.563,P=0.003)。见表2。

表2 Cox回归分析影响肝细胞癌患者术后总生存期的因素Tab.2 Cox analysis of factors affecting postoperative overall survival in hepatocellular carcinoma patients
2.5 肝细胞癌患者及各对照组患者血清中NTNG1表达水平
ELISA法检测结果显示,肝细胞癌患者血清中NTNG1的表达水平高于健康受试者(P<0.0001),也明显高于其他肿瘤患者(P<0.0001),见图3。
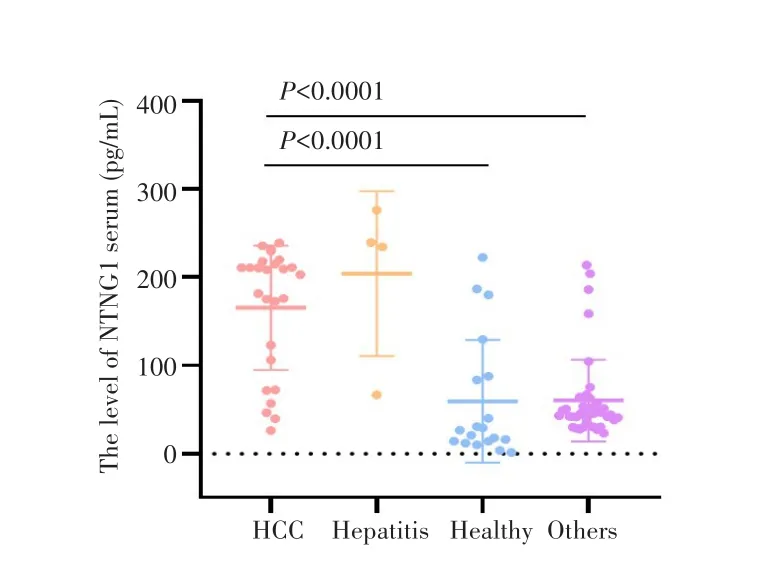
图3 NTNG1在肝细胞癌患者及各对照组患者血清中的表达情况Fig.3 Expression levels of NTNG1 in serum of patients with hepatocellular carcinoma and each control group
2.6 血清NTNG1在肝细胞癌中的诊断价值
采用ROC曲线评估肝细胞癌患者以及对照组(包括肝炎患者、健康受试者、其他肿瘤患者)共90例受试者血清NTNG1的诊断价值,绘制肝细胞癌区别于非肝细胞癌患者的ROC曲线,当NTNG1以69.50 pg/mL为临界值时,诊断肝细胞癌的灵敏度和特异度达到最佳,分别为84.62%和76.56%,ROC曲线下面积(area under curve,AUC)为 0.8251(95%CI:0.7298~0.9205,P<0.0001),见图4。
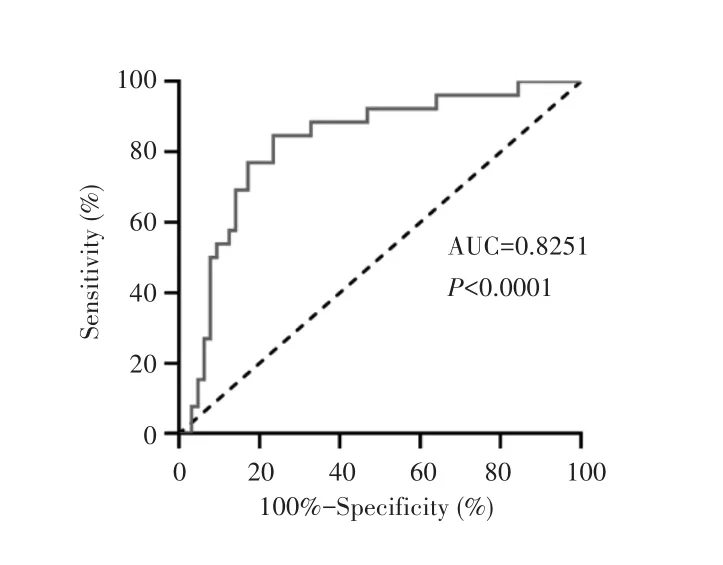
图4 肝细胞癌患者血清NTNG1的ROC曲线Fig.4 The ROC curve of NTNG1 in serum of patients with hepatocellular carcinoma
3 讨论
肝细胞癌的发生是一个多步骤、多因素的过程,包含一系列抑癌基因失活和癌基因异常激活[9]。肝细胞癌发展过程中,多种与细胞增殖、迁移和转移密切相关的分子信号发生异常表达或激活,这决定了肝细胞癌高复发、高转移的生物学特点,进一步导致患者预后不良。因此,深入探索肝细胞癌发生发展相关基因,对开发肝细胞癌新的诊断、药物标靶和预后标志物具有重要意义。
Netrins作为一类自分泌蛋白或膜结合蛋白,可以通过结合不同类型受体发挥不同作用。最初Netrins在中枢神经系统发展中起重要作用,包括调节神经细胞的迁移、分化和凋亡,并稳定血脑屏障,限制免疫细胞进入中枢神经系统[10]。此外,Netrins也参与一些非神经组织的黏附、迁移和分化等生理过程,如血管生成、淋巴管形成和炎症等[11]。现有研究也显示,Netrins参与调控肿瘤的发生与发展,在不同类型肿瘤中发挥抑制或促进作用[12]。如有研究报道NTN1在膀胱癌[13]、胃癌[14]、非小细胞肺癌[15]等多种恶性肿瘤中表达异常升高。然而,在早期胰腺癌组织中NTN1呈低表达,并通过下调MEK/ERK通路和抑制整合素β4(ITGB4)表达而抑制早期胰腺癌细胞生长[16]。NTNG1作为Netrins家族的新兴角色,同样发挥类似功能[7]。有研究报道在结肠癌中,NTNG1高表达患者发生DNA甲基化的频率增加,且与患者预后不良相关[17]。而在无蒂锯齿状腺瘤/息肉(SSA/P)和锯齿状腺瘤标本中,ANDREW等[18]研究发现NTNG1的甲基化区域存在差异性,采用甲基化特异性聚合酶链反应检测其甲基化状态,有助于描述SSA/P的生物学特性,成为患者鉴定和监测指标。本研究检测NTNG1蛋白在肝细胞癌中的表达,发现与癌旁组织相比,NTNG1在肝细胞癌组织中显著高表达,且与患者年龄、门脉高压、腹水、AFP、白细胞水平、总胆红素水平、肿瘤包膜及微血管密度等不良特征相关,生存分析也显示NTNG1高表达患者预后不良,进一步行Cox回归分析证实NTNG1高表达是预后不良的独立危险因素,说明NTNG1可能参与肝细胞癌发生并在其中发挥促癌作用。
相对于肝组织标本,血清检测具有创伤性小、操作简便等优点,也更利于临床推广。为此,本研究采集了门诊就诊的肝细胞癌患者以及对照患者包括肝炎患者、健康受试者、其他肿瘤患者等共90例受试者血清,结果所有受试者均能检测到NTNG1表达,且肝细胞癌患者血清中NTNG1的表达水平明显高于健康受试者及其他肿瘤患者,与其在肝细胞癌组织中的表达类似;此外ROC曲线分析显示,NTNG1诊断肝细胞癌的AUC为0.8251,灵敏度和特异度分别为84.62%和76.56%,说明NTNG1在肝细胞癌中的表达具有一定特异性,且诊断效能良好,可能是潜在的肝细胞癌早期诊断标志物。
综上所述,NTNG1在肝细胞癌患者组织及血清中呈高表达,且NTNG1高表达是预后不良的独立危险因素,血清NTNG1对肝细胞癌患者也具有良好的诊断效能,因此NTNG1可能是肝细胞癌患者潜在的早期诊断及预后评估指标。但本研究为单中心小样本分析,NTNG1在肝细胞癌中的作用仍需进一步研究验证。

