miR-7及SP-1与非小细胞肺癌患者放疗敏感性的相关性研究
唐朝 李建民 潘婵苑 谭文文 刘慧
作者单位:410000 长沙 湖南师范大学附属第一医院(湖南省人民医院)呼吸与危重症医学科
肺癌是目前人类因癌症死亡的主要原因之一,在全球癌症相关死亡中肺癌占20%以上,而非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的80%[1-2]。放疗是不可手术切除NSCLC患者的主要治疗方案,术后放疗也可使患者获益[3],因此放疗敏感性的预测生物标志物成为临床关注的焦点之一。微小核糖核酸(miRNAs)可通过调节肿瘤相关基因的表达,发挥肿瘤抑制或促癌基因作用[4]。既往研究显示,miR-7作为一种肿瘤抑制因子,主要通过激活表皮生长因子受体信号通路增强肿瘤细胞放射敏感性[5]。特异性蛋白 1(specific protein 1,SP-1)是肿瘤发生、DNA双链断裂修复和调节肿瘤放射敏感性的关键转录因子,据报道SP-1表达受到上游miR-7调控[6]。然而miR-7及其下游靶分子SP-1对NSCLC放疗敏感性的作用尚未明确。本研究旨在探讨miR-7及SP-1与NSCLC患者术前放疗敏感性的关系,以期寻找NSCLC放射增敏靶点和预后监测指标。
1 资料与方法
1.1 研究对象
收集2018年7月—2020年9月于本院治疗的116例原发性NSCLC患者癌组织及其匹配的癌旁组织(距离肿瘤边缘>2 cm),所有组织切除后立即置于液氮中,-80℃冰箱保存。放疗前,所有患者均抽取晨起空腹静脉血5 mL,离心后留取上清样本并保存于-80℃冰箱中。纳入标准:⑴初诊,接受放疗进行根治性切除术;⑵放疗前未接受化疗、手术、靶向治疗等抗肿瘤治疗;⑶ECOG状态评分0~2分;⑷具有RECIST规定的可测量病灶。排除标准:⑴同步放化疗或放疗期间接受其他抗肿瘤治疗的患者;⑵既往有胸部放疗史和重要器官功能障碍患者。所有患者在完成放疗计划后评估治疗反应。本研究遵循赫尔辛基宣言,研究方案获得本院伦理委员会的批准,患者或家属签署知情同意书允许使用其临床资料。
1.2 放疗方案及疗效评估
采用3~7野共面三维适形或调强放射治疗,处方剂量为 45.0~50.4 Gy,常规分割 25~28次,单次剂量1.6~1.8 Gy(6~18 MV X射线),每周5次,共5.0~6.5周。使用PET/CT和四维CT制定放射计划,计划靶体积(planning target volume,PTV)边缘距离临床靶体积0.5~1.5 cm。2~3周后进行根治性切除术,根据Dowrak/Rodel标准评估肿瘤退缩程度(tumor regression grading,TRG),0级:完全退缩;1级:<25%肿瘤区域纤维化;2级:26%~50%肿瘤区域纤维化;3级:>50%肿瘤区域纤维化;4级:无活性退缩细胞(完全缓解)。将TRG 4级定义为放疗敏感,其余定义为放疗抵抗。
1.3 实时荧光定量PCR法检测miR-7的表达水平
取250 μL血清加入TRIzol试剂(TaKaRa,日本)750 μL,或者在进行研究前取出冻存的组织研成粉,加入1 mL TRIzol试剂混匀。将溶液高速涡旋15 s,孵育5 min。用Qiagen miRNeasy Mini试剂盒或miRNA血清提取试剂盒(Qiagen,德国)提取组织匀浆和血清中总RNA。采用紫外分光光度计测定RNA的浓度,凝胶电泳检测RNA的完整性。再使用miRNA First Strand cDNA合成试剂盒(TaKaRa,日本)合成cDNA。取1 μg cDNA模板,用SYBR Premix Ex Taq(TaKaRa,日本)试剂盒配制PCR反应体系20 μL,在ABI 7500型实时荧光定量热循环仪上进行PCR扩增,94℃预变性2 min,1个循环;94℃变性30 s,55℃退火45 s,72 ℃延伸60 s,共35次循环。miR-7正向引物:5′-GGCAGACTGTGATTTGTTGTCG-3′;miR-7反向引物:5′-GTTGGCCTAGTTCTGTGTGGA-3′。加入外源性celmiR-39作为小分子内参,采用2-△△Ct计算miR-7表达水平。
1.4 免疫组化检测SP-1蛋白表达水平
取福尔马林固定、石蜡包埋的组织蜡块,连续切片(4~5 μm),脱蜡水化。染色前用0.01 mol/L柠檬酸盐缓冲液处理,双重内源封闭剂封闭切片的内源蛋白结合和过氧化物酶活性10 min,然后用缓冲液洗涤。切片与SP-1特异性抗体孵育30 min,洗涤后再将切片与EnVision、双连接试剂(与山羊抗小鼠免疫球蛋白和辣根过氧化物酶结合的聚合物)孵育30 mim。洗涤后,用二氨基联苯胺和过氧化氢处理得到最终产物。加入显色剂后观察染色情况。
SP-1蛋白主要存在细胞核,根据着色强度和阳性细胞比例乘积判断SP-1免疫组化结果,其中着色强度分为0分(阴性染色)、1分(浅黄色)、2分(棕黄色)、3分(褐色、黑色);阳性细胞占比判定:1分(≤10%)、2分(11%~50%)、3分(51%~75%)、4分(>75%)。SP-1阳性定义为染色强度与阳性细胞数积分乘积≥3。组织化学染色和TRG评估结果由两位病理科医师独立完成。
1.5 统计学方法
采用SPSS 26.0和GraphPad Prism 6.0软件进行数据分析。使用Kolmogorov-Smirnov检验数据的正态性,服从正态分布的计量资料以均数±标准差()表示,两组间比较采用独立样本t检验;但NSCLC患者肿瘤组织和癌旁组织miR-7表达水平比较采用配对样本t检验;多组间比较采用单因素方差分析。偏态分布的计量资料以中位数(P25,P75)表示,组间比较采用Wilcoxon秩和检验;分类资料以n(%)表示,组间比较采用χ2检验,但癌旁组织和肿瘤组织中SP-1阳性表达比较采用配对χ2检验。采用Logistic回归分析影响NSCLC患者放射敏感性的因素。Pearson相关分析检验血清miR-7与肿瘤组织miR-7表达的关系,受试者工作特征(receiver operating characteristic,ROC)曲线分析血清miR-7 表达预测 NSCLC 放射敏感性的价值。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 miR-7、SP-1在NSCLC患者中的表达情况
实时荧光定量PCR检测结果显示,NSCLC患者癌组织中miR-7的相对表达量低于癌旁组织(0.596±0.242vs1.072±0.288,P<0.001)。免疫组化检测结果显示,癌组织中SP-1阳性表达率高于癌旁组织(70.69%vs39.66%,P<0.001),见图1。Pearson相关分析显示,血清中miR-7的表达水平与其在癌组织中表达水平呈正相关(r=0.492,P<0.001),见图2。SP-1表达阳性患者血清中的miR-7相对表达量低于阴性表达患者(0.18±0.10vs0.24±0.11,P=0.005)。
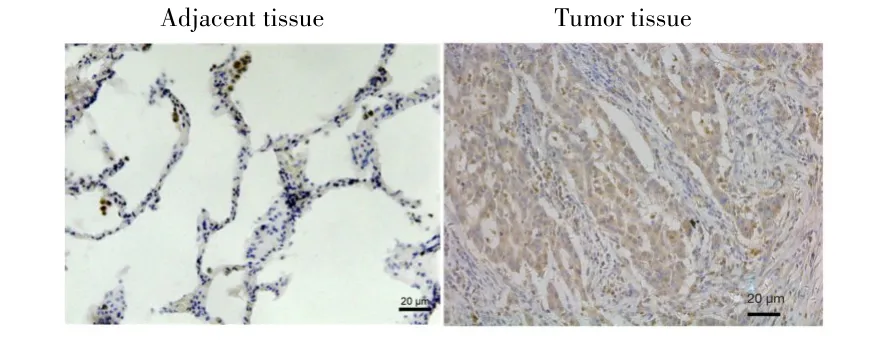
图1 免疫组化检测NSCLC癌组织及其癌旁组织中SP-1蛋白的表达(×200)Fig.1 SP-1 protein expression in NSCLC tumor tissues and adjacent tissues detected by immunohistochemical staining(×200)
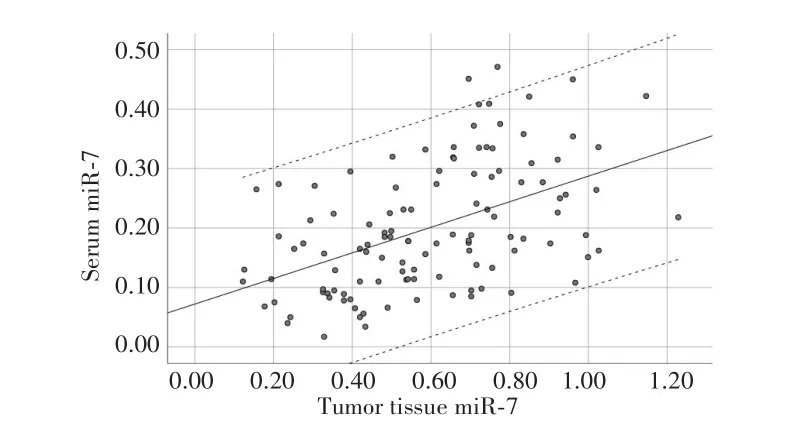
图2 血清miR-7表达与肿瘤组织miR-7表达的相关性Fig.2 Correlation between serum miR-7 expression and tumor tissue miR-7 expression
2.2 miR-7及SP-1表达与NSCLC患者临床病理特征的关系
miR-7及SP-1表达与T分期、TNM分期、吸烟、放射性肺损伤均有关(P<0.05),其中T3~4分期、TNM分期ⅢA~B期、有吸烟史、发生放射性肺损伤的NSCLC患者血清和癌组织中miR-7表达降低(均P<0.05),癌组织中SP-1阳性表达率升高(均P<0.05)。见表1。
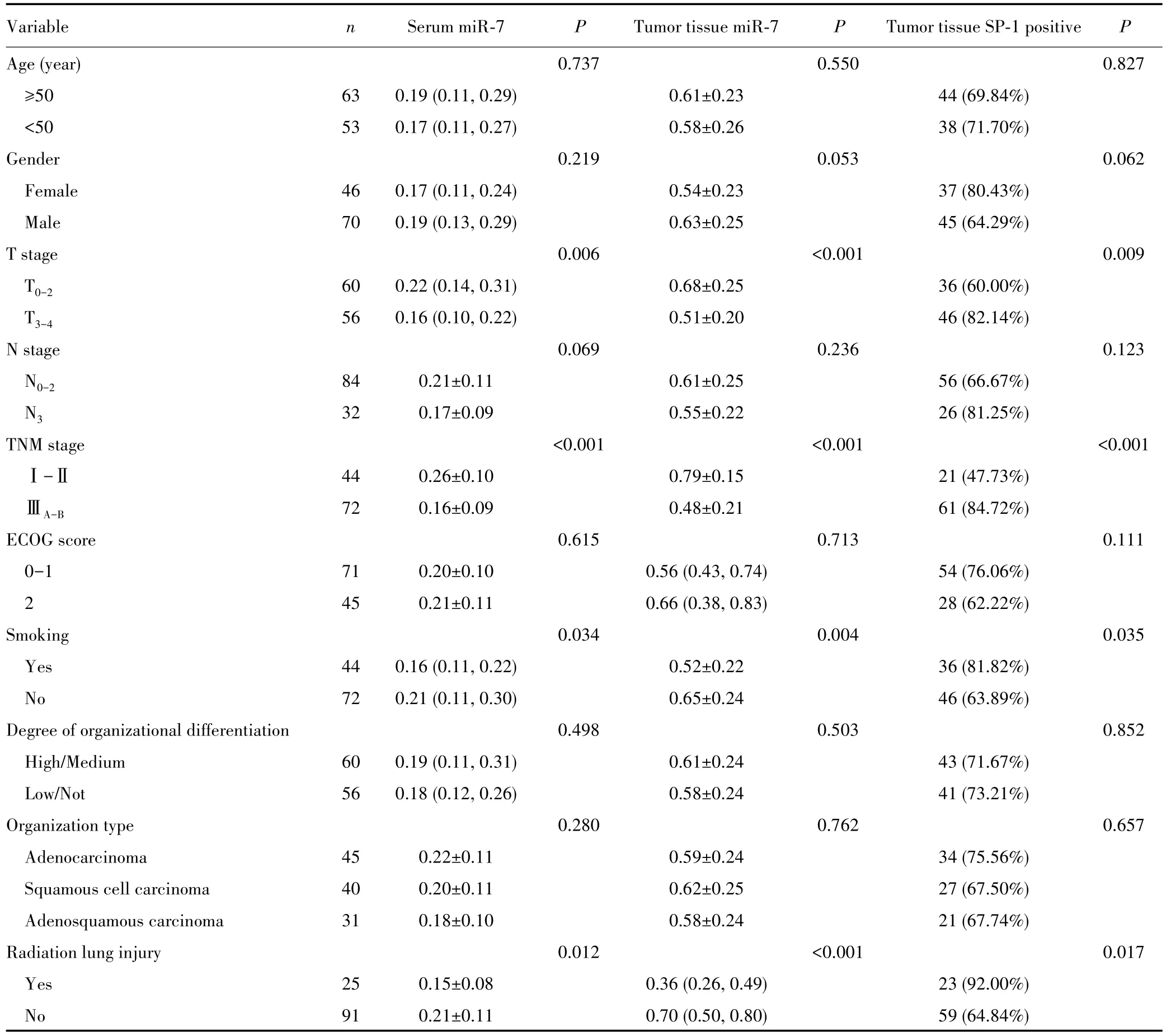
表1 血清miR-7、组织miR-7及SP-1表达与NSCLC患者临床病理特征的关系Tab.1 Relationship between the expression of serum miR-7,tumor tissue miR-7,tumor tissue SP-1 and clinicopathological characteristics in NSCLC patients
2.3 血清中miR-7预测NSCLC患者放疗敏感性的效能
与放射抵抗组比较,放射敏感组患者血清(0.15±0.08vs0.27±0.10,t=7.063,P<0.001)和癌组织中miR-7表达水平(0.45±0.17vs0.83±0.15,t=12.285,P<0.001)明显升高,而SP-1阳性表达率降低(87.32%vs46.67%,χ2=22.370,P<0.001)。
ROC曲线显示,血清中miR-7预测NSCLC患者发生放射抵抗的曲线下面积(AUC)为0.822(95%CI:0.746~0.897,P<0.001),截断值为0.17,灵敏度和特异度分别为0.844、0.662,约登指数为0.506。见图3。
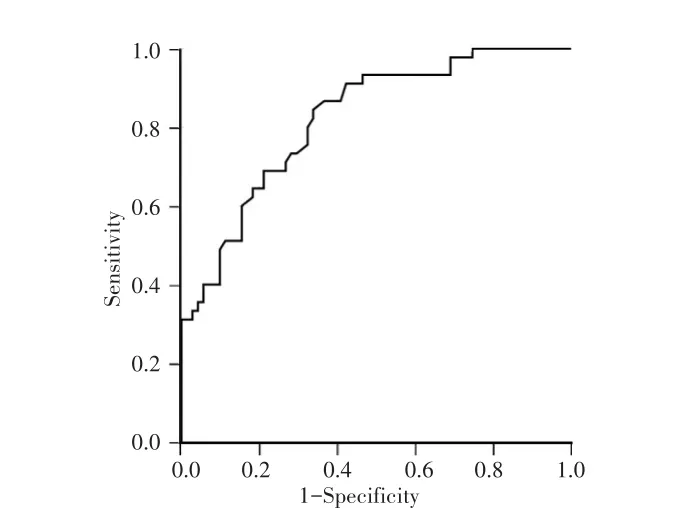
图3 血清miR-7对NSCLC患者放疗敏感性的ROC曲线Fig.3 ROC curve of serum miR-7 to radiotherapy sensitivity of NSCLC patients
2.4 NSCLC患者放疗敏感性的单因素和多因素分析
采用Logistic模型分析影响NSCLC患者放疗敏感性的因素,血清miR-7以ROC曲线的截断值作为分界值进行赋值,单因素Logistic回归分析显示,肿瘤T分期、TNM分期、吸烟史、放射性肺损伤、血清miR-7水平与放疗敏感性有关(均P<0.05);将上述变量纳入多因素Logistic模型,结果显示肿瘤T分期、TNM分期以及血清miR-7水平是影响放疗敏感性的独立因素(均P<0.05)。见表2。
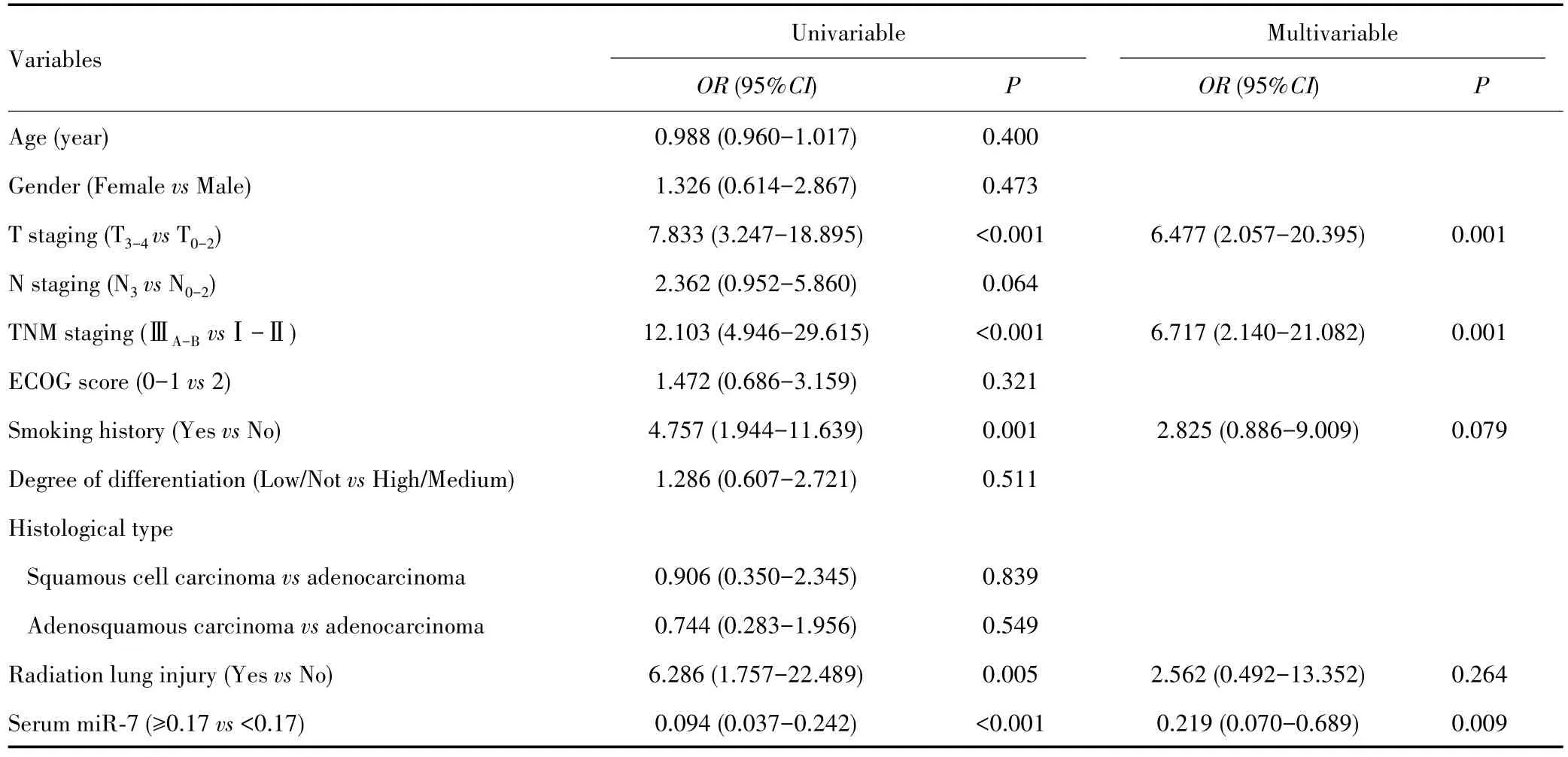
表2 Logistic模型分析影响NSCLC患者放疗敏感性的因素Tab.2 Logistic model analysis of clinical factors affecting radiotherapy sensitivity of NSCLC patients
3 讨论
放疗是NSCLC治疗体系中的重要手段,但是部分患者会产生放射抵抗,导致治疗失败,从而影响患者生存预后[7-8]。放射线可以同时损伤DNA和核外靶点,通过激活多种信号通路诱导细胞凋亡[9]。miRNAs是信号传导途径中重要的调节因子,也是反映放射敏感性的有效指标。本研究发现NSCLC患者血清miR-7水平与放疗疗效有关,其表达水平降低是影响放射敏感性的独立危险因素,且miR-7表达水平与其下游靶基因SP-1表达密切相关,因此检测血清miR-7水平是预测NSCLC患者放疗敏感性的有效途径,miR-7/SP-1可能是放疗增敏的潜在靶点。
既往研究显示,miR-7在多种肿瘤中作为肿瘤抑制因子发挥作用。如ZHU等[10]在人卵巢癌细胞A2780中发现,ALKBH5异位表达增加了细胞中EGFR的表达,而miR-7表达上调后,这种调节机制被抑制。也有研究在NSCLC组织中发现miR-7-5p表达下调,且上调miR-7-5p能抑制A549、SPCA-1细胞增殖、迁移能力[11]。本研究检测收集的NSCLC患者癌组织也发现miR-7表达水平较癌旁组织明显降低,且随着肿瘤进展,血清和癌组织中miR-7的表达水平进一步降低,说明在NSCLC中miR-7也扮演着抑癌基因角色。此外,miR-7与放疗敏感性的关系也有较多报道。如在乳腺癌细胞系中发现miR-7表达下调,且过表达miR-7可通过逆转沉默的致癌环状miRNA CDR1as增强细胞放疗敏感性[12]。GUO 等[13]在肺腺癌细胞(A549)和肺鳞癌细胞(SK-MES-1)中也发现上调miR-7表达可通过抑制下游SP-1蛋白表达进而增强细胞辐射效应,并降低放射后的细胞存活率。此外,miR-7还能通过激活EGFR信号通路增强多种肿瘤细胞包括肺癌细胞放射敏感性[14],外泌体miR-7通过调控Bcl-2参与脑照射后未接受照射细胞的自噬[15]。以上研究说明miR-7可能参与放射抵抗的发生,本研究也得出类似结果,即相比放射敏感组,放射抵抗组中血清和癌组织的miR-7水平均降低,且Logistic模型分析显示血清miR-7水平降低是影响NSCLC患者放疗敏感性的独立危险因素。
本研究还发现miR-7表达水平与其下游靶分子SP-1蛋白表达呈负相关。既往研究报道SP-1基因沉默可增加细胞对DNA损伤的敏感性[16],也可导致染色体异常积累,进而影响DNA修复。此外,SP-1蛋白还能调控参与细胞周期、细胞分化及肿瘤发生等相关基因。如KINOUCHI等[17]证明敲除SP-1基因可以降低人肺癌细胞株A549的恶性化潜能,并影响糖基转移酶的表达。ZHANG等[18]发现二甲双胍能以浓度依赖性的方式下调SP-1表达水平,进而增加肝癌SMMC-7721细胞的放射敏感性。在肺癌细胞中,SP-1过表达通过上调ATP结合盒转运蛋白家族G2的表达而影响化疗耐药性[19]。SP-1也能通过减少G2/M期宫颈癌细胞停滞增加放射抗性[20]。关于miR-7与SP-1的关系,有研究报道miR-7可直接靶向SP-1基因导致其下游分子表达的改变[7,13]。刘文莉等[21]亦通过双荧光素酶报告基因实验验证发现miR-7对SP-1有负性调控作用。本研究也发现miR-7水平降低与肿瘤组织中SP-1蛋白表达升高有关,说明miR-7可能通过靶向调控SP-1基因的转录后翻译过程,从而影响肿瘤细胞的DNA损伤修复,进而参与调节放疗敏感性,具体作用机制有待进一步深入研究。
综上所述,NSCLC患者癌组织及外周血清中miR-7表达水平降低,且血清miR-7低表达是放疗敏感性的独立危险因素,检测血清miR-7水平在预测放疗抵抗中具有良好的效能。而miR-7与其下游靶基因SP-1表达呈负相关,提示miR-7/SP-1轴可能是NSCLC放疗增敏的潜在靶通路,为探索NSCLC患者放疗抵抗的分子机制提供了新的思路。

