LATS1/2在卵巢癌细胞化疗中的作用研究
程颖颖,於子翔,徐露佳,高梦叶,刘胜兵
(嘉兴学院医学院,浙江 嘉兴 314000)
0 引言
作为妇科恶性肿瘤,卵巢癌严重危害女性生命健康。化疗是目前卵巢癌治疗的重要手段,虽然化疗可以提高卵巢癌患者生存率,但随着用药时间的延长,化疗抗性难以避免[1],降低化疗抗性,则可以提高临床疗效。Hippo信号通路在调节细胞增殖和凋亡,以及对干细胞调控中都有重要作用,Hippo信号通路与癌症发生发展有紧密联系。Hippo信号通路中,Mst1/2激酶与SAV1形成复合物,继而磷酸化LATS1/2,随后磷酸化的LATS1/2激酶可以磷酸化Hippo信号通路下游关键效应分YAP/TAZ,抑制YAP/TAZ转录活性。研究发现,LATS1/2基因敲除可抑制卵巢癌细胞ES-2的增殖,克隆形成和迁移,人卵巢癌细胞ES-2中敲除LATS1/2可以促进细胞凋亡,影响细胞周期。关于ES-2中敲除LATS1/2后,对卵巢癌细胞的化疗效果和耐药性的影响,未做进一步研究。本研究以LATS1/2敲除的卵巢癌细胞ES-2为研究对象,以顺铂处理卵巢癌细胞,通过检测化疗药物处理后的卵巢癌细胞转移侵袭能力、化疗抗性检测以及通路中的YAP蛋白的表达情况,初步阐明LATS1/2在卵巢癌细胞化疗中的作用。
1 材料和方法
1.1 材料
DMEM培养基、胰蛋白酶、青链霉素购自Hyclone公司;胎牛血清购于Gibco公司;β-actin、LATS1、LATS2、p-YAP抗体购自Cellsignaling公司;YAP、p-Taz和Taz抗体购自SantaCruze。
1.2 细胞培养
卵巢癌ES-2细胞和LATS1/2敲除的ES-2细胞由本实验室保存于-80℃冰箱,取ES-2细胞复苏至,用加1%青链霉素的含10%胎牛血清的DMEM,在37℃、5%CO2的培养环境培养。隔天换液至细胞密度到90%后,分盘接种到10cm培养皿继续培养。
1.3 CCK8检测细胞增殖
将对数生长期ES-2细胞悬液和LATS1/2敲除的ES-2细胞悬液分别以每孔100μL接种于 96 孔板,实验组分别加入DDP 5、20和100μg/mL。各组细胞设 3 个复孔,细胞密度为10000个/孔,96 孔板置于37℃、5% CO2培养箱培养48h后每孔加入20μL CCK-8 溶液和80μL培养基后避光置于培养箱中,2h 取材96孔板,酶标仪检测 450nm 处的吸光度(OD)值。
1.4 细胞迁移实验
培养到对数生殖期的将WT组与LATS1/2 KO的ES-2细胞各分为对照组和实验组,实验组加DDP 0.5μg/mL 24小时,各组细胞计数,取细胞悬液(3×103)100μL加置培养板,并加入无血清培养基200μL。培养板下室加入500μL无血清培养液,培养12h后用预冷后的甲醇固定细胞30min后进行苏木精染色,染色时间30s,显微镜下取10个视野计数。
1.5 细胞凋亡检测
将WT与LATS1/2 KO的ES-2细胞各分为对照组和实验组,实验组加DDP 0.5μg/mL,24小时,计数取1×106个细胞,预冷PBS洗涤3次后重悬细胞,取100μL置于1.5mL离心管(细胞浓度1×105),室温下避光15min后流式细胞仪检测。
1.6 western blotting 检测
将WT与LATS1/2 KO的ES-2细胞各分为对照组和实验组,实验组加DDP 0.5μg/mL,24小时后收各组细胞后加入适量RIPA蛋白质裂解液冰上消化30min,后高速离心机4℃下10000rpm15min,取上清,BCA试剂盒检测蛋白浓度后,调整各组蛋白浓度加5×蛋白质上样缓冲液,充分混合后95℃水浴加热5min,水浴后置于冰上冷却。各组样品10μL加至浓缩胶上样孔中,100min后结束电泳,湿转90min后取膜,室温下用5%脱脂奶粉封闭1h,PBST洗3次/5min。4℃一抗孵育过夜后用PBST洗膜,3次/5min。室温二抗处理1h后PBST洗膜3次/10min,ECL发光试剂盒显影。
1.7 数据统计分析
均数±标准差的统计学方法处理数据,组别之间通过t检验分析和One-wayANOVA检验分析。当P<0.05时表示差异有统计学意义。
2 结果
2.1 Lats1/2 KO的ES-2细胞鉴定
本实验室之前通过慢病毒载体构建Lats1/2KO的卵巢癌ES-2细胞,通过western检测Lats1/2 KO的ES-2细胞,结果显示,Lats1/2 KO的ES-2细胞中Lats1/2表达明显减少(图1A)。
2.2 DDP对Lats1/2 KO的ES-2细胞增殖的影响
CCK8实验结果显示,DDP处理后的LATS1/2敲除细胞增能力降低(图1B)。

图1 A western检测LAST1/2 敲除效果图1B CCK8检测LAST1/2敲除后对DDP作用的影响
2.3 DDP对Lats1/2 KO的ES-2细胞迁移的影响
Transwell小室实验检测LATS1/2 KO后的ES-2细胞迁移,DDP处理前后,野生型ES-2细胞迁移效率明显高于LATS1/2 KO组和两组DDP加药组(P<0.05),LATS1/2 KO 细胞在加药前后迁移没有明显变化(图2)。
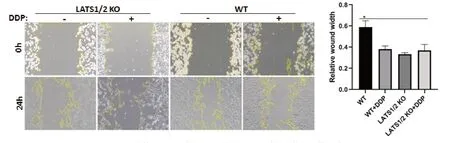
图2 Transwell实验检测DDP对ES-2细胞LATS1/2 敲除后的迁移的影响(*P<0.05)
2.4 DDP对Lats1/2 KO的ES-2细胞凋亡的影响
流式细胞术检测DDP对Lats1/2 KO的ES-2细胞凋亡的影响,结果显示,Lats1/2 KO后对细胞凋亡无明显影响(图3)。
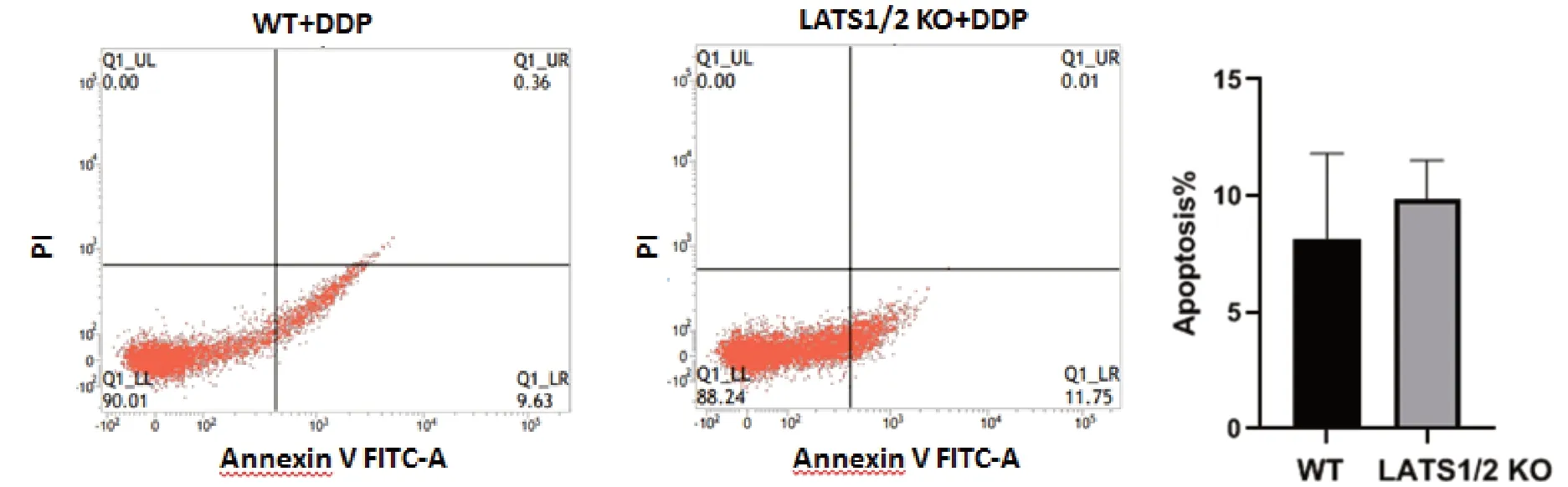
图3 流式细胞术检测DDP对ES-2细胞LATS1/2敲除后的凋亡的影响
2.5 DDP对Lats1/2 KO的ES-2细胞中YAP和p-YAP的表达影响
western blotting检测Lats1/2 KO的ES-2细胞中YAP和p-YAP在DDP处理前后的影响,结果发现,DDP处理Lats1/2 KO的ES-2细胞中,YAP和p-YAP的表达无明显变化(图4)。

图4 western检测DDP对LATS1/2敲除后的ES-2细胞中YAP和PYAP表达的影响
3 讨论
Hippo通路最初是在黑腹果蝇中发现的,Hippo通路在组织稳态中发挥核心作用。Hippo通路调节许多生物过程,包括细胞生长和命运决定,器官大小控制和再生。哺乳动物Hippo通路的核心包括激酶级联,MST1/2和LATS1/2,以及下游效应物,转录共激活物YAP和TAZ[2]。Hippo通路其失调可导致肿瘤发生,其核心成分(MST1/2、LATS1/2、YAP和TAZ)的突变和表达改变促进了癌细胞的迁移、侵袭和恶性[3]。LATS1/2是一种肿瘤抑制因子,在包括白血病、肺癌、前列腺癌和乳腺癌在内的几种人类癌症中已显示出突变或下调,LATS1/2可以作为肿瘤抑制基因发挥作用,LATS1/2被敲除后可导致细胞增殖增强,对药物诱导的细胞死亡的抗性,以及细胞迁移的增加,LATS1/2通过多种机制和多种信号通路发挥作用,包括Hippo信号通路,以及p53、Ras-ERK或WNT网络,以抑制肿瘤进展[4]。LATS1/2磷酸化并抑制Hippo途径的主要效应因子YAP/TAZ,近来也有研究发现MST1/2不是调节YAP/TAZ所必需的[5]。胃癌中LATS1/2、CD8和FOXP3联合分析比单独使用单项指标有更好的预后准确性,LATS1/2作为Hippo通路的核心激酶,与CD8和FOXP3密切相关[6]。LATS1/2缺失可增强了肿瘤疫苗的有效性。在肿瘤中缺失LATS1/2可提高肿瘤的免疫原性,通过增强抗肿瘤免疫应答而破坏肿瘤,靶向LATS1/2在癌症免疫治疗有一定的意义[7]。LATS1/2通过调控Hippo通路、EMT和细胞分裂来触发肿瘤干细胞的自我更新[8]。YAP和下游TEAD家族是维持可能参与卵巢癌干细胞干性和化疗耐药的特定基因表达所必需的,YAP/TEAD共激活剂调节卵巢癌起始细胞多能性和化疗耐药[9]。YAP/TAZ与TEAD家族共激活因子结合,促进癌细胞存活、增殖、侵袭性迁移和转移。YAP/TAZ激活也可能导致对化疗、放疗或免疫治疗的耐药性[10]。
甲氨蝶呤和阿霉素提高了哺乳动物MST1的降解,降低了LATS1/2的总蛋白水平,增加了YAP的激活和核转位。YAP能增强MG63细胞的增殖能力和耐药能力[11]。研究发现丝氨酸/苏氨酸激酶MK5是YAP的正调节因子。MK5与YAP发生物理作用,不依赖于LATS1/2抑制CK1δ/ε介导的YAP泛素化和降解。MK5可作为新的调控YAP稳定性的因子,独立于LATS1/2调控YAP,可作为癌症治疗的靶点[12]。关于LATS1/2在卵巢癌化疗中的作用,本实验通过DDP处理LATS1/2 KO的卵巢癌ES-2细胞,发现LATS1/2 KO后对细胞的迁移有一定的影响,这与前期的实验结果一致[13]。而DDP对LATS1/2 KO前后的增殖、迁移和凋亡并未有影响,通过western blotting实验,对DDP作用于野生型卵巢癌ES-2细胞后,YAP和p-YAP表达明显下降,LATS1/2 KO后,DDP处理前后,YAP表达变化不明显,初步说明在卵巢癌化疗抵抗中LATS1/2的作用不明显,YAP在DDP处理后的表达变化或许有其它的机制作用。

