小鼠羊水间充质干细胞的分离、培养及鉴定
吴航飞 王康淳 潘崎 程颖
间充质干细胞(mesenchymal stem cell,MSC)具有再生、多向分化以及免疫调节能力,可作为药用细胞移植到人体,缓解炎症反应,促进局部组织恢复,改善移植位点血运,并调节受者免疫环境,因而受到人们的关注[1]。MSC广泛分布于人体多种组织内,其中新生儿相关组织,如脐带、羊水、羊膜、胎盘组织等还可无创获取,伦理学争议较小,且细胞本身的突变风险较低,相对于成人来源细胞各方面能力更突出,是细胞治疗来源的最佳选择[2]。已有实验证明,人羊水中含有MSC[3]。但将人体细胞应用于实验动物,可导致强烈的免疫排斥反应,且羊水获取较为不便,因此,若是能从实验动物体内提取羊水MSC(amniotic fluid-derived MSC,AF-MSC),将更有利于基础实验研究。
C57BL/6小鼠是目前主流的实验动物之一,本实验从C57BL/6怀孕母鼠体内分离出子宫,首次成功提取小鼠AF-MSC,并对其进行细胞鉴定,为细胞移植相关治疗方案提供新的细胞来源及研究思路。
1 材料与方法
1.1 实验动物与试剂
无特定病原体(specific pathogen free,SPF)级C57BL/6小鼠购于北京维通利华实验动物技术有限公司,进行常规喂养,使其自然交配,在母鼠怀孕约12 d时抽取羊水。小鼠AF-MSC的分离、培养、鉴定均在中国医科大学附属第一医院器官移植实验室完成,并得到中国医科大学伦理委员会批准。
细胞培养基、胎牛血清、胰酶均购于美国Gibco公司,CCK-8试剂盒购于美国APExBIO公司,台盼蓝染色液购于北京索莱宝科技有限公司,三系分化诱导试剂盒购于赛业(苏州)生物科技有限公司。干细胞抗原(stem cell antigen,Sca)-1、CD29、CD44、CD34、CD45流式抗体均购自美国Thermo Fisher公司。
1.2 AF-MSC分离与培养
脱颈处死孕鼠,75%酒精浸泡消毒,剖开腹部,分离子宫,将其置于磷酸盐缓冲液(phosphate buffer saline,PBS)中清洗,尽可能去掉血渍。使用镊子提起并固定子宫壁一段,另一只镊子沿子宫长轴将胎鼠向下压,将羊水挤压至上极,形成一个小水泡,此时使用1 mL注射器将羊水抽出。获取羊水后,采用70 μm孔径的细胞筛网对其进行过滤,收集滤液,300×g离心5 min,去除上清,PBS清洗后再次离心,去除上清,将细胞沉淀置于培养皿(直径3 cm)中,加入培养基,置于细胞培养箱(37 ℃,5% CO2)中培养72 h。
培养4 d后镜下观察,根据细胞密度决定是否进行换液。7 d时镜下观察,若细胞融合度达到80%~90%,则进行1∶2或1∶3传代;若细胞密度过低,则再次进行换液,待其融合度提升后传代。传代时,PBS清洗2次,尽可能去除残留的培养基,用胰酶消化1 min,加入含10%胎牛血清的培养基中止消化,反复吹打,将所获得的单细胞悬浮液300×g离心5 min。去除上清液,用完全培养基将细胞重悬,转移到新的培养皿中培养。
1.3 实验方法
1.3.1 AF-MSC生长曲线的绘制 取生长状态良好的第3、5、7代细胞(P3、P5、P7)进行消化,制成2×104/mL的细胞悬液。将细胞接种于96孔板,于细胞培养箱中培养,分别于培养的1、2、3、4、5、6、7 d测量吸光度(absorbance,A)。事先加入CCK-8试剂,每孔10 μL,然后置于培养箱中孵育1 h,酶标仪测定450 nm波长A值(型号PowerWave XS2,美国BioTek公司)。
1.3.2 AF-MSC表面标志物的鉴定 流式细胞术鉴定AF-MSC表面标志物,取生长状态良好的P1、P3、P5细胞,消化后用PBS重悬,制成1×108/mL单细胞悬液,加入 Sca-1、CD29、CD44、CD34、CD45抗体孵育30 min。PBS清洗后收集细胞沉淀,再用PBS重悬,取流式管,每管加入100 μL细胞悬液,加入PBS调整细胞浓度,上机检测(型号FACSCanto Ⅱ,美国BD公司)。
1.3.3 AF-MSC三系分化能力的检测 取P4 AF-MSC进行三系分化培养,诱导分化培养液根据说明书进行配置。将细胞以2×104/cm2的密度接种于6孔板,每孔加入普通完全培养基2 mL,置于培养箱中培养。当细胞融合度达到70%时,弃去原有的培养基,PBS清洗1~2次,随后加入诱导分化培养液(成骨诱导分化培养液、成脂诱导分化培养液),每隔3 d换液,成骨诱导25 d,成脂诱导21 d,随后用茜素红进行成骨染色,用油红O进行成脂细胞染色,然后置于显微镜下观察(型号TS100,日本Nikon公司)。
将4×105个细胞转移至15 mL离心管中,20 ℃,250×g离心4 min,去上清,加入0.5 mL成软骨诱导分化培养液重悬,20 ℃,150×g离心5 min,去上清,清洗细胞,随后再加入0.5 mL成软骨诱导分化培养液,150×g离心5 min,拧松离心管管盖以便于气体交换,将其竖立放置于37 ℃、5% CO2、饱和湿度的培养箱中,24 h后观察到细胞出现聚团现象,轻弹离心管底部,使得软骨球脱离管底而悬浮于培养基中,每隔3 d更换1次培养基,诱导21 d后进行切片和阿利新蓝染色,置于显微镜下观察(型号ECLIPSE 80i,日本Nikon公司)。
1.3.4 冻存AF-MSC的活力检测 细胞消化后100×g离心5 min,去上清,收集沉淀,加入1 mL无血清细胞冻存液,然后将细胞混匀,制成细胞混合液,转入冻存管中,及时置于−80 ℃环境冻存。
取出冻存管,立即放入37 ℃水浴锅中快速解冻。待冻存管中细胞混合液完全融化后,立即加入1 mL细胞培养液进行混合,然后将其加入5 mL细胞培养基中,300×g离心5 min,去上清,加入完全培养基,将细胞沉淀与培养基混匀,取0.1 mL细胞悬液与0.4%台盼蓝染色液0.9 mL混匀,3 min内用细胞计数板计数活细胞与死细胞,其中死细胞被染成蓝色,而活细胞呈无色透明状。细胞存活率(%)=活细胞总数/(活细胞总数+死细胞总数)。
1.4 研究内容
观察P0、P2、P4 AF-MSC的形态。分析P3、P5、P7 AF-MSC的增殖特点。鉴定P1、P3、P5 AF-MSC表面标志物Sca-1、CD29、CD44、CD34、CD45的表达。检测P4 AF-MSC的三系分化能力。检测P3 AF-MSC冷冻复苏后的细胞活力和增殖能力。
1.5 统计学方法
采用GraphPad Prism 8软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示;采用Two-way ANOVA Turkey多重比较分析P3、P5、P7的AF-MSC增殖能力的差异;采用Two-way ANOVA Sidak多重比较分析冻存前后细胞增殖能力的差异。检验水准α=0.05。
2 结 果
2.1 AF-MSC的形态学观察
原代培养的AF-MSC形态学观察结果见图1,P0 AF-MSC基本上为梭形细胞,以局部细胞岛的形式呈现,其中含有较多的漂浮杂质细胞或死亡的细胞,还有少量的组织块(图1A、B)。P2 AF-MSC(图1C、D)与P4 AF-MSC(图1E、F)镜下呈现较为典型的梭形、漩涡状的细胞群(融合度>80%),大小相近,形态趋于一致,存在少许偏圆的杂质细胞,这可能是羊水中存在的异质性细胞,也可能是在培养的过程中,细胞形态发生了改变。
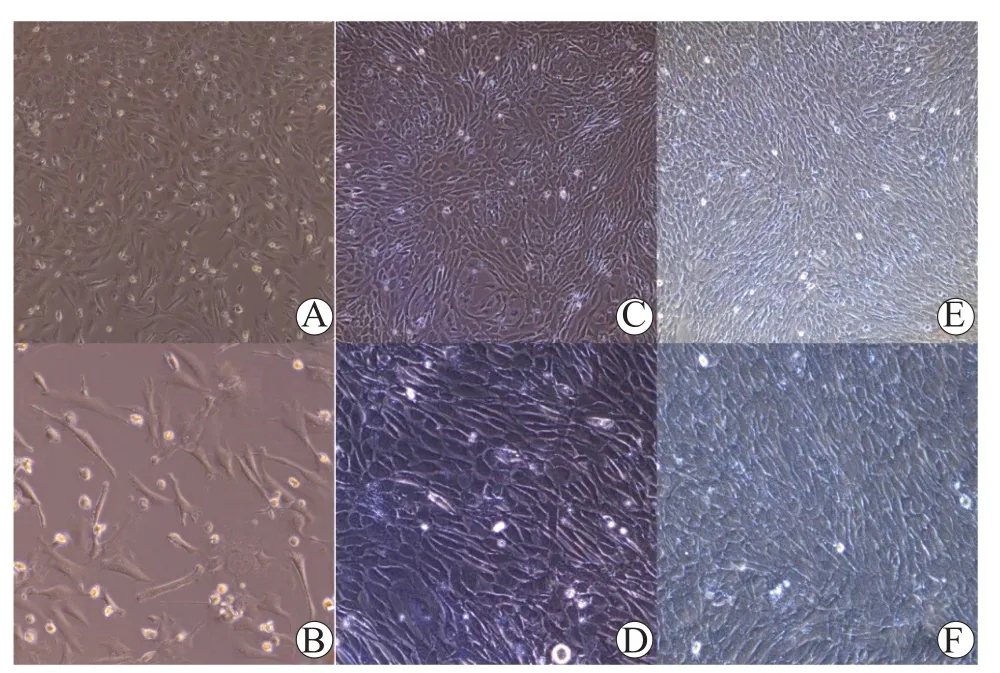
图1 AF-MSC的形态Figure 1 The morphology of AF-MSC
2.2 AF-MSC的增殖特点
小鼠AF-MSC的增殖曲线见图2。AF-MSC传代培养均无明显潜伏期,培养2~3 d进入对数增长期,增长速度最快,之后增殖速度减慢,进入平台期。P7 AF-MSC在7 d时的增殖能力优于P3,差异有统计学意义(P<0.05/3),其余时间段 P3、P5、P7 AF-MSC的增殖能力差异均无统计学意义(均为P>0.05)。

图2 AF-MSC的增殖曲线Figure 2 Proliferation curves of AF-MSC
2.3 AF-MSC表面标志物检测
P1、P3、P5 AF-MSC表面标志物检测结果见图3。AF-MSC表达 Sca-1、CD29、CD44(阳性率>90%),不表达CD34、CD45(阳性率<5%)。且随着传代次数的增加,CD29、Sca-1、CD44的阳性率逐渐上升,提示AF-MSC可以通过传代而得以纯化。
2.4 AF-MSC的三系分化
AF-MSC成骨分化后,矿化结晶被茜素红染成深红色的点状(图4A);成软骨分化后,分泌的酸性粘多糖被阿利新蓝染成淡蓝色(图4B);成脂分化后,胞质脂滴被油红O染成红色(图4C)。
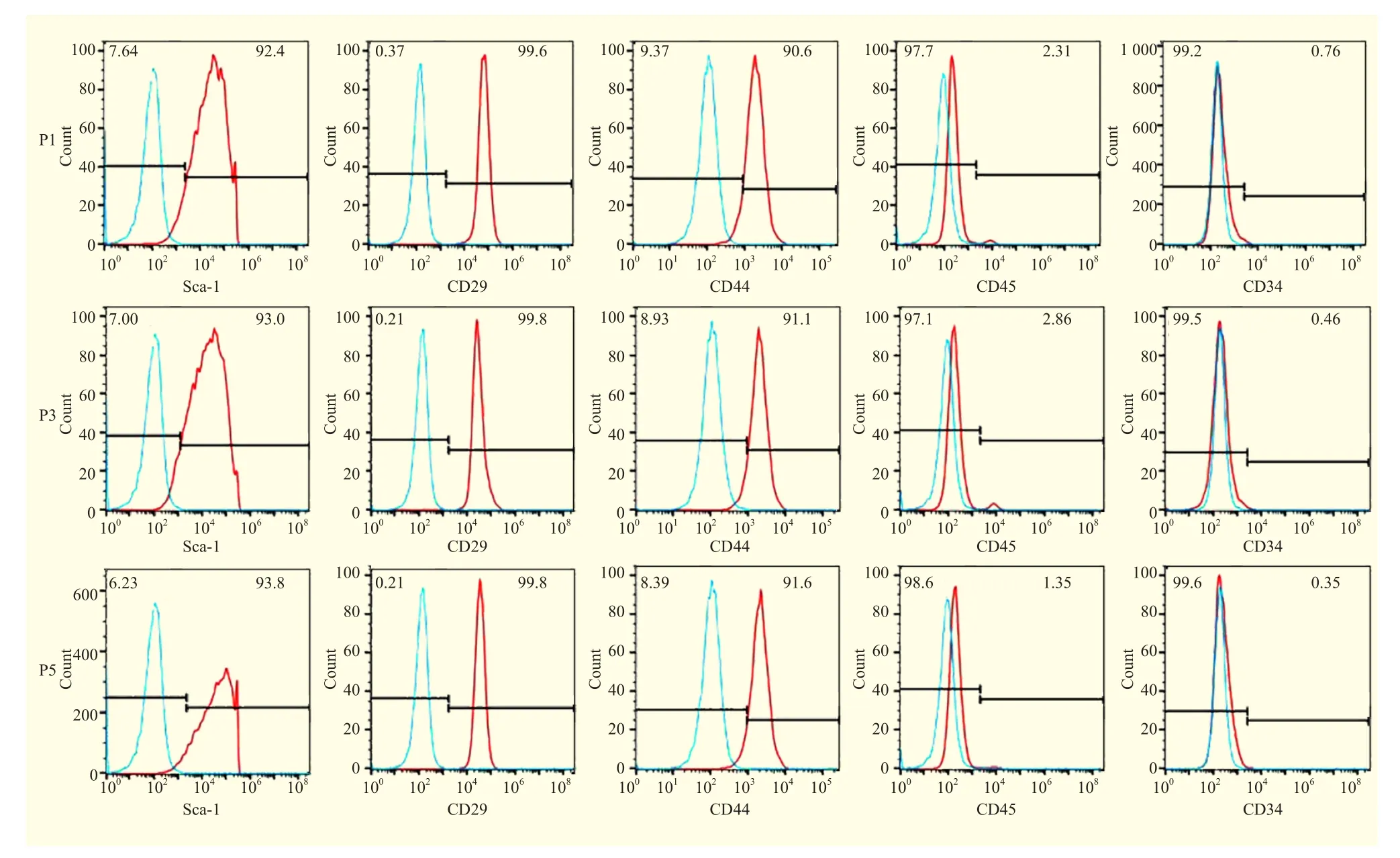
图3 AF-MSC表面标志物的流式细胞图Figure 3 Flow cytometry of surface markers of AF-MSC
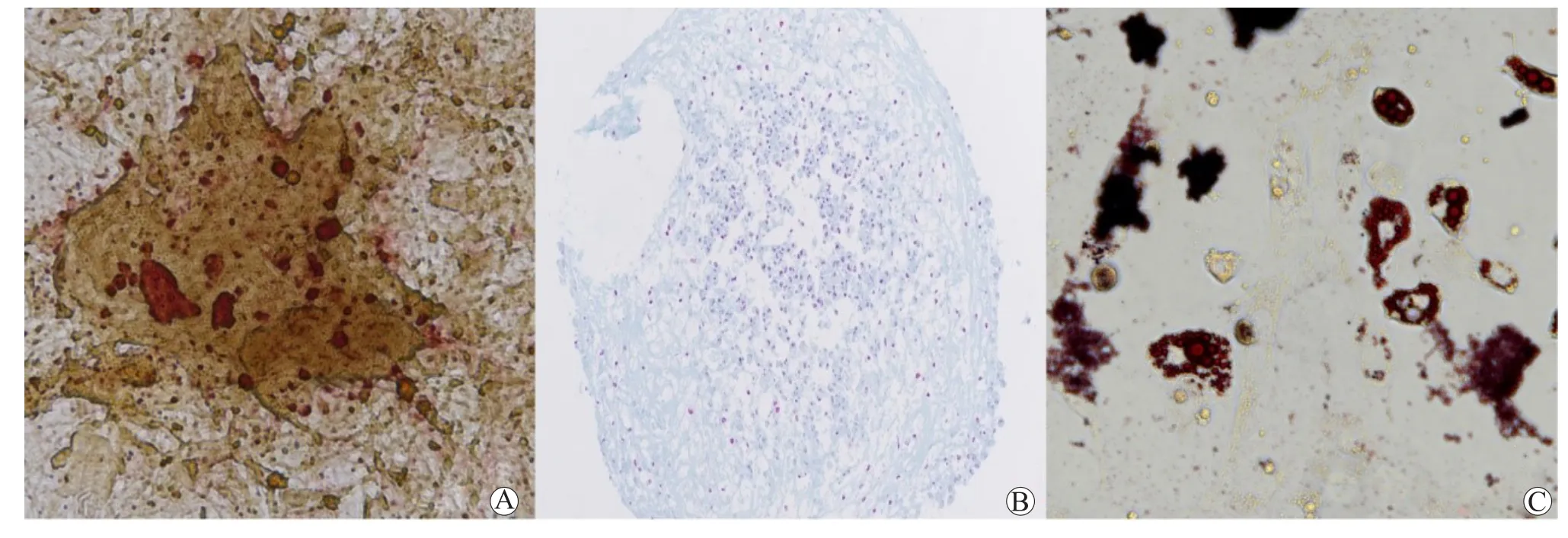
图4 AF-MSC的三系分化染色图Figure 4 The trilineage differentiation figures of AF-MSC
2.5 冻存AF-MSC复苏后的活力
冻存AF-MSC复苏后存活率>96%,生长状态良好。与冻存前比较,冻存AF-MSC复苏培养6 d时增殖能力升高,差异有统计学意义(0.779±0.013比0.818±0.027,P=0.027),其余时间冻存后AF-MSC的增殖能力差异均无统计学意义(均为P>0.05)。
3 讨 论
MSC最先由Friedenstein等[4]于1974年从骨髓中提取,后来在脂肪、皮肤、肌肉、牙髓、毛囊、胎儿附属物等各种不同组织中也提取出了MSC[5-7]。随着研究的深入,人们发现骨髓MSC随体外扩增次数的增加,增殖与分化能力明显下降,凋亡增加[8],而且获取方法均为有创,伦理争议较大,不利于其应用推广[9]。上述问题在成体干细胞中也都存在。因此,寻找一种能用作细胞治疗最优的MSC成为了新的研究目标。
早在2003年,就有研究者在孕中期羊水中发现了类似MSC的细胞[10-12],并认为此时期羊水中的细胞较为丰富,也因此引起了人们的关注。2007年,De Coppi等[13]在人源羊水中提取出MSC,并发现该细胞增殖代数可达250代,且增殖速度无明显改变,仍能够保持较长的端粒酶长度,总体特征与MSC类似,部分特性与胚胎干细胞类似,但不会形成畸胎瘤,首次将其定义为AF-MSC。AF-MSC介于成体干细胞与胚胎干细胞之间,可无创获取,伦理争议较小。与骨髓MSC相比,AF-MSC在体外增殖培养的过程中更不易衰老,自我DNA修复的能力更强[14],且拥有更强的旁分泌能力,移植后的修复能力也更强[15]。
人体羊水的收集较为困难,不利于进行深入研究。且人源细胞因实验伦理、作用机制未明确等原因不能直接应用于人体进行体内试验,而将其应用于实验动物,可能会导致迅速发生排斥反应,选择免疫缺陷动物则无法较好呈现其免疫调节能力。小鼠是目前实验室最常用的动物,是用于基础实验研究的理想模型,因此我们尝试从小鼠提取AF-MSC。羊水中的细胞来源多样,来源于各个胚层,其中的主要成分是来源于胎儿皮肤脱落的细胞,除此之外还有来自泌尿系统、呼吸系统、消化系统、脐带、胎膜等成分的细胞[16],根据细胞形态可将羊水细胞分为羊膜细胞(60.8%)、上皮样细胞(33.7%)和成纤维细胞(5.5%)[17]。这就意味着羊水来源的产品可能具有一定的异质性,导致其应用的不确定性和复杂性增加。本研究结果发现AF-MSC可以随着传代次数的增加得以纯化,不同孕期的羊水成分不同,细胞产品的活性也不同,什么时期的AF-MSC产量最高、性能最好?都有待研究人员更深入的探索。尽管还存在着不确定性,但AF-MSC的应用价值已经得到了初步肯定。有研究证明,AF-MSC能够对肺不同部位细胞的损伤做出应答,促进其修复[18]。Park等[19]实验证明,AF-MSC可通过Nanog基因的表达,增强自身的增殖能力,同时增强旁分泌作用,加速真皮乳头细胞活性,促进毛囊再生。Takov等[20]发现在缺血心脏模型中,AF-MSC可通过分泌作用保护心脏,促进血管生成。AF-MSC还具有修复能力和抗衰老能力[21-23],广泛应用于神经、骨再生等领域[24-25],具有较好的应用前景[26]。
为了满足基础实验研究,推进临床转化,本实验从小鼠体内成功提取AF-MSC,其形态与MSC典型形态大致相符[27],具有较强的增殖能力,且不会随着传代的增加(P0~P7)而衰减。细胞表面标志物鉴定结果显示,Sca-1、CD29、CD44表达阳性,CD34、CD45表达阴性,证明本实验分离的细胞为AF-MSC。
综上所述,MSC因其多向分化能力、免疫调节能力、低免疫原性而被人们所关注[28],筛选出性能最佳的细胞,研究其作用机制,将为许多疾病提供新的治疗思路和方法。本研究结果证实小鼠AF-MSC提取的过程较为简便,提取成本较低,细胞冻存复苏后存活率高,增殖能力未受影响,可长期保存以备实验之需,适合于基础实验研究。
致谢:感谢器官移植实验室李弘、于家楠、赵宁、许铁,普外实验室李越、张晓姣对该实验给予的帮助。

