移植肺病理学诊断标准及其进展
郭晖
在一个世纪的实验研究和临床研究的基础上,肺移植已经成为治疗终末期肺疾病的唯一有效方法,主要用于治疗各种原因所致的慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)或肺气肿、特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、囊性纤维化(cystic fibrosis,CF)、α1抗胰蛋白酶缺乏症(α1-antitrypsin deficiency,AATD)、原发性或继发性肺动脉高压及右心衰竭等。肺移植分为单肺移植、双肺移植和心肺联合移植3种方式,少数情况下施行肺叶移植(主要为活体肺叶移植)。肺移植术后移植肺可出现多种并发症,其确诊主要依据移植肺活组织检查(活检)。本文对移植肺病理学研究的简史、移植肺活检的主要方法及其病理学处理技术、肺移植术后主要并发症及其活检病理学诊断标准进行阐述。
1 移植肺病理学研究的简史
1.1 国际移植肺病理学研究的简史
在既往实验动物研究的基础上,1963年Hardy等在美国密西西比大学为1例58岁肺癌患者实施了首例人体肺移植,受者因肾衰竭仅存活了18 d,死后尸检对移植肺的病理学观察没有发现急性排斥反应的表现,这也是人体首例移植肺的病理学研究。紧随其后,1964年White等在加拿大多伦多大学也为1例31岁终末期硅沉着病患者实施了肺移植,受者仅存活了7 d,尸检病理学观察发现移植肺存在保存性损伤、急性细胞性排斥反应(acute cellular rejection,ACR)和主支气管坏死改变。随后1968年Cooley等实施了人体首例儿童心肺联合移植, 1971年Lillehi等也为COPD患者实施了肺移植,这些早期的临床研究由于无法克服支气管吻合口漏和排斥反应而失败,但都通过肺移植术后的解剖病理学研究初步观察了移植肺的病理学改变。随着20世纪80年代环孢素等新型免疫抑制剂的临床应用,美国斯坦福大学和加拿大多伦多大学分别重启了肺移植临床研究,随后越来越多的肺移植中心也稳步开展了肺移植,肺移植逐渐成为治疗终末期肺实质病变和血管病变的首选治疗方法,全球肺移植例数逐步增长。1990年在国际心肺移植学会(International Society of Heart and Lung Transplantation,ISHLT)的主持下制订了移植肺排斥反应活检病理学诊断及其分级标准(以下简称“ISHLT标准”),1995年ISHLT组织更多的肺脏病理学家,在参考了移植肺的纤维支气管镜活检病理学诊断经验的基础上,进一步对1990年ISHLT标准予以更新,提出了1996年ISHLT标准,进而在2004年整合多中心移植肺活检病理学研究的经验对1996年ISHLT标准予以更新,在2006年进一步结合了抗体介导的排斥反应(antibody-mediated rejection,AMR)的活检病理学特征对标准予以更新并于2007年发布了2007年ISHLT标准,一直沿用至今[1]。
1.2 我国移植肺病理学研究的简史
1979年,北京中日友好医院的辛育龄等实施了我国首例肺移植。进入21世纪后,尤其是近3年以来,随着肺移植例数的增加以及肺移植外科技术和术后管理经验的积累,目前全国可开展肺移植的中心已达44个,覆盖全国21个省市(自治区、直辖市),截止至2019年底,中国肺移植注册登记系统显示肺移植例数超过1 500例[2]。虽然我国肺移植病理学的研究开展较迟,但借助我国逐渐积累的肺移植病例,病理学家和肺移植临床学家在应用移植肺纤维支气管镜活检的基础上对移植肺活检及其病理学特征进行了研究,逐步积累了我国移植肺病理学研究的宝贵经验[3-4],其中无锡市人民医院开展了较大例数的(133例次)移植肺纤维支气管镜活检的临床病理学观察。
2 移植肺活检的主要方法及其病理学处理技术
2.1 移植肺活检的主要方法
移植肺并发症的诊断除了可以进行临床观察、肺功能检测外,其确诊主要依据移植肺活检(biopsy)。移植肺活检方法包括经支气管肺活检(transbronchial lung biopsy,TBLB)、经支气管冷冻肺活检(transbronchial cryobiopsy,TBCB)、经皮穿刺肺活检(percutaneous needle biopsy)、胸腔镜肺活检(thoracoscopic biopsy)和开放式肺活检(open lung biopsy)。在多种肺活检途径中,既往主要为TBLB,即将活检钳沿纤维支气管镜吸引管伸入支气管、细支气管并达到肺泡,活检钳取肺组织供后续组织病理学检查,这一技术使得纤维支气管镜检查的范围不再局限于气道,还可以进入肺组织,扩大了纤维支气管镜检查的范围,对肺的各种周围病变、弥漫性病变有良好的诊断价值。近年来,新的TBCB技术的应用逐渐增多,其是将冷冻探头经支气管伸入远端细小支气管,利用冷冻探头在快速冷冻过程中对支气管及肺组织的黏附性,经快速冷冻及冻融而分离获取探头周围的肺组织标本的一项新技术,非常适用于支气管镜下弥漫性肺疾病和肺外周病变的活检[5-6]。 TBLB诊断肺部病变的不足在于其方法为机械钳夹,因此不仅肺组织标本细小,而且常常因钳夹导致组织标本人为挤压而变形,不利于准确诊断,而TBCB不仅获取组织较大,较TBLB可以获得更多的小血管和终末细支气管结构等更充分的肺组织,而且肺泡等组织结构不受人为挤压而变形,更有利于准确诊断和鉴别诊断移植肺内多种复杂的并发症[7],其较TBLB更为安全、快速和有效,近年来在移植肺活检中的应用日益增多。随着TBLB、TBCB的应用日益增多和经验日益成熟,经皮穿刺肺活检或胸腔镜肺活检应用极少,在上述方法仍无法满足诊断需要的情况下,开放式肺活检可以提供其它几种活检无法提供的最为满意的肺活检组织,但其需要进行全身麻醉下的外科手术,具有风险高、费用高、易于出现气胸并发症以及延长患者住院时间等诸多弊端而一直存在争议,往往是不得已而考虑采用的活检方式。
此外,通过纤维支气管镜进行支气管肺泡灌洗(bronchoalveolar lavage,BAL)也可以用于移植肺并发症的诊断,对于移植肺的间质性炎症尤其是移植肺感染等的早期发现与诊断具有独特的优势,其方法为在进行常规纤维支气管镜观察后,经活检孔于段或亚段支气管口内注入适量生理盐水并负压抽吸回收灌注液,进行病原学和细胞学检查,协助诊断移植肺感染性疾病或通过淋巴细胞数量分析协助诊断急性排斥反应,但由于其仅仅获取细胞成分,标本内缺乏移植肺固有的组织结构,无法对移植肺慢性排斥反应等提供诊断帮助。
同时也需要关注的是,随着肺移植例数及其术后并发症管理经验的积累,借助活检及其病理学诊断及时发现和治疗各种并发症越来越有必要,这其中监视性活检(surveillance biopsy)不失为一项有效的手段,其可以借助纤维支气管镜随时观察移植肺的情况并在必要时进行活检,更重要的是其适用性非常灵活,一方面可以依据规定时间点动态监测观察移植肺的情况,类似计划性活检(protocol biopsy),也可以在必要时随时实施活检,类似指征性活检(indication biopsy),即将两者的优势结合起来,非常适合应用于移植肺并发症的监控,值得推荐采用,以更好地保障移植肺和受者的长期存活。
2.2 移植肺活检标本的病理学处理技术
ISHLT推荐在TBLB活检组织中至少应钳取5块肺实质组织,同时特别需要关注其钳取组织的质量好坏,这对于诊断具有决定性意义,取材部位不当、标本钳夹中组织变形等人为因素均可以严重干扰镜下组织病理学的诊断。TBLB活检标本应立即置于10%甲醛溶液中固定,再轻轻振荡,使组织标本与固定液充分浸泡接触,并使钳夹中部分塌陷的肺泡组织恢复膨隆后,用于后续诊断。TBCB活检探头可在荧光镜精确引导下达到深部肺组织,对活检部位进行数秒钟的快速冷冻及冻融分离获取肺组织后经气管镜将活检肺组织收回,活检组织标本在生理盐水中解冻后迅速固定于甲醛溶液中。组织标本常规脱水后进行石蜡包埋,建议多个层面切片,切片厚度3~4 μm,然后进行苏木素-伊红(hematoxylin-eosin,HE)染色、Masson三色染色和弹力纤维染色;为明确移植肺病毒感染,也必须进行巨细胞病毒(cytomegalovirus,CMV)和爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)的相应免疫组织化学(免疫组化)染色或原位杂交染色,对于疑为AMR者,ISHLT移植肺AMR工作组推荐进行C4d、C3d、CD68和CD31免疫组化染色以协助诊断。
3 肺移植术后主要并发症及其活检病理学诊断标准
无论是单肺移植、双肺移植还是心肺联合移植,均具有基本相似的病理学改变。肺移植术后移植肺可出现多种并发症,主要包括由移植肺缺血-再灌注损伤(ischemia-reperfusion injury,IRI) 等所致的原发性移植肺无功能(primary graft dysfunction,PGD)、急性与慢性排斥反应以及移植术后应用免疫抑制剂所致机体免疫力下降后出现的机会性感染或淋巴组织异常增生等。肺移植术后并发症通常依据其可能出现的时间而分类,常见的并发症归纳于表1,以下就移植肺并发症及其病理学特征,尤其是排斥反应及其活检病理学诊断标准的进展予以阐述。

表1 肺移植术后主要并发症Table 1 Major complications after lung transplantation
3.1 血管与气道吻合口并发症
血管与气道吻合口并发症常见于肺移植早期临床研究阶段、手术技术操作不成熟、移植肺显著的IRI或移植肺感染等情况下。随着肺移植经验的成熟和感染等诱发因素的良好控制,术后即期内出现该并发症已很少见。气道吻合口并发症中包括吻合口部位的气道裂开(bronchial dehiscence)和吻合口狭窄(anastomotic stricture),前者可由气道吻合口严重感染、缺血坏死等因素导致,常需立即开胸修补,随着近年来肺移植技术成熟及规范化,目前已极少发生;后者常由于气道吻合口部位的肉芽组织增生、支气管软化缩窄等引起,更为棘手的是其常常在术后远期阶段才逐渐出现临床表现,因其与移植肺慢性排斥反应所致的通气功能减退相混合而给鉴别诊断带来很多困扰。这些血管和气道吻合口并发症主要依赖临床支气管镜和CT等影像学检查,病理学不作为诊断的主要手段。
3.2 超急性排斥反应
超急性排斥反应(hyperacute rejection,HAR)是最为严重的、灾难性的移植肺排斥反应,其机制目前已明确是迅猛发生的急性AMR,即受者体内预存抗体与移植肺内的移植抗原结合后迅速激活补体级联反应导致广泛的血液循环障碍,移植肺常常在术中或术后数小时内失功。其临床表现为迅速出现功能骤然衰竭,肺动脉压力和通气压力陡然升高、动脉血氧分压迅速下降,影像学迅速出现“大白肺”。国际文献报道的8例移植肺HAR病例中7例均为女性受者,6例原发病为肺气肿,5例术前群体反应性抗体(panel reactive antibody,PRA)检测呈阴性,3例检测到术后PRA水平升高,其中6例受者即便迅速采用了血浆置换和加强免疫抑制剂治疗仍死亡[8-13]。受者死后移植肺的解剖病理学观察可见移植肺肺泡内微血栓栓塞、弥漫性淤血和肺泡腔内出血。因此,对于HAR治疗的关键在于预防,目前随着更为全面和敏感的移植术前组织配型检测的应用,HAR罕见发生。
3.3 植入反应
移植肺植入反应(implantation response)的本质为急性肺水肿。造成移植肺水肿的原因是多方面的,包括供肺获取过程中淋巴管以及神经的离断导致淋巴液回流障碍以及肺丧失神经调控机制、保存与灌注过程中压力过高以及输液量过大等所致的毛细血管内皮及肺泡上皮细胞损伤等。临床上植入反应常见于肺移植术后1~2 d内,主要表现为X线胸片上肺的弥漫性阴影,组织病理学可见肺泡间隔水肿以及中性粒细胞浸润,其常可以在术后1周内逐渐缓解。
3.4 缺血-再灌注损伤
移植肺IRI在部分文献中也称为保存性损伤(preservation/harvest injury),严重的IRI是导致临床上出现PGD的主要因素之一。PGD是ISHLT公认的急性肺损伤(acute lung injury,ALI)表现,常发生于肺移植术后72 h内,也是术后近期导致移植失败及受者死亡的常见并发症之一。除IRI以外,其它导致PGD的危险因素还包括供肺因素和受者因素两个方面。供肺因素包括高龄或低龄供者、女性供者供肺,供者有吸烟史、长期机械通气、严重颅脑损伤、脑死亡后血液循环不稳定等[14-15],其中吸烟供者可见呼吸性细支气管炎及支气管肺炎,严重颅脑损伤尤其是车祸等外伤供者的供肺内常可见包括脂肪栓子、骨髓成分栓子以及脑组织栓子在内的栓塞,肺出血以及弥漫性肺泡损伤;受者因素包括受者原发病为特发性肺动脉高压(idiopathic pulmonary arterial hypertension,IPAH)或肺肉样瘤病(sarcoidosis)等弥漫性肺实质疾病、移植术前肺动脉高压或经历了长时间的体外循环等。
IRI的机制为缺血、缺氧因素所致弥漫性肺泡上皮细胞和肺泡间隔毛细血管内皮细胞等损伤,导致肺移植术后即刻发生血氧屏障的氧交换功能障碍,迅速发生PGD。随着损伤程度的不同,IRI组织病理学改变从移植肺局部的小灶状病灶至弥漫性肺泡损伤,前者组织学上可见局部肺泡上皮细胞水肿,肺泡间隔增宽,肺泡间隔毛细血管内可见微血栓,局部肺泡上皮可坏死脱落(图1A);后者在临床上可造成肺移植术后急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),其本质为肺泡毛细血管经历较长时间缺血、缺氧等损伤所致的移植肺水肿,类似于肺透明膜病(hyaline membrane disease)。组织病理学上可见移植肺肺泡内表面覆盖一层炎性渗出的、均匀带状的透明膜样物质(图1B),过碘酸-雪夫(periodic acid-Schiff,PAS)染色和蛋白反应阳性,电子显微镜(电镜)下可见该透明膜由凝聚的膜结构碎片、核碎屑等细胞器成分组成,导致肺泡的气血交换界面功能丧失。同时,IRI不仅造成早期的PGD,该损伤诱发的修复过程将持续数周甚至数月并形成移植肺实质组织的早期纤维化。

图1 移植肺IRI的病理学表现Figure 1 Pathological findings of IRI in lung allograft
3.5 排斥反应
移植肺的排斥反应总体上根据其组织病理学表现的不同即是否表现为急性免疫损伤性炎症或慢性增生性炎症,区分为急性排斥反应和慢性排斥反应。其中,对于急性排斥反应既往仅仅关注急性T细胞介导的排斥反应(acute T cell-mediated rejection,aTCMR)或称为ACR,因此最初的1990年ISHLT标准、1996年ISHLT标准,直至2007年ISHLT标准中均只有ACR和以ACR损伤机制所致的慢性排斥反应类别。随着AMR免疫损伤机制及其病理学特征在移植肾和移植心脏活检中逐渐得以明确,在借鉴移植肾和移植心脏AMR的病理学诊断原则的基础上,虽然移植肺AMR的病理学特征及其诊断方法已经过多中心的协作研究初步予以明确,但在2007年ISHLT标准中仍未将其纳入诊断分类中,希望后续更新的ISHLT标准中可以予以公布。
虽然移植肺急性排斥反应或慢性排斥反应较常出现于相应的术后时间段内,譬如急性排斥反应多见于肺移植术后近期尤其是术后3个月至1年内,慢性排斥反应多出现于肺移植术后1年后,但时间不能作为诊断的依据。急性排斥反应临床上常表现为发热、咳嗽、呼吸困难、乏力、胸腔积液和肺部啰音;胸部CT显示自肺门部向外扩展的浸润性阴影,动脉血氧分压明显降低,气管分泌物细菌学检查阴性,放射性核素肺灌注扫描显示移植肺内灌注减少;肺功能检测中肺总量(total lung capacity,TLC)、用力肺活量(forced vital capacity,FVC)、最大呼气流量-容积曲线(maximal expiratory flow-volume curve,MEFV)、通气/血流比(ventilation/perfusion,V/Q)以及25%和75% FVC时的平均用力呼气流量(mean forced expiratory flow between 25% and 75% of FVC,FEF25%~75%)等指标明显下降,但这些临床检测指标的灵敏度和特异度均不高,必须在这些相应肺功能检查的基础上,及时进行移植肺TBLB或TBCB予以明确诊断。
3.5.1 移植肺急性细胞性排斥反应 移植肺ACR是肺移植术后3~6个月内常见的并发症,有报道其在肺移植术后的发生率为30%~40%。虽然多数ACR见于肺移植术后近期,但有部分ACR可以发生于肺移植术后任何时间,尤其是长期存活受者免疫抑制剂贸然减量或停用以后。移植肺ACR的组织病理学改变包括支气管病变和血管病变两个方面。
3.5.1.1 移植肺急性细胞性排斥反应的支气管病变 移植肺TBLB或TBCB中可见的ACR的支气管病变主要体现在细末支气管,包括终末细支气管和呼吸性细支气管。最早的病变可见细支气管周围单个核细胞浸润,随着ACR程度的加重,浸润的炎症细胞不仅围绕在细支气管周围,也可扩展浸润进入细支气管黏膜上皮层内,形成支气管上皮的淋巴细胞浸润。起初黏膜上皮还保持完整, 严重者黏膜上皮坏死脱落,严重排斥反应时可见上皮层内大量淋巴细胞甚至混合中性粒细胞浸润以及黏膜溃疡形成。
3.5.1.2 移植肺急性细胞性排斥反应的血管病变 移植肺ACR的血管变化可累及动脉、静脉分支以及毛细血管。最早期的变化为小血管周围少数单个核细胞围管状浸润,被浸润的小血管可以是小动脉或小静脉,浸润的单个核细胞呈2~3层围绕在血管周围,浸润的单个核细胞主要是成熟的小淋巴细胞。随着排斥反应程度逐渐加重,血管周围浸润的炎症细胞数量明显增加,并且可见活化的淋巴细胞以及巨噬细胞和浆细胞;同时血管内膜也可见淋巴细胞浸润甚至内膜水肿,形成血管内膜炎改变。进一步发展,血管外周浸润的炎症细胞向周围肺实质以及组织间质内扩展,肺泡间隔增宽,肺泡间隔内除有淋巴细胞浸润外,也可见少数嗜酸性粒细胞和中性粒细胞浸润,严重的排斥反应时肺泡间隔内出血、多数肺泡坏死及肺泡表面透明膜形成。由于强效免疫抑制剂的应用,严重的ACR已不多见,少数情况下见于因感染或移植后淋巴组织异常增生等并发症而不得不减量或停用免疫抑制剂的受者。
移植肺ACR时的支气管病变或血管病变虽然可单独出现,但在实际的病例中两者常同时出现,说明其本质为ACR损伤的两个不同方面。
3.5.1.3 移植肺急性细胞性排斥反应的诊断标准及其分级 在排斥反应的病理学特征逐渐明了和各肺移植中心逐渐开展活检以后,ISHLT希望对排斥反应活检病理学诊断制定统一的诊断标准,其目的在于制定一个简单、易于应用、结合各中心诊断标准的优点并能为各中心所接受的诊断体系。1990年在ISHLT的主持下由其肺移植排斥反应研究小组(Lung Rejection Study Group,LRSG)提出了肺移植排斥反应诊断标准及其排斥反应分级体系即1990年ISHLT标准,该标准中ACR的诊断是基于细支气管炎症和血管炎症;借此,慢性排斥反应也是基于细支气管和血管的慢性病变两个方面,即闭塞性细支气管炎(obliterative bronchiolitis,OB)和移植相关血管病(transplantassociated vasculopathy,TAV)。该标准历经1996年和2007年的更新,虽然近年来急性AMR的病理学诊断受到密切关注,但仍有待于在后续更新的标准中予以体现,在此结合2007年ISHLT标准(表2)对ACR的组织病理学特征予以阐述。
表2 移植肺排斥反应诊断标准及其分级(2007年ISHLT标准)Table 2 Diagnostic criteria and classification of rejection of lung allograft (2007 ISHLT working formulation)
3.5.1.3.1 急性细胞性排斥反应(A级) A0级-无急性排斥反应:A0级表示移植肺活检组织结构正常,无血管周围炎症细胞浸润,无出血及坏死等任何急性排斥反应的组织病理学表现。
A1级-轻微急性排斥反应:A1级即轻微急性排斥反应(minimal acute rejection),特征为低倍镜下肺组织内的个别细微小动脉或小静脉周围少许的单个核细胞围管状浸润。血管周围浸润的炎症细胞在血管外膜周围由小淋巴细胞以及少许活化的淋巴细胞形成2~3层的浸润。
A2级-轻度急性排斥反应:A2级即轻度急性排斥反应(mild acute rejection),特征为在低倍镜下可见多个小动脉或小静脉周围围管状的、单个核细胞浸润,浸润的炎症细胞中包含有小淋巴细胞、活化的淋巴细胞、浆细胞、巨噬细胞和嗜酸性粒细胞。浸润的炎症细胞不仅围绕在血管外膜周围,也可见血管内膜有炎症细胞浸润并导致内皮细胞水肿或空泡变,即形成血管内皮炎(endothelialitis),但浸润的炎症细胞仅局限于血管周围,而没有波及邻近的肺组织(图2)。这一级别的急性排斥反应中不常伴有淋巴细胞性支气管炎。轻度急性排斥反应与轻微急性排斥反应的形态学区别为,轻度者在用低倍镜扫视肺组织时可见明显的围管状炎症细胞浸润;此外在轻度排斥反应时,常可见有血管内皮下的炎症浸润即内皮炎以及同时存在的气管炎性损伤。对于单个的血管,如果周围有明显的炎症浸润,应高度怀疑急性排斥反应。
图2 移植肺A2级ACR的病理学表现Figure 2 Pathological findings of A2 grade ACR in lung allograft
A3级-中度急性排斥反应:A3级即中度急性排斥反应(moderate acute rejection),特征为小动脉或小静脉血管周围有密集的单个核细胞浸润而形成明显的炎症浸润的“袖套”,常合并有血管内皮炎。血管周围浸润的炎症细胞中混合有嗜酸性粒细胞和中性粒细胞。这一级别中浸润的炎症细胞不仅围绕在血管周围,而且也扩散进入邻近的支气管周围、肺泡间隔以及气管管腔内。
A4级-重度急性排斥反应:A4级即重度急性排斥反应(severe acute rejection),特征为移植肺活检组织内血管周围、肺泡间隔、气管周围及管腔内有弥漫性单个核炎症细胞浸润;同时肺活检组织可见梗死和血管管壁的纤维素样坏死。肺泡上皮细胞明显损伤并可见肺泡腔内有坏死脱落的肺泡上皮细胞、巨噬细胞、中性粒细胞、透明膜甚至出血。
3.5.1.3.2 淋巴细胞性支气管炎(B级) 淋巴细胞性支气管炎(lymphocytic bronchitis)表现为肺活检组织内的末梢细支气管周围甚至黏膜上皮内不同程度的炎症细胞浸润。
BX级-因肺活检标本偏少、标本人为挤压变形或切片级染色不佳而不适宜诊断分级。
B0级-末梢支气管周围或黏膜上皮内无单个核炎症细胞浸润等炎症改变。
B1R级-低级别的支气管炎症:末梢支气管周围出现了从少数到数量密集的、不同程度的单个核炎症细胞浸润的围管状浸润,支气管黏膜层内亦可见炎症细胞浸润(图3)。

图3 移植肺B1R级淋巴细胞性支气管炎的病理学表现Figure 3 Pathological findings of B1R grade lymphocytic bronchitis in lung allograft
B2R-高级别的支气管炎症:末梢支气管周围密集的炎症细胞浸润并有支气管黏膜上皮细胞坏死脱落形成溃疡,在支气管管腔内有明显的炎症渗出物,其中混杂有坏死的上皮细胞以及较多渗出的单个核炎症细胞和中性粒细胞。
3.5.2 移植肺抗体介导的排斥反应
3.5.2.1 移植肺抗体介导的排斥反应病理学诊断标准及其主要进展 虽然在移植肺活检的1990年、1996年和2007年ISHLT标准中均未能体现AMR的内容,但随着对移植肾和移植心脏等移植器官AMR病变的认识及其诊断方法的明确,移植肺AMR的认识也逐渐得以明确。目前已明确移植肺同样存在AMR,其也是导致移植肺慢性失功(chronic lung allograft dysfunction,CLAD)的主要因素之一。
近年来,在ISHLT的组织下对急性AMR进行了多中心的协作研究和持续的研讨,包括2012年和2016年,其移植肺病理学委员会专门针对急性AMR进行了详细的讨论并提出了相应的共识,其中就急性AMR的综合诊断方法、特征性病变类型及其命名、移植肺活检标本的C4d染色方法及其阳性结果的判定标准等提出了推荐意见[16-17]。进而在2017年第15届Banff移植病理学会议中由肺移植工作组进一步针对移植肺急性AMR的诊断类别、病理学特征和未来的研究方向进行了讨论和总结。这些临床研究和2012年、2016年的ISHLT研讨会以及2017年Banff移植病理学会议研讨会共识及其进展包括:(1)由于目前移植肺急性AMR的诊断方法和诊断标准仍有待明确,其准确的发生率仍未明了。(2)移植肺急性AMR的诊断仍然需要遵循综合诊断的原则,即包括移植肺功能减退、移植肺活检相应的病理学表现、C4d免疫组化染色阳性和供者特异性抗体(donor specific antibody,DSA)检测阳性。(3)结合移植肺的综合诊断,推荐将移植肺急性AMR的病理学诊断分为3个类型,即确定的急性AMR(definite acute AMR)、很可能的急性AMR(probable acute AMR)和有可能的急性AMR(possible acute AMR)。其中“确定的急性AMR”定义为全部具备了移植肺功能减退、DSA阳性、活检组织中具备AMR的组织病理学表现和C4d的免疫荧光或免疫组化染色呈阳性4项指标;“很可能的急性AMR”,即具备4项指标中的3项;“有可能的急性AMR”为仅具备4项指标中的2项。其中对于出现了移植肺功能减退者,则为临床的急性AMR,而暂时缺乏临床移植肺功能减退者,则提示可能是亚临床的急性AMR,其后续的监视性活检(surveillance biopsy)和肺功能检测则尤为重要。(4)移植肺急性AMR的组织病理学特征为移植肺急性毛细血管损伤(acute capillary injury,ACI)或称为急性毛细血管炎(acute capillaritis)和动脉炎(arteritis)。(5)对于C4d染色,建议选择移植肺活检组织石蜡切片进行C4d免疫酶组化染色,其阳性结果的判定标准为>50%的活检肺泡间隔毛细血管内皮出现线样的阳性沉积则为阳性,否则为阴性,移植肺组织内间质纤维组织、动脉和静脉小血管、小支气管管壁的阳性仅作为染色方法的阳性参照,不能作为急性AMR的C4d阳性判定的部位;对于经活检病理学观察,提示移植肺可能存在急性AMR者,建议进行包括C3d、C4d、CD68和CD31在内的免疫组化染色,以协助诊断。(6)虽然目前可以在移植肺的TBLB或TBCB中对其急性AMR予以观察和诊断,但仍需要更大例数的临床病理学研究证据,因此在目前采用的2007年ISHLT标准中仍未将其纳入作为一个诊断类别,相信不久的将来在新的ISHLT标准中会将AMR这一诊断类别、活检病理学诊断标准和程度分级予以更新发布。
3.5.2.2 移植肺急性抗体介导的排斥反应病理学的基本特征 移植肺急性AMR的组织病理学改变以ACI病变为主,同时对于确定的急性AMR也可出现动脉炎。但也需要注意的是其并非绝对具有特异性,急性抗体介导性的免疫损伤不仅可以表现为持续的、反复发生的ACR和淋巴细胞性支气管炎,而且也可以隐匿进展并首先表现为以OB为特征的慢性排斥反应[18]。因此在临床出现移植肺功能减退时及时进行活检诊断和DSA的检测,并与其他并发症进行鉴别是AMR诊治的关键。
ACI病变是以血管内皮尤其是毛细血管内皮为主要靶部位的免疫损伤[19],其特征性表现包括肺泡间隔毛细血管的急性毛细血管炎(acute capillaritis)和移植肺组织内的动脉炎(arteritis)。其中急性毛细血管炎依据其炎症损伤的程度不同而具有不同的多种表现,包括肺泡间隔毛细血管内的中性粒细胞着边(neutrophil margination)和中性粒细胞性毛细血管炎(neutrophil capillaritis),前者仅表现为肺泡间隔毛细血管内出现淋巴细胞和中性粒细胞淤积,其中可见中性粒细胞贴附毛细血管内皮呈着边的表现,但没有毛细血管内微血栓形成,肺泡内出血坏死改变;后者则炎症细胞淤积浸润的程度明显加重,肺泡间隔毛细血管内亦可见微血栓栓塞、肺间质出血及肺泡腔内漏出性出血和肺泡腔内淋巴细胞和中性粒细胞脱落。移植肺活检组织的动脉炎常见于细微动脉分支,呈细微动脉内膜淋巴细胞浸润及内膜水肿,严重者甚至出现细微动脉管壁纤维素样坏死。对于经活检观察高度提示急性AMR者,ISHLT推荐必须进行活检肺组织的C4d免疫酶组化染色和DSA检测[20-21]。C4d阳性表现为>50%的或者弥漫性的肺泡间隔毛细血管内皮呈细线样阳性沉积。
3.5.3 移植肺慢性排斥反应 移植肺慢性排斥反应的病理学表现与急性ACR类似,病理组织学变化包括支气管和血管两个方面,分别形成OB和TAV。
3.5.3.1 移植肺慢性排斥反应的支气管病变 移植肺慢性排斥反应的支气管病变形成特有的OB,是包括反复发生的、持续的ACR和急性AMR所致的移植肺慢性损伤,是肺移植以及心肺联合移植中移植肺长期存活过程中的主要并发症。OB本身是一个非特异性的病理组织学改变,在临床上造成移植肺闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)。移植肺OB的发生率为10%~45%,在单肺移植、双肺移植以及心肺联合移植受者中均可发生,是阻碍移植肺及受者长期存活的主要障碍。
移植肺OB的本质是综合性损伤因素共同参与所致的肺部病理学变化,其中移植肺反复、多次急性排斥反应的特异性免疫损伤为主要因素。其次,免疫损伤后合并的感染、肺神经与淋巴管离断、支气管缺血损伤、药物毒性、支气管黏膜纤毛廓清功能受损、下呼吸道防御机能的破坏等多种非免疫因素也发挥重要的协同作用。移植术后早期的、严重的、控制不良的急性排斥反应(包括ACR和AMR)是导致OB的关键因素,OB多继发于严重的、多次的ACR或AMR,对这些急性排斥反应的诊断可作为OB的预警因素。
OB的临床表现为反复咳嗽、咳痰、活动后呼吸困难,进一步进展出现严重的小气道受阻症状,合并反复肺部感染、血氧水平逐步降低,肺功能检测呈明显的渐进性阻塞性呼吸功能不全。OB难以自行缓解,部分病例在早期通过加大糖皮质激素类药物剂量可暂时稳定病情,减缓或推迟病变进程,但无法逆转病情。
OB的病理学特征为急性排斥反应的持续损伤导致移植肺内细小气管如终末细支气管和(或)呼吸性细支气管黏膜上皮反复损伤,早期可见细支气管周围有明显的炎症细胞浸润,此时,除小淋巴细胞外,可见较多活化的大淋巴细胞甚至中性粒细胞浸润;由于细支气管上皮损伤可见上皮坏死甚至脱落形成局部溃疡,黏膜下组织暴露,黏膜肌层断裂;细小支气管黏膜上皮经历反复损伤与修复增生,细支气管周围黏膜下组织可完全被增生的肉芽组织所取代,肉芽组织及瘢痕组织逐渐突入细支气管管腔内甚至在管腔内扩展,导致管腔部分或全部阻塞(图4),形成临床上的移植肺慢性阻塞性疾病即BOS[22]。
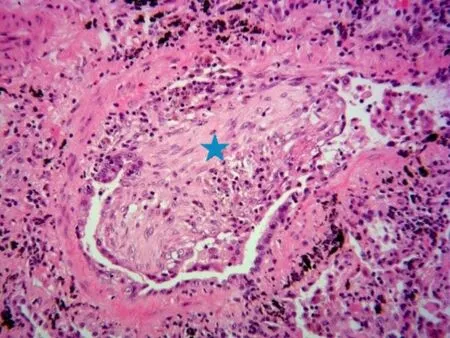
图4 移植肺慢性排斥反应的OB的病理学表现Figure 4 Pathological findings of OB of chronic rejection in lung allograft
3.5.3.2 移植肺慢性排斥反应的血管病变 移植肺慢性排斥反应的血管病变即TAV在移植肺内的动脉与静脉均可出现,以动脉病变更为显著。其组织病理学特征为在动脉或静脉横断面可见内膜明显增生及内膜向心性增厚(图5),导致管腔狭窄甚至完全闭锁。增生内膜内主要为内皮细胞、成纤维细胞、平滑肌细胞以及吞噬脂质的巨噬细胞形成的泡沫细胞(foamy cell),同时也可合并明显的炎症细胞浸润,浸润的炎症细胞以单个核细胞为主,包括淋巴细胞、浆细胞以及巨噬细胞,表明免疫性损伤机制仍持续存在。就临床意义而言,移植肺的气管病变即OB及其所致的临床BOS更为重要,其更早出现且更快导致CLAD。
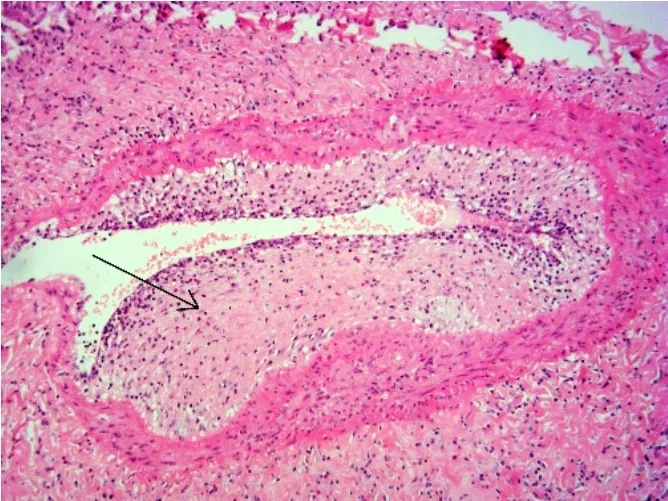
图5 移植肺慢性排斥反应的TAV的病理学表现Figure 5 Pathological findings of TAV of chronic rejection in lung allograft
3.5.3.3 移植肺慢性排斥反应诊断标准及其分级 2007年ISHLT标准对移植肺慢性排斥反应的两种病变即OB和TAV予以了分级。其中对于OB的分级,由于在单独一次移植肺活检中可观察的组织非常局限,判定移植肺OB的阻塞程度非常困难,因此在2007年ISHLT标准中OB的分级即C级病变简单而明确地区分为“有”或“无” OB即可,其中C0级为移植肺活检组织内无OB改变,C1级为有OB改变;同样的,TAV的分级即D级也仅依据是否有相应病变而分为D0级即无TAV病变,D1级即有TAV病变。
3.5.3.4 移植肺其它的慢性病变 移植肺慢性病变还包括限制性移植物综合征(restrictive allograft syndrome,RAS)、急性纤维素性机化性肺炎(acute fibrinoid organizing pneumonia,AFOP) 和阿 霉素反应性移植肺功能障碍(azithromycin responsive allograft dysfunction,ARAD)或称中性粒细胞性可逆性移植肺功能障碍(neutrophilic reversible allograft dysfunction,NRAD)[23-28]。目前这些慢性病变的致病原因及其致病机制仍未完全明确,其中排斥反应因素与包括IRI和感染等在内的非免疫因素均是导致这些慢性病变的原因。
在移植肺活检病理学上,RAS主要表现为胸膜纤维化和胸膜下纤维化,其特征为病变纤维化肺组织与相邻正常肺组织之间的交界非常清晰,两者泾渭分明。同时,大多数RAS中同时伴有OB。RAS的预后明显差于OB,且再次肺移植的预后也较差。ARAD或NRAD的主要表现为移植肺的肺泡灌洗液内中性粒细胞数量显著增多,其组织病理学上也类似OB改变,其机制初步推测与中性粒细胞产生释放的大量氧化应激因子、趋化因子和生长因子等有关,具有抗菌和抗炎效应的阿奇霉素对其治疗有效,因此也有研究者推荐在部分OB病例的治疗中尝试应用阿奇霉素。
3.6 感 染
由于长期免疫抑制剂的应用,且移植肺是开放性器官,肺移植术后移植肺感染是威胁受者长期存活和导致术后死亡的主要原因,尤其是大剂量的糖皮质激素冲击治疗以及移植肺出现OB后,移植肺感染的发生率更高。造成移植肺感染的病原体包括各种常见的致病菌以及在正常情况下不多见的条件致病菌,其中约50%为细菌感染,其次为病毒以及原虫感染,在病毒感染的基础上也极易合并细菌感染。
对于移植肺感染的诊断,目前主要包括移植肺活检组织学诊断、肺泡灌洗液的细胞学诊断、病原体培养以及二代测序(next generation sequencing,NGS)等分子生物学诊断几种方法,其中TBLB或TBCB对于排斥反应与感染有良好的鉴别诊断作用[29-32]。
3.6.1 巨细胞病毒感染 CMV感染是移植肺内主要的机会性感染,其感染的来源包括CMV阴性的受者接受了CMV阳性的供者器官、受者接受了被感染的血液及血液制品、移植受者本身有CMV的隐性感染,应用免疫抑制剂特别是抗胸腺细胞球蛋白更易引起病毒活化。
通过移植肺的支气管肺活检可对CMV感染以及CMV肺炎的诊断提供组织学依据。移植肺CMV肺炎的特征性表现为形成移植肺的病毒性肺泡炎(viral alveolitis),可见肺泡上皮细胞增生,严重的病例可见肺泡上皮细胞坏死、肺泡内透明膜形成。肺组织间质内有混合性炎症细胞浸润,常常包括大量的中性粒细胞、淋巴细胞和巨噬细胞,大量浸润的中性粒细胞常形成多处小脓肿。肺泡腔内也常含有大量的中性粒细胞、巨噬细胞、渗出的纤维素、漏出性出血的红细胞以及坏死组织,而最终的确诊需在活检组织内找到CMV病毒包涵体(viral inclusion),其主要见于支气管或细支气管黏膜上皮细胞、肺泡上皮细胞以及血管内皮细胞。CMV包涵体主要见于细胞核内,因形态类似于鹰眼而称为“鹰眼样细胞”,同时建议行CMV免疫组化或原位杂交染色提高诊断的准确性。
3.6.2 单纯疱疹病毒感染 单纯疱疹病毒(herpes simplex virus,HSV)感染的发生率较CMV感染低。在移植肺内HSV所造成的特征性病变为坏死,主要为气管、支气管以及细支气管黏膜的坏死并形成溃疡缺损。感染的细胞主要为支气管黏膜上皮细胞、化生的鳞状上皮细胞和肺泡上皮细胞,因此易于形成坏死性支气管肺炎,并有大量的中性粒细胞浸润以及崩解形成的脓细胞,可以借助这一点与CMV感染所造成的肺部病变相区别。在移植肺活检组织内可检见病毒包涵体,但较CMV包涵体的发现更为困难,细胞内包涵体可有2种形态表现,其一为受感染细胞的胞核呈嗜酸性毛玻璃样,其周围有一薄层深染的核染色质;其二为感染细胞的胞核形成嗜酸性固缩的中心体,并且在其周围形成透亮的空晕。HSV一般不形成受感染细胞的胞浆内包涵体以及巨细胞。免疫组化染色也非常有助于明确HSV感染的诊断。在因感染而死亡的受者尸检组织中由于病毒的自溶而一般难以检见病毒包涵体。
3.6.3 真菌感染 真菌是引起肺部感染的重要病原体之一,肺移植受者真菌感染可以通过外源性真菌的直接感染、体内其它部位真菌感染经血行或淋巴系统播散至移植肺等途径所致。尤其是移植肺是开放性器官,在大量应用免疫抑制剂后,更增加了真菌感染的可能。肺真菌病在肺内的组织病理学改变无特异性,其诊断方法有直接涂片、培养、血清学检查以及组织病理学检查等,而在病变肺组织的病理学检查中找到真菌是最确定的诊断手段(图6)。3.6.4 卡氏肺孢子虫感染 肺移植术后随着免疫抑制剂的应用,移植肺对卡氏肺孢子虫(pneumocystis carinii)有很高的易感性。移植肺内卡氏肺孢子虫所致的病变主要为肉芽肿性炎症反应,表现为肺泡内有泡沫样炎症渗出物,在此基础上,肺泡内有明显的多核巨细胞、类上皮细胞形成的肉芽肿,肺泡上皮细胞亦明显增生。应用甲胺银染色(methenamine silver stain),可见卡氏肺孢子虫病原体包裹于肉芽肿的中心。此外,肺组织可见间质性肺炎表现,血管周围也可见炎症细胞浸润,其中有大量的浆细胞。如果在移植肺支气管肺活检组织内发现有明显的以浆细胞浸润为主的间质性炎症并有肺泡内肉芽肿形成,应进行甲胺银染色以确定诊断。同时,ISHLT移植肺排斥反应诊断分级标准中亦要求对所有活检组织进行甲胺银染色,在排除感染的前提下才能建立排斥反应的诊断。
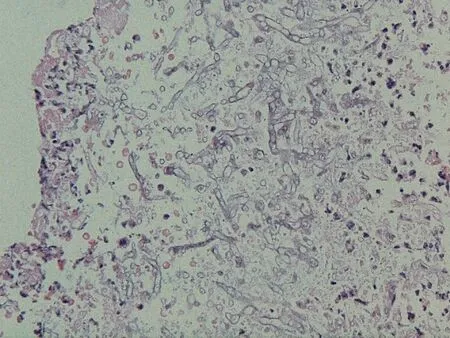
图6 移植肺毛霉菌感染的病理学表现Figure 6 Pathological findings of mucor infection in lung allograft
3.6.5 弓形虫感染 肺移植后弓形虫(toxoplasmosis)感染可以是原发性感染,也可以是再发性感染。在肺移植中往往难以在移植肺活检组织中发现弓形虫,其临床诊断可以借助血清学检查。
3.6.6 EBV感染 肺移植后EBV感染的后果在于其有可能增加移植后淋巴组织异常增生的发生率,而移植肺的EBV感染又非常难以与急性排斥反应相鉴别。
3.7 移植后淋巴组织异常增生
肺移植或心肺联合移植术后由于强效免疫抑制剂的应用以及合并EBV感染导致以B淋巴细胞为主的淋巴组织异常增生,引起移植后淋巴组织增生性疾病(posttransplant lymphoproliferative disorder,PTLD)。有报道,较其它器官移植,肺移植以及心肺联合移植中PTLD的发生率更高,为3.8%~7.0%,而且大部分发生于移植肺本身,占肺移植受者PTLD的60%以上。导致肺移植受者中PTLD发生率较高的原因可能包括:(1)移植肺组织内特定细胞是EBV天然的寄居部位,如移植肺内正常存在的大量呼吸道相关淋巴组织(bronchus-associated lymphoid tissue,BALT)中含有许多B淋巴细胞;(2)肺移植后较之其它器官移植更为强劲的免疫抑制治疗强烈地抑制了T淋巴细胞群的增生与分化,使得B淋巴细胞更容易出现异常增生。
在肺移植受者中如果移植肺的X线胸片、CT等影像学检查可见明显的结节状病变灶,应高度怀疑PTLD可能,其影像学上多呈大小不一的多结节性肿块,可以进行TBLB或TBCB, 必要时开放式活检予以诊断。解剖学标本可见肿块常位于肺实质内,与周围肺组织缺乏明显的界限。肿瘤组织可沿血管分支以及淋巴管分支浸润入肺小叶间隔组织内。组织学类型包括多形性以及单形性PTLD两种类型。
3.8 原发病复发
多数肺移植受者的原发病为肺气肿、各种原因所致肺纤维化以及肺动脉高压等,绝大多数情况下原发病极少在移植肺复发。有部分肺移植是为了治疗全身系统性疾病所致的肺功能的衰竭,如囊性纤维化(cystic fibrosis)、结节病(sarcoidosis)、淋巴管平滑肌瘤(lymphangiomuomatosis,LAM),其中可见少数结节病以及LAM肺移植术后复发的文献报道。
4 小 结
肺移植术后不同的时间段,移植肺会发生多种不同类型的并发症,主要包括PGD、急性和慢性排斥反应、移植后的机会性感染或移植后淋巴组织异常增生等。其明确诊断为在移植肺功能检查的基础上,及时采取以纤维支气管镜活检或纤维支气管镜冷冻活检为主的活检,并依据2007年ISHLT移植肺排斥反应诊断标准和针对AMR参考2017年的诊断共识予以诊断,以更好地指导临床对上述并发症采取针对性的治疗方案,更好地保障移植肺和受者的长期存活。

