儿童肝移植治疗Alagille 综合征的单中心经验
檀玉乐 朱志军 孙丽莹 魏林 曲伟 曾志贵 张海明 刘颖 王君 李宏宇
Alagille综合征(Alagille syndrome,ALGS)是一种常染色体显性遗传病,由JAG1或NOTCH2基因突变引起,病变可累及肝脏、心脏、骨骼、眼睛、颜面及肾脏等多个器官[1-3]。ALGS在活产婴儿中的发病率为1/50 000~1/30 000[4-5],肝病是该人群发病的主要原因,而心脏和血管受累是死亡的主要原因[6],超过20%的ALGS患者会发展为肝硬化[7], 21%~31%的ALGS患者需要进行肝移植[8]。多达70%的患者在儿童时期需要进行肝移植[9]。ALGS患者肝移植适应证为导致生活质量差的难治性瘙痒、终末期肝病、门静脉高压症[10]。肝移植可能导致伴有心血管畸形的ALGS患儿出现异常。目前尚未见治疗伴有心血管畸形的ALGS患儿肝移植临床经验报道。本研究回顾了在首都医科大学附属北京友谊医院肝移植中心接受肝移植的ALGS患儿的临床资料,旨在探讨儿童肝移植治疗ALGS的安全性和疗效。
1 资料与方法
1.1 一般资料
回顾性分析2016年1月至2020年5月在首都医科大学附属北京友谊医院肝移植中心接受肝移植治疗的12例ALGS患儿的临床资料,其中男8例,女4例,月龄16.5(12.5,63.0)个月。12例ALGS患儿行肝移植手术治疗的原因分别为难治性瘙痒伴生活质量差4例,肝硬化失代偿或终末期肝病8例。
1.2 ALGS的诊断和移植前评估
ALGS的诊断依据为JAG1或NOTCH2基因突变、ALGS家族史或临床体征[11-12]。临床诊断标准包括肝脏组织学[胆管缺乏和(或)胆汁淤积],心脏、肾脏、眼部或骨骼受累,血管异常,以及面部特征(如前额宽阔、眼窝深陷、耳廓突出、眼距增宽、尖下巴,整张脸犹如一个三角形,呈“V”字形)的存在[12]。
所有患儿术前均进行超声心动图检查、腹部CT检查,使用Schwartz方程计算估算肾小球滤过率(estimated glomerular filtration rate,eGFR)。
1.3 免疫抑制方案
肝移植术后根据受者年龄、病情等给予他克莫司+吗替麦考酚酯+糖皮质激素或他克莫司+糖皮质激素免疫抑制方案进行治疗。术中一次性静脉应用甲泼尼龙10 mg/kg,术后1 d按5 mg/kg分4次静脉给予甲泼尼龙,7 d内逐渐减量至每日口服8 mg,此后缓慢减量,术后3个月至半年左右停用;术后36 h加用他克莫司,术后3个月内他克莫司血药谷浓度维持在8~10 ng/mL,术后3个月至半年内维持在6~8 ng/mL;吗替麦考酚酯初始剂量为250 mg,每12 h口服1次,术后1年根据病情停用。
1.4 研究内容
收集并分析ALGS患儿的临床资料,其中一般资料包括月龄,性别,术前身高和体质量Z评分,ALGS特异性临床特征(包括典型面容、心脏或血管异常、眼睛异常、椎体异常等),原发病情况,发病时的首发症状及出现时间;手术资料包括是否行葛西手术、儿童终末期肝病模型(pediatric end-stage liver disease,PELD)评分、肝移植类型、移植物质量、术后并发症和随访情况等。随访时间截止至2021年6月。
身高和体质量Z评分通过使用WHOAnthro软件根据新的世界卫生组织的正常人口生长图表计算。Z评分<-2分表示身高或体质量不足,Z评分≥0分为追赶性生长,Z评分<-3分表示严重营养不良和严重发育迟缓。
2 结 果
2.1 ALGS患儿的临床特征和病肝组织病理学特点
12例ALGS患儿的临床特征见表1。所有患儿均存在JAG1基因突变和典型面部特征,在肝移植术前均明确诊断为ALGS。黄疸是最常见的首发症状,在出生后7(3,40)d出现。患儿行肝移植时身高和体质量Z评分分别为-2.14(-3.11,-1.83)分和-2.32(-3.12,-1.12)分,5例患儿严重发育迟缓,4例患儿严重营养不良。12例患儿中8例伴有心血管异常,其中肺动脉狭窄4例、动脉导管未闭4例、室间隔缺损2例、卵圆孔未闭3例、主动脉瓣狭窄和主动脉瓣二叶瓣畸形1例、三尖瓣轻度反流1例。
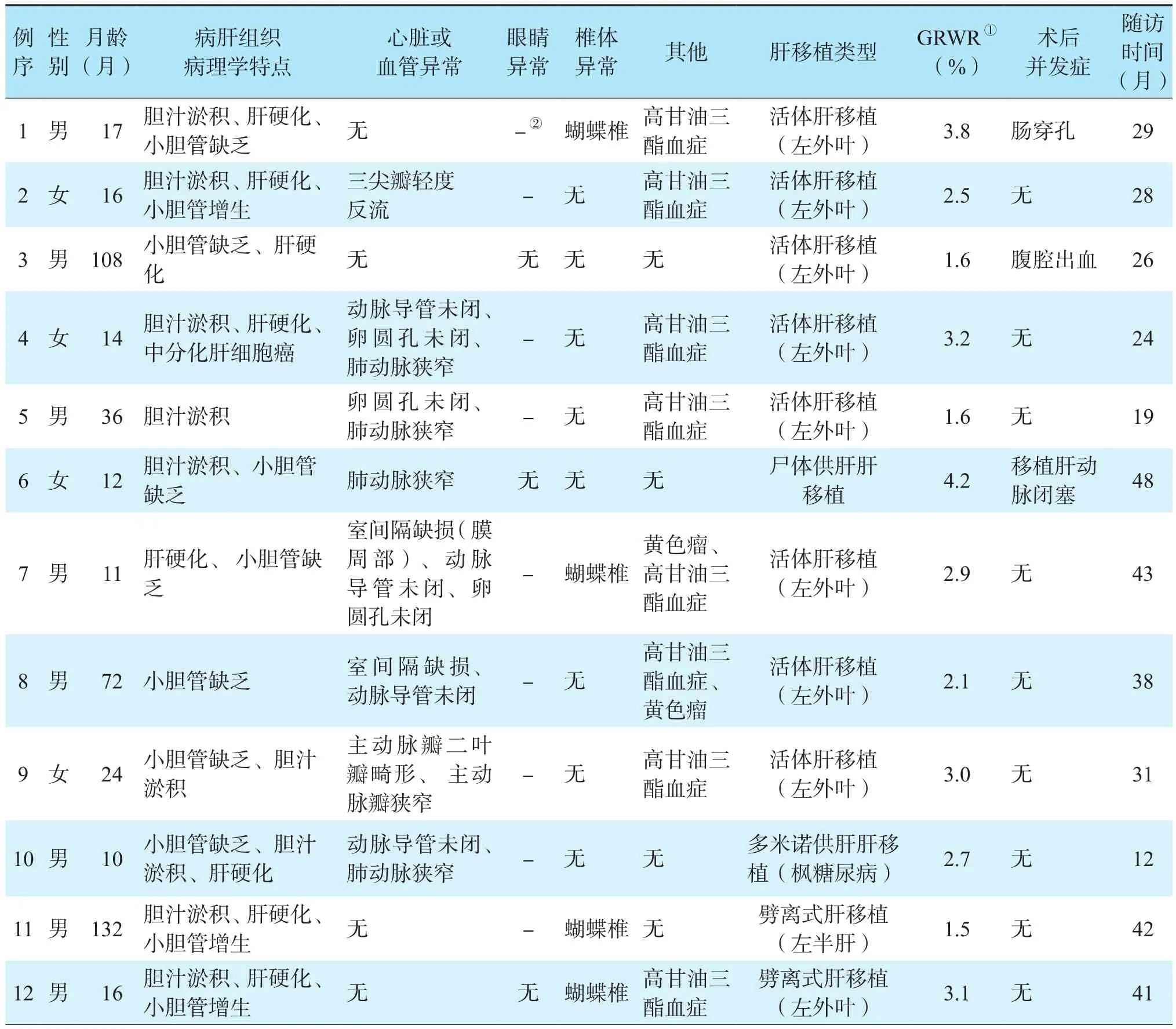
表1 12例ALGS患儿的临床资料Table 1 Clinical data of 12 children with ALGS
病理学检查结果显示,4例患儿病肝的小叶结构基本保持,8例存在大小不等结节性肝硬化。小胆管增生3例,汇管区小胆管消失7例。1例(例4)肝硬化患儿的病肝检测到单个早期中分化肝细胞癌(表1)。
2.2 ALGS患儿肝移植的特点
12例ALGS患儿的PELD评分为15.5(12.0,19.0)分。eGFR 为 206(186,217) mL/(min·1.73 m2), 处于正常范围内。8例伴有心血管异常的患儿中,例10患儿因动脉导管未闭,于肝移植术前10 d行动脉导管结扎术,其余7例未做特殊处理。例1、例2和例12患儿因误诊为胆道闭锁而行葛西手术治疗。8例患儿行活体肝移植,3例患儿行尸体供肝肝移植(包括2例劈离式肝移植和1例尸体全肝移植),1例患儿行多米诺肝移植(供肝来自于枫糖尿病患者)(表1)。1例多米诺肝移植和2例劈离式肝移植均由于供肝肝静脉过短,术中行肝静脉重建成型术,所有患儿均有合适的受者肝动脉进行动脉吻合术。所有患儿胆道重建均采用肝空肠Roux-en-Y吻合术。
2.3 ALGS患儿肝移植术后并发症和随访情况
ALGS患儿肝移植术后住院时间为18(12,30)d。例1患儿在肝移植术后15 d出现肠穿孔,需再次行剖腹探查+小肠部分切除+吻合术。例3患儿在肝移植术后6 d出现腹腔出血,再次行开腹手术。例6患儿肝移植术后8 d出现移植肝动脉闭塞,肝功能监测结果显示肝功能持续好转,未进一步处理。
所有儿童均定期随访,随访时间为 30.0(24.5,41.7)个月,患儿和移植物存活率均为100%。所有患儿移植肝功能良好。在随访过程中,患儿身高和体质量Z评分分别为-1.24(-2.11,0.60)分和-0.83(-1.65,-0.43)分,表明患儿术后生长和发育情况明显改善。
3 讨 论
ALGS是一种累及多器官的疾病,对患者短期和长期预后均有影响,需要在肝移植术前仔细评估。研究发现,即使同一家族的ALGS患儿病变累及全身程度也可能不同,容易导致误诊[13]。利用儿童肝移植数据库对比类似队列ALGS组患者与胆道闭锁组患者发现,ALGS患者心脏异常发生率更高,移植前肾小球滤过率和1年生存率更低。进一步研究发现,ALGS患者移植术后多在术后1个月内死亡,考虑与该病累及多系统有关[1]。影响患儿长期生存最重要的危险因素是先天性心脏病。因此术前仔细分析手术风险,并告知患儿家属肝移植术后的潜在风险非常重要。
ALGS合并心脏异常可能对肝移植术前、术中和术后均有影响,肝移植期间的心脏问题与右心室肥厚合并周围性肺动脉狭窄导致的右心室储备功能不足有关[8,14]。对于所有行肝移植的ALGS患儿,术前都应进行心血管危险因素评估。对于存在心血管异常的患者,应请心脏病专家详细评估。在本研究12例患儿中,例10患儿术前进行了动脉导管结扎术,例4、例5、例6和例10患儿均存在肺动脉狭窄,例9患儿存在主动脉瓣畸形、狭窄。有文献报道,ALGS患儿腹部血管异常的发生率亦较高[15]。本研究中12例患儿腹部CT检查均未发现腹部血管异常,存在心血管异常的患儿均未在肝移植术中或术后立即发生相关并发症。
研究显示,葛西手术并不影响ALGS患者肝移植术后生存率或移植物存活率[1,16]。在本研究中,有3例患儿肝移植术前因误诊为胆道闭锁而接受了葛西手术治疗,目前都预后良好。ALGS与胆道闭锁的鉴别比较困难,主要原因包括:(1)两者在新生儿期和婴儿期均可以表现为γ-谷氨酰转移酶水平升高,胆囊缺失或胆囊小,肝胆闪烁成像示踪剂肠道排泄缺失[17-18];(2)ALGS的特殊临床表现在新生儿期和婴儿期不明显;(3)ALGS常见病理学表现为肝内胆管缺乏,在婴儿ALGS患者中不常见[19];(4)由于基因检测在新生儿期可用性有限,在临床实际操作中不可行,这种检测会延误胆道闭锁患者的葛西手术时间[16,20]。因此仔细评估ALGS患者的肝外表现,尤其是心脏受累的类型、ALGS的特殊临床或放射学特征可能有助于鉴别ALGS和胆道闭锁[21]。
ALGS患儿肾功能不全可在肝移植术前出现[22],并可在随访中持续恶化[1],在围手术期和长期随访中应密切监测其肾功能。本研究中所有患儿移植术前肾功能均正常。术后随访6个月后,患儿均应进行血清肌酐、尿蛋白排泄和eGFR评估,若随访发现患儿出现肾功能不全,应减少钙调磷酸酶抑制剂类药物的用量,或加用霉酚酸酯类药物。
12例患儿在肝移植术前均存在显著的生长滞后。5例患儿在移植时存在严重的发育迟缓(身高Z评分<-3分),4例患儿存在严重营养不良(体质量Z评分<-3分)。在肝移植术后随访过程中,患儿身高和体质量Z评分分别为-1.24(-2.11,0.60)分和-0.83(-1.65,-0.43)分,表明患儿在肝移植术后生长和发育明显改善。
肝细胞癌可以发生在任何年龄的ALGS患者中,无论肝脏伴或不伴肝硬化[23-28]。本研究中,1例肝硬化患儿在病肝中检测到了中分化肝细胞癌。因此,术前对每例 ALGS患儿进行肝细胞癌风险评估非常重要。
综上所述,ALGS是一种复杂的累及多系统的常染色体显性遗传病,临床特征的外显率具有广泛的可变性。肝病是这一人群发病的主要原因,ALGS的内科治疗效果有限,当进展到终末期肝病或严重瘙痒伴生活质量差时,应及时行肝移植手术治疗。本中心的经验表明,肝移植是安全有效的,即使存在心脏和血管受累的患儿,经过仔细的术前评估,联合儿科心脏病专家会诊,该病可成功治疗[29-31]。治疗心血管异常后再行肝移植手术,同样能取得与其他常见胆道疾病相媲美的效果。

