肾脏常温机械灌注与无缺血肾移植
吴国彬 陈国栋
安全有效的器官保存是移植成功的重要条件。器官保存旨在让获取后的器官在离体状态下长时间保持组织细胞活性,以保证器官植入受者体内后可迅速恢复功能。目前肾脏体外保存方法主要包括以下几种:静态冷保存(static clod storage,SCS)、低温机械灌注(hypothermic machine perfusion,HMP)、低温氧合机械灌注(hypothermic oxygenated machine perfusion,HOMP)及常温机械灌注(normothermic machine perfusion,NMP)。
离体肾脏保存最早是采取HMP的方式,但后来由于SCS操作相对简单且成本低,而且在脑死亡器官捐献(donation after brain death,DBD)供肾保存效果方面两种方法相当,因此SCS成为了过去50年来主流的肾脏保存方式。但近年来,随着心脏死亡器官捐献(donation after cardiac death,DCD)供肾增多,HMP在降低术后移植物功能延迟恢复(delayed graft function,DGF)发生率及提高移植肾1年甚至3年存活率上有着显著优势[1]。此外,最近发展起来的HOMP在HMP基础上给予氧气供应,为组织细胞提供能量储备,减少了移植术后并发症和急性排斥反应的发生[2]。
近年来,随着肾移植等待者的不断增加和供肾短缺日益严重,越来越多的扩大标准供者(expanded criteria donor,ECD)供肾在临床应用。由于ECD供肾本身质量较差,不论是通过SCS或HMP保存,长时间的低温环境和缺血-再灌注损伤(ischemiareperfusion injury,IRI)容易造成细胞水肿、能量消耗、酸中毒及过氧化物堆积等,从而导致移植肾损伤[3]。NMP有助于减轻低温保存导致的肾损伤,因此成为了离体肾脏保存研究的热点。
NMP通过持续为离体肾脏提供氧气及能量底物,维持离体肾脏接近正常生理功能。因此既有助于修复ECD器官,也可以用于监测器官活力[4]。在此基础上,许多学者对NMP保存供肾的方法进行了不同的探索和创新,其中中山大学附属第一医院器官移植中心首创的无缺血肾移植技术(ischemia-free kidney transplantation,IFKT),将NMP应用于供肾获取、保存、移植全过程中,保持血流和供氧不中断,从根本上避免了供肾IRI发生,有助于降低术后DGF和急性排斥反应发生的风险[5]。
本综述着重总结近年来肾脏NMP方面的新进展,以及IFKT手术方式和近期疗效。
1 肾脏常温灌注机器
目前国外最常用的离体肾脏NMP仪器,是荷兰Organ Assist公司制造的 Kidney Assist设备。该仪器的灌注流量是通过压力控制的。由于集成了加热器、冷却器,温度可以设置从低温到常温变化[6]。
2 肾脏保存和肾移植手术方式
常规肾移植手术主要包括了供肾获取、保存以及移植3个阶段。其中SCS或HMP技术已成熟地应用于供肾保存过程。但近年来,随着ECD和DCD来源的肾脏增多,NMP平台在临床的应用越来越广泛,使得肾脏保存和肾移植手术方式也发生了重大的改变。根据NMP平台应用的阶段不同,分为离体NMP、常温局部灌注(normothermic regional perfusion,NRP)和IFKT 3种方式(图1)。
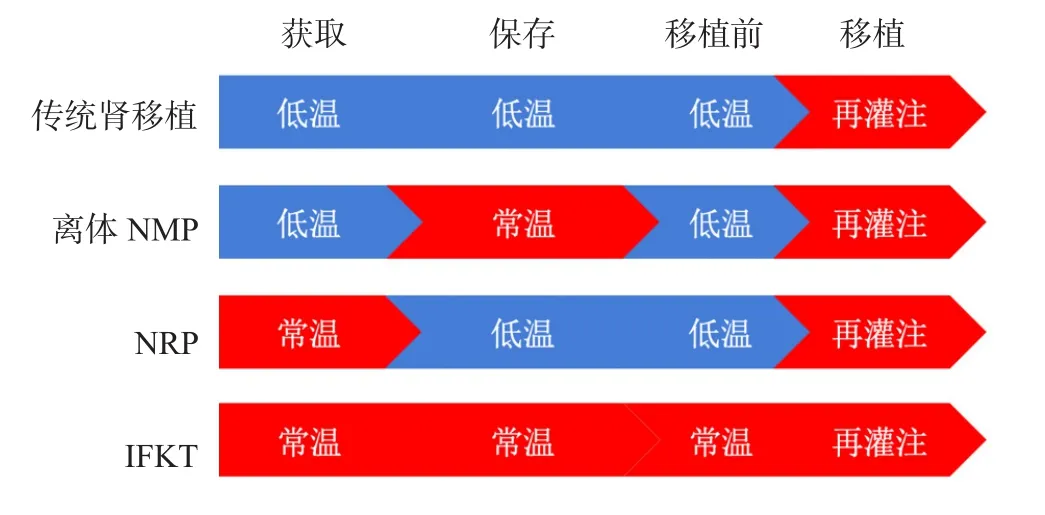
图1 传统肾移植手术和3种NMP应用方式比较Figure 1 Traditional kidney transplantation and comparison of three NMP application methods
3 肾脏在体常温局部灌注
英国的移植中心率先将NMP应用在供肾获取阶段即为NRP。具体方法是供者停止治疗并确认死亡后,被转移到手术室;经快速剖腹,并对主动脉和下腔静脉插管,分别供血和回流;同时开胸,夹闭降主动脉以防止大脑和冠状动脉再灌注。NMP结束时,再用冷高渗枸橼盐腺嘌呤溶液原位灌洗腹部器官,取出肾脏,进行常规冷保存,直至行常规肾移植手术[9]。
4 肾脏离体常温机械灌注
Hosgood团队率先将NMP技术应用到ECD供肾离体保存和修复[10]。即将常规冷保存的ECD供肾在体外进行NMP后,再用冷高渗枸橼盐腺嘌呤溶液冲洗掉常温灌注液,并重新转回冷保存直至进行常规肾移植。他们开展的前瞻性临床对照研究结果显示,与47个行SCS的ECD供肾比较,在移植术前行1 h NMP修复的18个ECD供肾术后DGF发生率降低,但术后1年移植物和受者存活率差异无统计学意义[11]。动物模型研究结果显示,与HMP或SCS相比,对DCD猪的供肾行NMP保存后进行自体移植,NMP组的移植肾早期功能改善更快,尤其表现在肌酐清除率显著增加[12]。从现阶段来看,仍缺乏证据级别较高的临床随机对照试验(randomized controlled trial,RCT)以评估离体NMP保存对减少肾移植术后DGF和急性排斥反应的优势。有一项英国Ⅱ期多中心大型RCT目前仍在进行,目的是比较SCS与NMP对DCD供肾肾移植术后结局的影响,目前研究结果尚未公布[13]。
5 无缺血肾移植
当器官组织遭受一定时间缺血后恢复灌注,组织细胞损伤程度会迅速加剧,这一现象称为IRI。先前已有不同的研究探讨了在移植前给予预处理,比如间充质干细胞等灌注治疗[14],可以减轻IRI的程度。但这些方法都无法从根本上预防IRI的发生,只能够减轻发生IRI后组织细胞损伤的程度。为从根本上消除器官IRI,我中心开创性地提出了无缺血器官移植的全新理念,即在器官获取、保存、移植3个阶段连续应用NMP,这样可以使器官持续得到血液供应和供氧,不需要经历获取和移植阶段的缺血过程,从而从理论上完全避免了IRI的发生(图1)。该项技术的可行性、安全性和有效性首先在肝移植中得到了验证,2017年我中心开展了全球首例无缺血肝移植[15]。随后我们又将这一理念扩展到了肾移植领域,2018年4月我中心开展了全球首例IFKT[5]。截止至投稿日,我中心共开展了4例IFKT,全部获得成功。
5.1 无缺血肾移植的手术方式
为了在供肾获取、保存和移植全过程中保持供肾的血流不中断,维持供血供氧,必须对传统的肾移植手术方式进行较大的改变,具体的手术方式如下[5]。
供者手术方式:首先对供者采取腹部大十字切口,打开左结肠旁沟侧腹膜,暴露左肾。游离左肾动、静脉和输尿管,将左肾周组织完全游离后,切断左肾动、静脉和输尿管,取出左肾并进行常规冷保存。随后游离右肾输尿管及右肾周组织、腹主动脉和右肾动脉、下腔静脉和右肾静脉。切断右侧输尿管并置管引流。接着在肾下腹主动脉置入NMP机器动脉导管,同时在肾下下腔静脉置入NMP机器静脉导管,并连接NMP机器。开动NMP机器并同时在腹腔干下方平面阻断肾上腹主动脉和肾上下腔静脉,建立供肾体外NMP循环。切断肾上腹主动脉和肾上下腔静脉,将右肾和血管周围组织完全游离后,将右肾及其连接的管道一起转移到NMP机器中。
供肾修整:将游离右肾移至NMP器官仓上,修整肾门及肾周多余结缔组织,用主动脉钳平右肾动脉上方阻断肾上腹主动脉,留约1 cm残端供吻合。缝合部分肾上下腔静脉残端,留1 cm开口,用主动脉钳平右肾静脉上方阻断肾上下腔静脉,保留约1 cm残端供吻合。
供肾体外NMP:以第三方洗涤红细胞作为携氧剂,用晶体液和胶体液配制成体外常温灌注液,加入微量元素、氨基酸、肝素、地塞米松、甘露醇、葡萄糖和胰岛素等营养和抑炎物质[16]。再根据上机灌注前的血气分析结果,加入适量碳酸氢钠调节酸碱平衡,控制pH值在正常范围。在灌注过程中,保持温度在37 ℃左右,灌注压力在70~80 mmHg(1 mmHg=0.133 kPa)。每0.5 h进行灌注液和尿液的血气分析,检测氧分压、pH值、渗透压等内环境指标,根据结果补充不同物质维持内环境稳态。肾脏排出尿液后以等量的乳酸林格氏液补充。根据肾脏的大体外观和灌注流速以及尿量来评估供肾质量[17]。
之后这位美术老师到大理做义工,闲暇之余,她凭着记忆和速写对绘本进行了二次创作。在她的笔下,这些文物跨越时空,和当下时兴的生活结合在一起:古代的陶舞俑舒袖跳起抖音热门的“海草舞”;南唐眉头紧锁的女持物俑成了摩拳擦掌的相扑选手;历史馆汉代标本馆里“长跪击剑”的歌舞俑更是成了广场舞的“扛把子”。而其中的一幅“剁手俑”最受网友关注,这件陶俑大部分身体完好,唯独缺了两只手,衣袖里只剩下两个空空的黑洞。这位美术老师笑称,看到这尊陶俑的时候,最先联想到的是每逢“双十一”就控制不住网上购物的欲望,网友总是用“剁手”警戒自己不再乱花钱,于是就配上了“再买就剁手”几个字,结果深受大家欢迎。
受者手术方式:做右下腹半弧形切口,逐层分离并显露髂外血管,充分游离髂外动、静脉后,将肾脏连着灌注管路摆放在受者的右髂窝合适位置。以两点法端侧吻合方式,将供肾肾上腹主动脉残端和肾上下腔静脉残端分别与受者髂外动脉和髂外静脉连续吻合。吻合完毕后,停止体外NMP,结扎并切断肾下腹主动脉和移除动脉导管,同时开放肾上腹主动脉端;开放血流30 s后,利用受者血液将常温灌注液冲洗干净,再结扎并切断肾下下腔静脉端和移除静脉导管,同时开放肾上下腔静脉回流,建立肾脏的受者血液循环供应。最后再用常规方法行移植肾输尿管膀胱吻合。
5.2 无缺血肾移植的近期疗效
2018年至今,我中心共开展4例IFKT。右肾进行无缺血移植,同时以进行常规肾移植的左肾作为对照。
临床结局:IFKT组和常规肾移植组受者术后肾功能均迅速恢复。术后1、3、7 d的尿量及术后7 d血清肌酐水平差异无统计学意义,两组受者术后均未发生DGF,且未发生感染、血栓、出血等并发症(未发表数据)。
血清肾损伤生物标志物:与常规肾移植组比较,IFKT组中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)、肾损伤分子-1 (kidney injury molecule-1,KIM-1)、肝型脂肪酸结合蛋白(liver-type fatty acid-binding protein,L-FABP)和谷胱甘肽转移酶α1(glutathione S transferase α1,GSTA1)水平均明显下降(未发表数据)。
尽管两组在临床结局上尚无明显差异,但IFKT组的血清肾损伤生物标志物水平更低。这些结果表明常规肾移植存在供肾IRI,而IFKT通过避免IRI发生从而减轻术后的肾损伤。由于这4例供肾质量较好,使得术后DGF和急性排斥反应发生率与常规肾移植组相比差异无统计学意义。在接下来的临床研究中,我们将进一步观察质量较差的ECD供肾应用IFKT是否对术后DGF有所改善。
5.3 无缺血肾移植的局限和展望
IFKT作为一种创新术式,还在不断发展和完善过程中,存在着一定的局限性。首先,从手术方式来看,IFKT目前只适用于DBD供者。未来可以尝试对DCD供者行NRP后,再续接IFKT术式,这需要进一步行大动物实验摸索新的术式。在NMP保存阶段,肾脏不断产生尿液,使得常温灌注液内环境稳态不断发生改变,这需要定时监测灌注液各离子成分、pH值、渗透压等内环境情况,以补充相应物质维持稳定。短时间灌注以乳酸林格氏液补充尚可维持稳定,但长时间灌注时,往往容易出现人为调节的滞后性,使灌注不稳定,采取尿液回收补充灌注液的方式有可能更好地维持内环境稳定[18]。为了避免过长时间NMP保存带来的不稳定性,供者获取和受者移植目前仍只能在同一个移植中心开展。在修剪供肾和吻合血管时,由于连接着灌注管路使得操作空间较少,血管容易变形、扭曲,一方面影响供肾灌注效果,另一方面对手术医师的手术操作技巧有较高要求,选取骨盆和髂窝空间较大的受者,手术相对容易操作。最后血管开放前需要利用受者血液冲洗供肾中的常温灌注液,但仍可能有少量残余灌注液进入受者血液循环造成不良反应,如灌注液中的肝素有可能造成手术过程中出血加重。总体而言,IFKT相较传统术式更为复杂,难度更高,需要更多的人员相互配合,能否简化其手术流程也成为未来能否广泛推广应用的关键。
从临床疗效来看,IFKT组受者术后移植肾功能均迅速恢复且无DGF发生。由于目前完成的IFKT例数太少,与常规肾移植组相比并未观察到术后近期疗效的差异。未来需要开展更多IFKT,尤其是应用于质量较差的ECD供肾,有可能观察到术后DGF的差异。此外还需要对IFKT受者进行长期术后随访,以观察IFKT的远期疗效。
目前有不少研究通过探索肾脏NMP中细胞转录表达及线粒体损伤情况发现,肾脏离体保存时应用NMP可以使肾脏细胞死亡、补体激活和氧化应激减少[19-20],同时增加氧化磷酸化转录表达,为组织细胞提供能量补充[21]。这为IFKT减轻术后供肾IRI提供了一定的基础理论支持。IFKT可以降低肾损伤生物标志物水平,但作用机制尚有待进一步探索和阐明。与IFKT不同的是,现在的常温灌注后行肾移植手术方案,在体外NMP后都需要经历一段冷保存时间,仍有可能导致IRI发生。
此外,在供肾体外NMP保存阶段,同样可对离体肾脏进行体外修复。比如应用免疫调节性细胞和基因沉默疗法、纳米颗粒靶向治疗、抑炎药物治疗、溶栓药物促进微血栓溶解等方法[22-28],有助于促进离体供肾功能的修复。
6 结 语
近年来,NMP的发展使器官保存方法由“冷”向“热”转变,推动了肾移植手术方式的革新。IFKT基于NMP平台,作为无缺血器官移植技术一个重要的扩展,实现了在供肾获取、保存、移植全过程血流不中断,同时可以对供肾进行体外修复,减轻了供肾IRI,有助于提高质量较差的ECD供肾利用率,解决器官短缺的问题。但目前IFKT病例数还较少,未来需要增加IFKT例数并对IFKT受者进行长期随访,以评估IFKT与SCS、HMP相比,对肾移植近期和远期结局的影响。

