血清免疫因子与多囊卵巢综合征的关系研究
张小玲,梁艳莉,陶春燕,姜彥
重庆市高新区人民医院检验科,重庆 400039
多囊卵巢综合征 (polycystic ovarian syndrome,PCOS)是一种至今病因尚不明确性的代谢性疾病,发病率在育龄期妇女中高达5%~ 10%[1]。 PCOS 的发病病程较长,可发生于青春期,一直持续到绝经期,会影响机体正常内分泌与生长代谢功能,是造成育龄期妇女不孕不育的主要原因之一[2]。 根据鹿特丹标准,PCOS 主要是根据临床症状来诊断(雄激素血症,稀发或无排卵和卵巢多囊性改变), 符合以上3 项中至少两项并排除其他代谢性疾病时即可诊断为PCOS。 目前PCOS 的发病原因不明,临床症状和病理生理的表现呈高度异质,常出现漏诊与误诊。因此,探索PCOS 的诊断标志物和实验室诊断模型,对POCS 的临床诊断与预后分析具有重要的意义。 在PCOS 患者中,体内免疫因子的变化情况与调节机制目前尚不明确, 然而PCOS 患者氧化应激和炎性的标志物与血液循环中的雄激素浓度高度相关[4-5]。 因此,该文选取2020 年1—9 月该院收治的57 例PCOS 患者和25 名健康女性,旨在分析患者免疫因子的变化情况及其与疾病的关系,探索免疫因子在PCOS 中潜在的诊断价值。 现报道如下。
1 资料与方法
1.1 一般资料
收集该院PCOS 患者共57 例(P 组),年龄22~40岁,平均(30.25±5.15)岁,均经过病史询问、性激素与超声检测,符合2013 年欧洲人类生殖和胚胎学会与美国生殖医学学会的专家会议推荐的鹿特丹标准,确诊为PCOS 患者, 并排除先天性肾上腺皮质增生、库欣综合征、分泌雄激素的肿瘤等其他致雄激素水平升高的疾病,排除高泌乳素血症、卵巢早衰和垂体或下丘脑性闭经、甲状腺功能异常等其他引起排卵障碍的疾病。同时选择25 名育龄期女性志愿者(N 组),年龄23~40 岁,平均(30.54±5.33)岁,均经临床和(或)实验室检测结果证实志愿者体健,无器质性、内分泌及风湿免疫系统疾病。 两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。 两组样本均来自重庆市高新区人民医院。该研究获得重庆市高新区人民医院伦理委员会的批准和受试者的知情同意。
1.2 仪器与试剂
贝克曼Au5800 全自动生化分析仪,丰华AutoTRFIA-4 型自动荧光分析仪,免疫因子测定试剂盒(北京九强)。
1.3 方法
P 组患者在采样前停用抗感染药物和其他影响免疫功能的药物,N 组无特殊处理。 抽取受试者空腹12 h 采集4 mL 静脉血于惰性分离胶管中, 待血液静止凝固后以3 000 r/min 离心10 min 分离血清, 使用生化分析仪 (免疫凝集法) 检测免疫球蛋白与补体(lgE、lgM、lgA、lgG、C3、C4 与CRP)。 检测均由专人专机统一检测,用同一批试剂盒,操作严格按照试剂盒说明书进行。
1.4 统计方法
采用SPSS 21.0 统计学软件对数据进行分析,计量资料采用(±s)表示,进行t 检验,两连续变量的相关性分析采用Pearson 相关分析, 用Logistic 回归分析探讨疾病的危险因素。 使用ROC 曲线分析检测标志物的诊断效能,P<0.05 为差异有统计学意义。
2 结果
2.1 两组免疫因子水平比较
P 组lgA、lgE、C3、C4、CRP 水平高于N 组, 差异有统计学意义(P<0.05)。 见表1。
表1 两组血清补体与抗体浓度对比(±s)
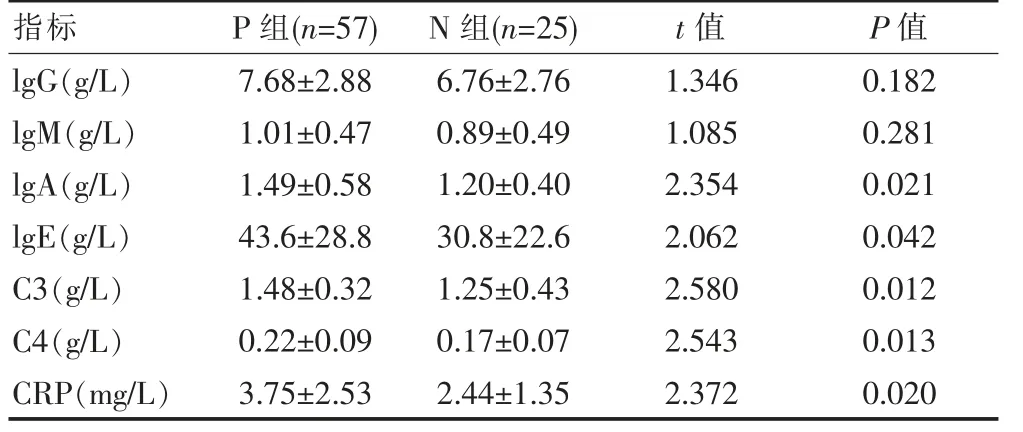
表1 两组血清补体与抗体浓度对比(±s)
指标P 组(n=57)N 组(n=25)t 值P 值lgG(g/L)lgM(g/L)lgA(g/L)lgE(g/L)C3(g/L)C4(g/L)CRP(mg/L)7.68±2.88 1.01±0.47 1.49±0.58 43.6±28.8 1.48±0.32 0.22±0.09 3.75±2.53 6.76±2.76 0.89±0.49 1.20±0.40 30.8±22.6 1.25±0.43 0.17±0.07 2.44±1.35 1.346 1.085 2.354 2.062 2.580 2.543 2.372 0.182 0.281 0.021 0.042 0.012 0.013 0.020
2.2 血清免疫因子与代谢指标的相关性
血清lgG 与雄激素 (T)、LDL-C 呈负相关 (r=-0.619, P=0.004;r=-0.540, P=0.014), 与餐后1 h 胰岛素呈正相关(r=0.452, P=0.045)。血清lgA 与T 呈负相关(r=-0.633, P=0.003),与TBA 呈正相关(r=0.6759,P= 0.001)。 C3 与LH、餐后1 h 血糖、餐后2 h 血糖、AST 呈正相关(r=0.486, P=0.003;r=0.633, P=0.003;r=0.493, P=0.027;r=0.532, P=0.047)。 C4 与餐后1 h 血糖、餐后2 h 血糖、餐后2 h 胰岛素呈正相关(r=0.452,P=0.047;r=0.672, P=0.001;r=0.463, P=0.004)。CRP 与BMI 呈正相关(r=0.527, P=0.028)。
2.3 血清免疫因子的诊断效率
采用受试者工作特征曲线 (receiver operating characteristic curve, ROC curve)分别评价血清免疫因子对PCOS 的诊断效能并寻找最优诊断阈值(Cut-off值),血清C4 的诊断价值较高,AUC 为0.676,灵敏度和特异度分别为63.2%和68.0%, 其诊断效率高于T的诊断效率。 见表2。
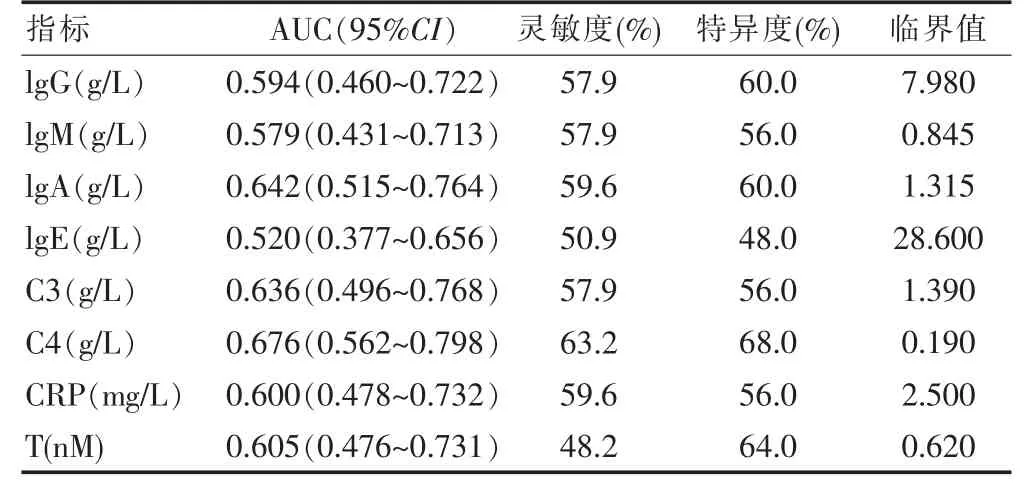
表2 PCOS 血清免疫因子的ROC 曲线分析
3 讨论
PCOS 是一种由雄性激素过剩、 排卵功能障碍和多囊卵巢为临床特征的异质性综合征[6]。 大部分患者除性激素代谢障碍,常伴随2 型糖尿病(T2DM)和心血管疾病(CVD)功能障碍。目前,PCOS 发病原因与机制尚不明确, 但一般认为该病是一种多基因遗传病,涉及甾体激素生成酶基因、与胰岛素分泌和活动有关的基因、 因子基因等, 同时不健康的饮食习惯也对PCOS 有重要影响[7-9]。虽然,肥胖是PCOS 患者常见的代谢紊乱症状之一,约2/3 的PCOS 患者超重或肥胖,但肥胖并不是PCOS 特征之一。 而因胰岛素抵抗而导致的肥胖确实与PCOS 有不可分割的联系。 一般认为,PCOS 患者促炎细胞因子的高表达,造成胰岛素介导的葡萄糖转运通路、与胰岛素及肾上腺素调节脂肪细胞内脂代谢活动异常,同时影响肝脏分泌调节蛋白与储存糖原的能力, 导致PCOS 出现胰岛素抵抗与肥胖。
慢性低级别炎症是PCOS 病理生理的基础,特别是卵巢局部组织的炎症反应被认为在PCOS 的发生与发展中起重要作用[10-12]。一方面,卵巢组织局部炎症会引起炎性因子的释放,促进卵巢颗粒细胞内CYP17 酶表达上调, 和卵巢膜细胞类固醇生成酶类活性增加,促进了雄性激素的生成与释放;另一方面,血液中炎性因子会直接导致机体发生胰岛素抵抗,进一步恶化卵巢正常的分泌功能,抑制了卵泡的生长[12-13]。 据报道,编码促炎细胞因子TNF-a 和白细胞介素-6(IL-6)的基因变异在多囊卵巢综合征人群中更为常见[11]。
目前,PCOS 的诊断主要依靠临床表现,影像学检查,以及高雄激素血症的症状与指标,缺乏特异性强、灵敏度高的实验室诊断标志物[6]。 卵巢组织的炎症反应会影响卵泡的发育,导致PCOS 的发生,其中CRP是PCOS 患者炎症反应最可信的循环标志物,meta 分析显示PCOS 患者血清中高水平的CRP 浓度与肥胖无关,一般是健康人群的2 倍[10,14-15]。 PCOS 患者的免疫系统常处于紊乱状态, 外周血中的CD4+淋巴细胞升高, CD3+和CD8+细胞显著降低, 并且PCOS 患者免疫细胞表面活化分子CD69 表达明显下降[16-18]。PCOS患者免疫性抗体异常升高,其中以抗组蛋白抗体和抗甲状腺抗体升高最为显著[19-20]。
补体是具有酶活性的一组免疫蛋白,该研究结果显示:P 组患者中C3 水平为(1.48±0.32)g/L,高于N组(1.25±0.43)g/L(P<0.05),这与何文雯等[21]的研究结果一致:患者组为(1.33±0.34)g/L,高于正常组(1.10±0.22)g/L(P<0.05)。该文进一步研究发现,C3 和C4 作为PCOS 潜在的诊断因子,诊断效能优于单一的雄激素指标。
综上所述,对PCOS 高发人群进行免疫因子的检测,对PCOS 的诊断与预防有不可取代的价值。

