肿瘤中心静脉导管相关性血栓形成的影响因素
王倩 陈丹妮
中山大学肿瘤防治中心,广州 510060
中心静脉导管适用于测量静脉压、静脉输液、长期药物注入、肿瘤化疗等,具有较高的生物相容性。中心静脉置管是恶性肿瘤患者治疗中常用的方法,可以减少患者反复穿刺的痛苦〔1〕。但长时间留置中心静脉导管容易引发多种并发症,如导管相关性血栓(Catheters Related Thrombosis,CRT)、穿刺点渗液、中心静脉导管感染等,其中CRT是由于穿刺与机械性刺激导致血管内皮功能损伤进而形成血栓,导致患者肢体肿胀、活动受限,增加治疗难度〔2-3〕。恶性肿瘤患者需要长时间输入高浓度、高刺激的药物,若发生CRT则需进行拔管处理,影响下一阶段的治疗计划。因此,为保障导管使用质量,促使治疗顺利进行,临床需针对肿瘤患者的CRT发生情况进行探讨。本研究主要分析肿瘤患者行中心静脉导管后发生CRT的影响因素,以便为临床防治CRT提供理论依据。
1 资料与方法
1.1 一般资料
采用前瞻性随机试验方法选取2020年4月至2020年10月中山大学肿瘤防治中心收治的行中心静脉置管的恶性肿瘤患者200例作为研究对象。纳入标准:①临床治疗期间均需行中心静脉置管,②肿瘤分期(参照《临床诊疗指南-肿瘤分册》相关标准〔4〕)为Ⅰ~Ⅲ期,③置管前血凝、血生化检查正常,④均可耐受彩色多普勒检查。排除标准:①既往有相同部位穿刺史的患者,②置管前伴有血栓史的患者,③置管侧肢体具有其他中心静脉通道的患者,④因导管阻塞、脱落、断管等非血栓性因素拔管的患者。纳入的200例患者中男117例,女83例;年龄41~73岁,平均(57.51±2.43)岁;其中肺癌51例,结肠癌46例,胃癌57例,食管癌35例,其他11例。患者及其家属均自愿签署知情同意书。本研究经该院医学伦理委员会批准。
1.2 方法
1.2.1中心静脉置管 中心静脉导管选自巴德公司,穿刺部位可根据治疗需求选择腋静脉、锁骨下静脉、无名静脉等,需严格遵循无菌操作原则且利用Seldinger法在床旁边进行导管置入,需定期对导管进行维护,更换敷料、清洁消毒等,均采用含肝素的无菌盐水冲管。当诊断为CRT需停止研究或怀疑感染、病情好转、病死等需根据情况拔管。
1.2.2CRT形成情况 置管后,观察置管侧上肢情况,若出现触痛、皮温升高、皮肤颜色变化等采用彩色多普勒超声(飞利浦EPIQ7C)检查;若无临床症状,可于置管后7 d、14 d、21 d、28 d行彩色多普勒超声检查。检查方法:选择频率为5~10 MHz高频线阵探头,血管较深处选择5 MHz凸阵探头。患者取仰卧位,对颈内静脉、锁骨下静脉、股静脉等进行扫查,查看血流动力学改变情况,参照《2014 ISTH指南:癌症患者上肢导管相关性深静脉血栓形成》〔5〕,若血管腔不能被压瘪、管腔内可见实性回声、彩流信号充盈缺损、血流频谱改变、挤压肢体远端血流增强消失或减弱等则可判断为CRT形成。
1.2.3基线资料统计 入组后,记录患者性别、年龄、体重指数(Body Mass Index,BMI)(BMI=体重/身高2)、肿瘤类型(肺癌、结肠癌、胃癌、食管癌、其他)、肿瘤分期、糖尿病史(有、无)、高血压史(有、无)、重大手术史(有、无)、穿刺次数、穿刺部位(腋静脉、锁骨下静脉、无名静脉)、导管尖端位置(上腔静脉下1/3、上腔静脉上1/3)、抗凝药物使用(有、无)。
1.2.4实验室检查 置管前,抽取患者空腹静脉血5 ml,放于0.2 ml枸橼酸钠抗凝试剂管中,3 000 r/min的速率离心15 min后取上层血浆,采用血凝仪(美德太平洋(天津)生物科技股份有限公司TS6000)检测患者活化部分凝血活酶时间(Activated Partial Thromboplsatin Time,APTT)、凝血酶原时间(Prothrombin Time,PT)、纤维蛋白原(Fibrinogen,FIB)、D-二聚体(D-Dimer,D-D)。
1.3 统计学方法
2 结果
2.1 CRT形成情况
200例患者中,16例发生CRT,占8.00%(16/200)。
2.2 肿瘤患者中心静脉置管后CRT形成的单因素
肿瘤患者中心静脉置管后CRT形成不受性别、年龄、肿瘤类型、肿瘤分期、高血压史、重大手术史、穿刺次数、穿刺部位、抗凝药物使用、APTT、PT、FIB水平的影响,差异无统计学意义(P>0.05);可能受BMI、糖尿病史、导管尖端位置、D-D水平的影响,差异有统计学意义(P<0.05)。见表1。
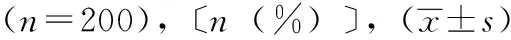
表1 肿瘤患者中心静脉置管后CRT形成的影响因素单因素分析
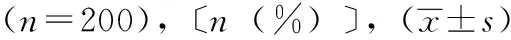
续表1 肿瘤患者中心静脉置管后CRT形成的影响因素单因素分析
2.3 肿瘤患者中心静脉置管后CRT形成的多因素
以肿瘤患者中心静脉置管后CRT发生状况为因变量,发生赋值为“1”,未发生赋值为“0”,以患者的BMI、糖尿病史、导管尖端位置、D-D水平为自变量,自变量赋值见表2。较高BMI、伴糖尿病史、导管尖端位于上腔静脉上1/3、D-D高水平均是肿瘤患者中心静脉置管后CRT发生的影响因素(OR>1,P<0.05)。见表3。

表2 自变量赋值说明
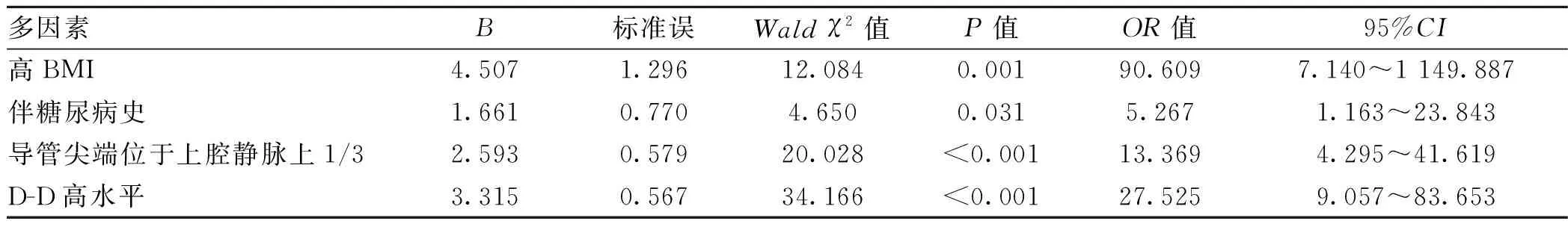
表3 肿瘤患者中心静脉置管后CRT形成的Logistic回归分析结果
3 讨论
中心静脉导管可为患者开通快速输液通道,便于抢救患者,具有安全、简便、拔管后可重复等优势,且中心静脉导管可有效监测患者静脉压,并指导补液,利于改善病情〔6〕。但长期置管可导致血管内皮功能损伤,从而诱发CRT。而CRT形成可并发肺、脑栓塞,增加临床治疗难度,进一步增加肿瘤患者病死率,因此对CRT形成情况进行分析具有必要性。
本研究结果显示,中心静脉置管CRT形成的发生率较高,需采取有效的措施进行干预。肿瘤患者中心静脉置管后CRT发生可能受BMI、糖尿病史、导管尖端位置、D-D水平的影响。进一步采用多项Logistic多因素回归分析证实,较高BMI、伴糖尿病史、导管尖端位于上腔静脉上1/3、D-D高水平均是肿瘤患者中心静脉置管后CRT发生的影响因素。分析其原因:①高BMI:BMI是衡量人体胖瘦程度与健康的指标之一,超重或肥胖可增加高脂血症、高血压的风险,且脂肪组织分泌或较多的细胞活性表达可导致血管内皮功能失调,血液黏度增加,延缓血流速度,进而增加CRT的发生风险〔7-8〕。因而较高的BMI患者可采用一定的措施(如调整饮食、适当运动等)控制体重,以此降低CRT的发生率,改善预后。②伴糖尿病史:糖尿病患者的血糖浓度较高,易增加血液的黏稠度,导致血管弹性较差,而中心静脉置管后会损伤患者的血管内皮细胞功能,诱发CRT〔9〕。此外,高血糖与胰岛素分泌不足可导致促凝因子合成,导致凝血与纤溶系统激活,易形成纤溶蛋白与血栓〔10〕。因此对于肿瘤合并糖尿病患者,在静脉中心置管前可通过控制血糖水平来降低CRT发生率,以此延长导管使用率。③导管尖端位于上腔静脉上1/3:上腔静脉下1/3处更接近右心房与上腔结脉的结合处,可使导管与血管壁呈平行状态,导管可跟随血流流向在管腔内漂浮,且上腔静脉下1/3处血流量较大,导管注入的液体可被快速稀释〔11〕。而上腔静脉上1/3处位置较浅,血流速度相对较慢,当内皮功能损伤后诱发血栓的风险较大〔12〕。因而在患者可耐受情况下尽量使导管尖端位于上腔静脉下1/3处。
目前,临床诊断血栓形成的指标较多,其中D-D是临床评估深静脉血栓形成(DVT)常用的敏感性指标。D-D是血液中交联纤维蛋白经纤维酶水解后的一种特异性降解产物,在病理状态下,当机体的凝血与纤维溶解状态失衡时,凝血倾向增强,导致纤维蛋白降解物质含量增加,引起D-D水平升高〔13-14〕。而D-D水平升高提示了机体处于高凝状态与纤维蛋白溶解亢进,是评估血栓形成的敏感性标志之一〔15〕。此外,机体凝血系统与纤溶系统的激活与疾病分期、严重程度及治疗情况密切相关,因而通过检测D-D水平可评估血栓程度及治疗效果〔16〕。但是在感染、手术等情况下,D-D会出现不同程度升高,因而不可将D-D作为评估CRT形成的唯一指标,但观察D-D的动态变化有助于评估疾病进展与预后。但是本研究仅进行为期28 d的超声血栓检查,部分患者可能在1个月后发生CRT,因而在CRT发生率统计上可能存在着一定偏差;其次影响CRT形成的因素较多,部分因素暂未纳入本研究,统计学结果可能存在偏差,未来可扩大样本量、增加纳入因素来进行深入分析。
综上所述,较高BMI、伴糖尿病史、导管尖端位于上腔静脉上1/3、D-D高水平可导致肿瘤患者中心静脉置管后发生CRT风险较高,置管前针对上述因素进行预防与评估,并采取有效措施进行干预对降低CRT发生率具有一定的价值。
利益冲突所有作者均声明不存在利益冲突

