番木瓜几丁质酶在毕赤酵母中的表达、表征及水解产物分析
吴丽娜,程 功,焦思明,冯 翠,李建军,杜昱光
(中国科学院过程工程研究所生化工程国家重点实验室,北京100190)
几丁质是一种由β-1,4糖苷键连接N-乙酰氨基葡萄糖的聚合物,它主要从虾、蟹壳和昆虫的外骨骼中分离纯化获得;几丁寡糖是几丁质的降解产物,基于几丁寡糖的抗氧化性、生物相容性、生物可降解性及无毒性质,其常被应用于生物医学、食品工程和农业等领域[1]。在生物医学领域,几丁寡糖可作为伤口敷料成分、抗菌药物、防御细胞凋亡及糖尿病药物等[2]。目前,几丁寡糖可以通过物理法、化学法、酶水解及微生物水解法获得[3-5]。相比之下,酶水解和微生物水解法可以在温和的条件下进行,更具有可控性和可预测性,并且绿色环保,成了研究的热点。但是目前主要使用的是非特异性酶,包括纤维素酶、果胶酶和淀粉酶等[6]。几丁质酶广泛存在于植物、真菌和昆虫等生物中,能够特异性地水解几丁质的β-1,4-糖苷键,又可分为内切几丁质酶和外切几丁质酶。几丁质酶主要采用提取法获得,所以大批量获取受限。为了解决这问题,科学家已经成功在双态真菌、巴斯德毕赤酵母、大肠杆菌和芽孢杆菌等宿主中表达几丁质酶[7-10]。通过几丁质酶的异源表达可以提高几丁质酶的产量,同时降低酶的获取成本,还可以制备组分丰富、新颖结构几丁寡糖,进一步提升产物的生物活性。
木瓜蛋白酶(papain),主要存在于番木瓜(Caricapapaya)的果实与茎叶中。在木瓜蛋白酶中存在能降解几丁质的几丁质酶,野生型番木瓜的几丁质酶活性均高于大豆、甜菜和马尾松等多种植物的几丁质酶活性[11],降解底物的最适pH为4.0~5.0,最适反应温度为40~45 ℃,表现出比较好的稳定性,具有进一步应用开发的潜力[12-13]。但是,在木瓜蛋白酶中能有效降解几丁质的几丁质酶类含量很低,增加了几丁质酶获取所需的成本[14]。因此,为了降低番木瓜几丁质酶的获取成本,将其在异源宿主中高效表达就可解决上述问题[15-16]。巴斯德毕赤酵母是甲醇酵母的一种,由于后续的纯化加工便利,毕赤酵母表达系统越来越受到欢迎,目前已经有400多种外源蛋白在这个系统中成功表达[17]。
在本研究中,笔者利用巴斯德毕赤酵母表达系统对来源于番木瓜的几丁质酶基因进行分泌表达并对其酶学性质进行研究,同时利用该酶水解低脱乙酰度壳聚糖,并对水解产物进行分析,以期为进一步的应用奠定基础。
1 材料与方法
1.1 材料与试剂
E.coliDH5α化学感受态细胞、T4连接酶、胶回收试剂盒以及质粒提取试剂盒,宝日医(北京)生物技术有限公司;XhoⅠ、NotⅠ、BglⅡ、毕赤酵母GS115、乙腈(色谱纯),美国Thermo Fisher公司;甲壳素、3-(三甲基甲硅烷基)丙酸-d4钠盐,Sigma-Aldrich公司;无氨基酸酵母氮源(YNB),Difco公司;蛋白Marker,北京索莱宝科技有限公司;毕赤酵母表达载体pPIC9,湖南科爱医疗器械有限公司。根据毕赤酵母密码子的偏好性对pPIC9信号肽核酸序列优化后得到载体pGBG1[18]。
YPD培养基(g/L):葡萄糖20、蛋白胨20、酵母膏10;YPD平板另加琼脂15。
BMGY生长培养基(g/L):YNB 13.4、甘油 10、生物素 0.000 4、K3PO4缓冲溶液 0.1 mol/L;pH 6.0。
甲醇缓冲复合培养基(BMMY)诱导培养基(1 L):YNB 13.4 g、甲醇 0.5%(体积分数)、生物素 0.000 4 g、K3PO4缓冲溶液 0.1 mol;pH 6.0。
1.2 仪器与设备
DYY-6C型核酸及蛋白电泳系统,北京六一仪器厂;Tanon-1600型凝胶成像系统,上海天能科技有限公司;L535R型低温冷冻离心机,湖南湘仪实验室仪器开发有限公司;MicroPulserTM电转仪,Bio-Rad公司;ACQUITY UPLC BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm)、XEVO G2-S QTOF质谱仪(配有Lock-spray 接口)、电喷雾离子源( ESI)及质谱工作站软件(Masslynx 4.1),Waters公司;AVANCE III 600 MHz型核磁共振仪,瑞士Bruker公司。
1.3 方法
1.3.1 番木瓜几丁质酶基因全合成及表达载体构建
基于来源于番木瓜的几丁质酶基因序列(GenBank:3CQL_A),人工设计毕赤酵母偏好的密码子,并在合成前对5′及3′末端分别添加XhoⅠ及NotⅠ酶切位点,进行全基因合成(委托北京擎科新业生物技术有限公司完成)。利用XhoⅠ及NotⅠ分别对含有目标基因序列的pUC18及表达载体pGBG1进行双酶切,再分别回收目标基因序列片段及线性化的pGBG1载体,然后在T4连接酶作用下连接并转入E.coliDH5α化学感受态细胞中,最后对构建的表达盒进行酶切及测序验证。
1.3.2 番木瓜几丁质酶毕赤酵母表达及酶学性质
1)外源蛋白表达实验。利用BglⅡ线性化目的基因的表达盒,对含有目的基因的片段进行切胶回收。采用电转化方法转化到毕赤酵母GS115感受态细胞中。选择组氨酸营养缺陷的基础葡萄糖(MD)平板筛挑选重组子,接着利用含有胶体几丁质(0.5%)的含有甲醇的缓冲性复杂培养基(BMMY)琼脂平板进一步筛选水解圈最大的菌株。
对筛选的菌株进行摇瓶诱导表达,先挑一个单菌落接入25 mL BMGY培养基,在 30 ℃、250 r/min条件下培养16~18 h,当OD600为2~6时,室温下1 500g离心5 min除去上清液,使沉淀悬浮在100 mL BMMY培养基里。添加甲醇至终体积分数为0.5%,之后每24 h添加一次,之后分别取样(0、24、48、72、96、120和144 h)1 mL,12 000 r/min离心3 min,上清液、沉淀分开保存,SDS-PAGE分析。
接着进行大量表达,挑一个单菌落接种到5 mL BMGY培养基里,在30 ℃、250 r/min条件下培养至OD600为2~6。将5 mL菌液全部接入200 mL BMGY培养基,在30 ℃、250 r/min培养至OD600为2~6。室温下1 500g离心5 min,除去上清液,沉淀悬浮在400 mL BMMY培养基里(OD600=1.0)。每24 h添加一次甲醇终体积分数为0.5%,总共表达5 d。室温下5 000g离心5 min,上清液和菌体分开保存,储存在4 ℃,上清液即为含有番木瓜几丁质酶的粗酶液。
2)酶学性质研究。利用SDS-PAGE检测蛋白表达情况,再由Bradford法测定粗酶液中的蛋白质量浓度。参照文献[19]制备脱乙酰度62%壳聚糖并作为反应底物,采用 3,5-二硝基水杨酸(DNS)法测定几丁质酶活性[20]。室温下将DNS溶液(1.5 mL)、粗酶(0.18 mg/mL,80 μL)、脱乙酰度62%壳聚糖(100 μL)混合反应30 min,同时做2个平行。沸水浴煮沸5 min显色,冷却后用蒸馏水稀释至5 mL,用分光光度计比色(540 nm),以对照液调零点。根据N-乙酰氨基葡萄糖的标准曲线,计算还原糖的含量。
几丁质酶活性单位(U)定义为每分钟生产1 μmol还原糖所需的酶量。
发酵酶活定义为1 mL待测酶液具有多少个酶活性单位,U/mL。
比酶活(U/mg)定义为在特定条件下单位质量(mg)酶所具有的酶活性单位数。
①pH对表达外源蛋白的影响。在pH 3.6~5.6时使用50 mmol/L的乙酸钠缓冲液,在pH 6.0~8.0时使用50 mmol/L的磷酸缓冲液,测定pH为 3.6~8.0时该酶活性,筛选出最适pH。把酶在最适pH时的初始比酶活作为100%,将不同pH时的比酶活和最适pH时的初始酶活进行比较,即可得到不同pH条件下的相对酶活。
②反应温度对该酶酶活的影响。在最适pH、不同温度下(30~60 ℃),测定几丁质的酶活性。为了取得该酶的热稳定性,分别在40、50、60、70及80 ℃下处理几丁质酶,每隔20 min测定残留酶活一次,总时长1 h。把酶在最适pH或最优条件下(最适pH和温度)的初始比酶活作为100%,在不同温度或时间点的残余比酶活和最适pH或最优条件下的初始酶活进行比较,即得到不同温度或时间点的相对比酶活。
1.3.3 低脱乙酰壳寡糖制备及组成与结构分析
对脱乙酰度为62%的壳聚糖用表达的几丁质酶制备部分乙酰化壳寡糖[19]。先称取50 g脱乙酰度为62%的壳聚糖,用水定容至1 000 mL,选用乙酸调节pH到6.0。将100 mL几丁质酶粗酶液缓缓加入,事先设置好温度为40 ℃,搅拌反应48 h。反应结束后,为了对几丁质酶进行灭活,升温到90 ℃并保持10 min。接着离心去除不溶物,对于溶液进行回收冻干,备用后续分析。
超高压液相分析条件:使用Waters ACQUITY UPLC BEH Amide色谱柱,流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱(0~2 min 15% A;2~32 min 15%~50% A;32~33 min 50%~80% A;33~36 min 80% A;36~37 min 80%~15% A;37~44 min 15% A),柱温35 ℃,流速0.3 mL/min,进样量1 μL。
质谱检测条件:ESI 源、正离子扫描模式,毛细管电压3 kV、锥孔电压60 V、离子源温度150 ℃、脱溶剂气温度500 ℃、锥孔气流量50 L/h、脱溶剂气流量为800 L/h、碰撞能量30~60 V、离子能量3 V、每0.25 s采集1次图谱。质量扫描范围150~2 000m/z。使用Masslynx 4.1质谱工作站软件对获取的液质结果进行分析,事先用超纯水配制1.0 mg/mL壳寡糖溶液,用于液质检测。
利用1H NMR及13C NMR对制备的壳寡糖的还原端及非还原端单糖组成分别进行分析,主要操作包括:第一步,称取25 mg制备好的壳寡糖冻干样品,加入0.50 mL D2O,充分溶解后加样检测。第二步,内标是 3-(三甲基甲硅烷基)丙酸-d4钠盐,样品检测仪器选用 AVANCE Ⅲ 600 MHz型核磁共振仪,其中,1H NMR检测时对水峰进行抑制减低干扰。最后,将获得的原始数据运用分析软件MestReNova进行分析,使用内标校正位移值后,对特定部位单糖进行标记(参照文献[21]的方法),具体的参考位化学移包括1H NMR中的还原端N-乙酰氨基葡萄糖(GlcNAc)(-A,δ5.19)、还原端(氨基葡萄糖)GlcN(-D,δ5.43)以及13C NMR中5位碳(C5)的非还原端GlcNAc(A-,δ78.5)及非还原端GlcN(D-,δ79.0)。
2 结果与讨论
2.1 番木瓜几丁质酶基因的克隆及毕赤酵母表达
番木瓜几丁质酶含243个氨基酸,对毕赤酵母偏好的密码子设计了该酶的基因序列,同时重新命名新的基因序列为cpchi19(GenBank: MG595780)。将合成后获得的基因构建到毕赤酵母表达载体pGBG1中[22]。采用琼脂糖电泳对酶切结果进行验证,结果见图1。由图1可知:具有目的基因的表达载体经XhoⅠ及NotⅠ双酶切后,在750~1 000 bp附近出现了1个条带(E1),与目的基因(765 bp)大小相一致;2个片段(E2)由BglⅡ对质粒线性化后获得,其中cpchi19的片段出现在10 kb附近,而抗性基因片段在3 kb附近(图1(a))。双末端测序结果也表明,目的基因被正确连接至表达载体中。
将含有目的基因的表达盒cpchi19-pGBG1线性化片段转入毕赤酵母GS115中,选用甲醇进行诱导表达,对表达产物(Cpchi19)进行SDS-PAGE分析(图1(b))。由图1(b)可知,在(2.5~3.5)×104附近出现的蛋白条带(P1)与该蛋白的预测值(2.77×104)一致,其中Bradford法测定粗酶液中的蛋白质质量浓度为0.18 mg/mL。
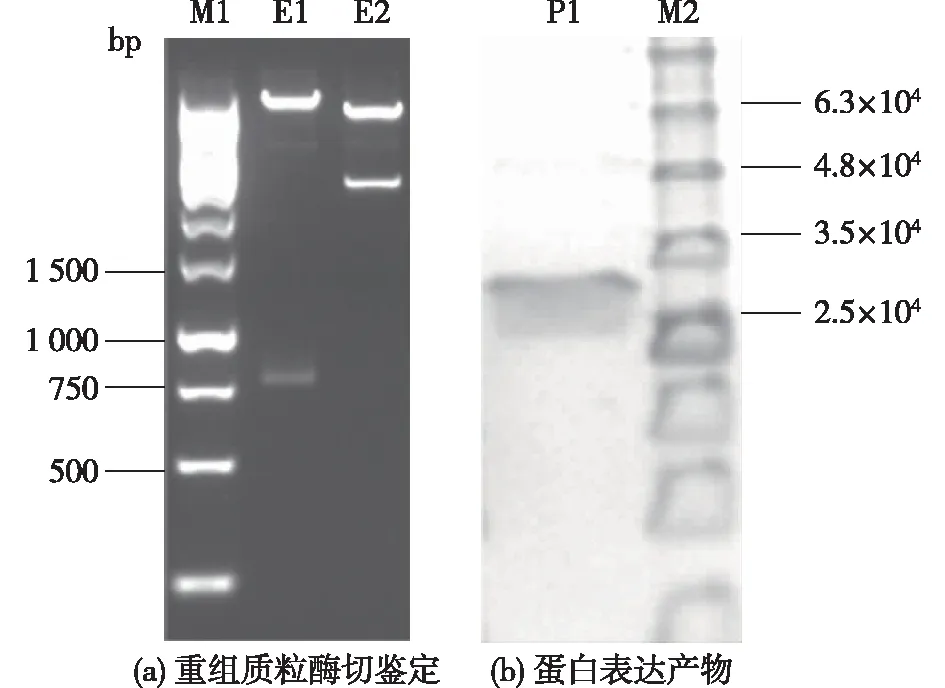
E1—Xho I和Not I双酶切产物;E2—BglⅡ酶切产物;M1—标准DNA;M2—标准蛋白;P1—诱导5 d表达的粗蛋白(离心后的上清液)图1 几丁质酶基因cpchi19重组质粒酶切产物(a)及其蛋白表达产物(b)电泳图谱Fig.1 Electrophoresis analysis of recombinant chitinase gene cpchi19 digestion by restriction enzymes (a) and overexpressed crude protein after induced for five days (supernatants after centrifuged) (b)
当前,木瓜蛋白酶中几丁质降解酶类的研究主要集中在其分离纯化及结构鉴定方面,确定了发挥几丁质降解活性的主要为糖苷水解酶19家族几丁质酶[16]。目前,多种来源的几丁质酶已在异源宿主系统中成功重组表达,例如大肠杆菌和枯草芽孢杆菌[23]。真菌对甲壳质的环境降解作用比细菌要强,但对真菌的了解比细菌的却少得多[24]。由于几丁质酶的多样性和复杂性,通过天然或异源表达获得的酶产率是影响整个过程生产率的关键因素。在本研究中,首次实现了番木瓜几丁质酶在毕赤酵母中的分泌表达。
2.2 几丁质酶Cpchi19的酶学性质研究
使用DNS法测定Cpchi19的酶学性质,结果见图2。由图2可知:该酶的最适pH为5.6,最适反应温度为75 ℃,在上述最适反应条件下的发酵酶活为0.32 U/mL。该酶在70 ℃及以下时较稳定,热处理1 h后酶活变化不大,但当温度升高至80 ℃时,该酶很快失活(图2(c)),并在处理20 min后不再具备活性。与文献[14]的最适pH为4.0~5.0及最适温度为40~45 ℃的结果有差异,主要原因可能是部分研究者使用的粗木瓜蛋白酶有差异,还可能酶不纯,存在其他水解酶类,而本研究使用的为过表达的几丁质酶。本研究中,表达的几丁质酶热稳定性较好,在70 ℃及以下时处理1 h,酶活未见明显降低,这对于后期基于毕赤酵母高密度发酵及喷雾干燥规模制备寡糖工艺具有很大的优势,可以很大程度降低酶制剂的制备成本。从最适温度测定结果来看,该酶在60 ℃时即可呈现约90%的酶活,这是利用该酶规模化制备几丁寡糖和部分乙酰化壳寡糖较适合的温度。但是,当水解几丁质和部分乙酰化壳聚糖的温度进一步升高时,副反应如Millard反应可能增强,将会影响产物寡糖的纯度。
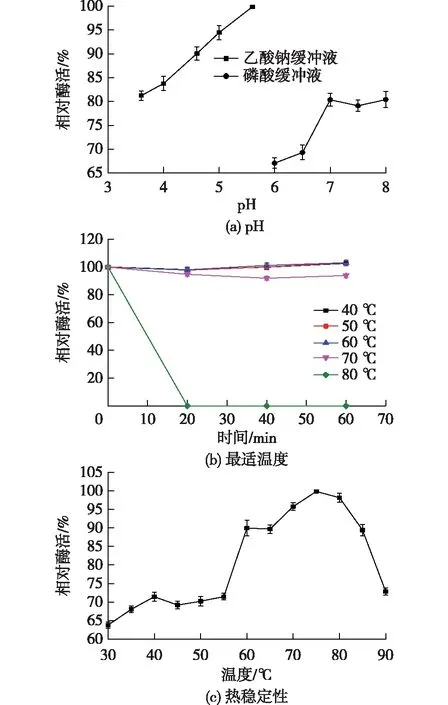
图2 pH、温度对几丁质酶Cpchi19的影响及其热稳定性Fig.2 Effects of pH (a) and temperature (b) on the activity of chitinase Cpchi19 and its thermostability (c)
2.3 几丁质酶Cpchi19水解部分乙酰化壳聚糖产物的组成及末端结构特征分析
对部分乙酰化壳聚糖(脱乙酰度62%)的水解产物利用UPLC-QTOF MS进行检测及分析,结果见图3。由图3可知:水解产物在一定程度上分离。对利用16个典型峰(A~P)的质谱信息,在这些峰中共计找到38个较为明显的潜在部分乙酰化壳寡糖组分。根据一级质谱信息,对这些不同质荷比(m/z)潜在部分乙酰化壳寡糖组分的组成进行推测,发现它们为聚合度2~20的不同脱乙酰度的壳寡糖(表1)。对照液相的总离子流图谱与质谱信息结果,发现部分乙酰化壳寡糖根据其中含有的氨基葡萄糖(GlcN)的数量由少至多出峰。不过该色谱柱难以有效分离含有相同数量GlcN但不同数量的N-乙酰氨基葡萄糖(GlcNAc)的寡糖组分。综合上述或分析,低脱乙酰度壳聚糖在该酶水解下可以获得多种部分乙酰化壳寡糖组分,这与使用传统的高脱乙酰度壳聚糖底物相比,改用低脱乙酰度壳聚糖获得的部分乙酰化壳寡糖产物的组分更加多样。
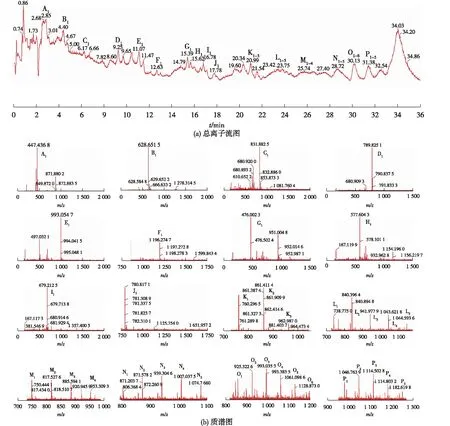
图3 Cpchi19酶解产物总离子流图(a)及质谱图(b)Fig.3 TIC (a) and mass spectrogram (b) ofhydrolysis productsbyCpchi19
该研究结果与我们前期研究结论类似,所有壳寡糖组分中均含有GlcNAc[25]。将此结果与来源于糖苷水解酶18家族的里氏木霉几丁质酶水解产物进行了比较,发现在获得的寡糖组分中除了GlcNAc的含量明显偏高,还含有全乙酰化的几丁三糖及几丁四糖产物,而部分乙酰化壳寡糖组分中的N-乙酰氨基葡萄糖含量均不小于氨基葡萄糖的含量[26]。另外,上述结果表示来源于糖苷水解酶19家族的木瓜几丁质酶在水解部分乙酰化的壳聚糖时,对糖链中GlcNAc的丰度有一定的要求。研究证实,壳寡糖发挥生理功能的主要方式可能为与动植物特定受体结合。目前已知的绝大部分壳寡糖受体,如甘露糖受体[27]、植物几丁质受体[28]及几丁质酶样结合蛋白YKL39[29]和YKL40[30]等,均可识别部分乙酰化壳寡糖链中的GlcNAc。利用本研究获得的几丁质酶制备部分乙酰化的壳寡糖,可以获得相对富集的GlcNAc含量较高的壳寡糖并且可能具有更高的生物活性。
为了了解酶解产物部分乙酰化壳寡糖的还原端及非还原末端结构特征,使用1H NMR及13C NMR进行鉴定,结果见图4。由图4可知:产物的还原末端主要为GlcNAc,同时还含有少量GlcN;非还原末端则同时包含GlcNAc及GlcN。总的来说,该几丁质酶优先水解糖苷键GlcNAc-GlcNAc和GlcNAc-GlcN,GlcN-GlcNAc在一定程度上被水解。几丁质酶主要分布在糖苷水解酶18及19家族中,而植物几丁质酶根据序列同源性又可以分为5类:第Ⅰ、Ⅱ及Ⅳ类属于19家族糖苷水解酶;第Ⅲ及第Ⅴ类属于18家族。本研究表达的几丁质酶在氨基酸序列上与第Ⅰ家族植物几丁质酶同源性较高,被糖活性酶数据库(www.cazy.org)归属为Ⅰ类几丁质酶,而Subroto等[15]考虑到该酶没有Ⅰ类几丁质酶典型的几丁质结合结构域,将其归类至Ⅱ类几丁质酶。目前,针对该酶对部分乙酰化壳聚糖底物的识别特异性尚缺乏研究。Sasaki等[21]对水稻来源的第Ⅰ及
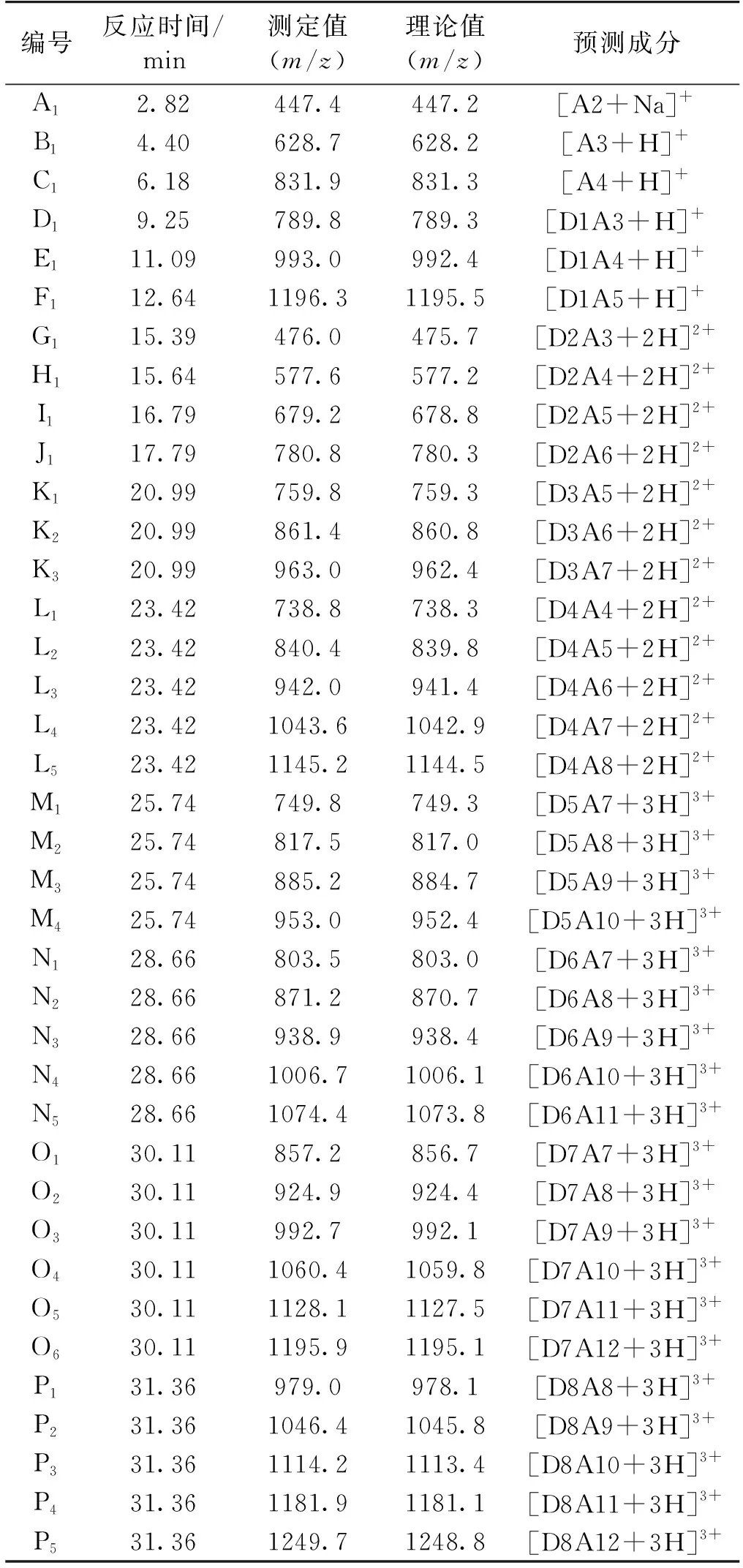
表1 Cpchi19水解产物组分鉴定
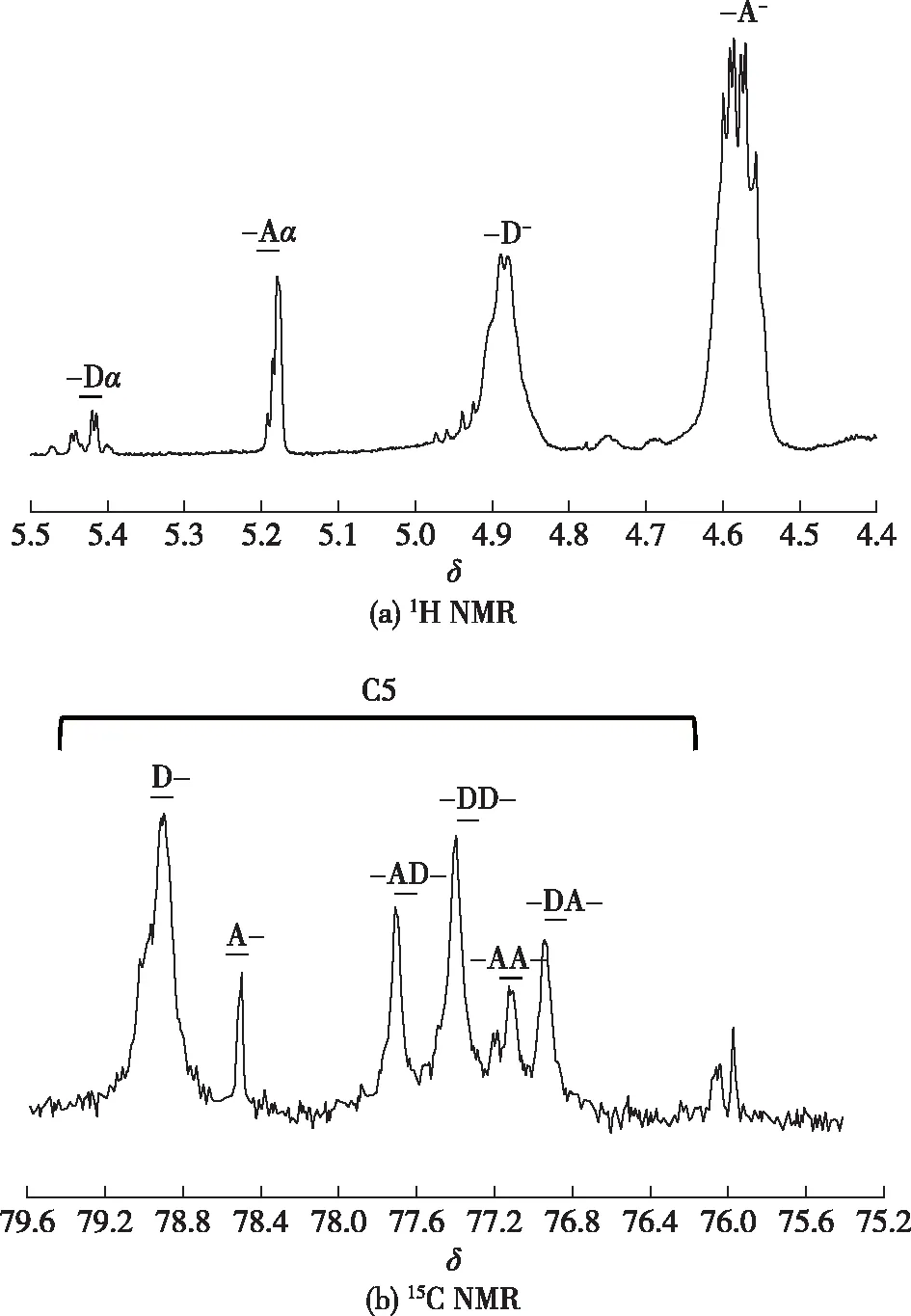
图4 Cpchi19酶解产物1H NMR及13C NMR分析Fig.4 1H NMR and 13C NMR spectra of hydrolysis products by Cpchi19
第Ⅲ类几丁质酶水解不同脱乙酰度壳聚糖的产物结构特征进行了研究,发现水稻Ⅰ类几丁质酶水解产物部分乙酰化壳寡糖的非还原末端主要为GlcNAc,同时含有少量的GlcN。这与本研究表达的几丁质酶性质类似,还原端则大部分为GlcNAc,而本研究表达的几丁质酶水解产物的非还原端则同时包含GlcNAc及GlcN。因此,本研究表达的几丁质酶在识别部分乙酰化壳聚糖底物上与水稻Ⅰ类几丁质酶存在一定的差异,具有独特的水解特征。
3 结 论
对于来源于番木瓜的几丁质酶基因在毕赤酵母中成功分泌表达,摇瓶条件下的蛋白质表达量为0.18 mg/mL,酶活为0.32 U/mL。通过酶学性质研究表明该酶的最适pH和温度分别为5.6和75 ℃,在70 ℃及以下较稳定,证明了该几丁质酶具有良好的热稳定性,具备很好的工业应用潜力。为了进一步研究该酶的水解特性,对低脱乙酰度壳寡糖进行了酶解研究,随后对其组成及结构特征进行了分析鉴定,结果发现,酶解产物中含有聚合度2~20、不同脱乙酰度的38个壳寡糖组分,可得到还原端及非还原端均同时含有N-乙酰氨基葡萄糖及氨基葡萄糖。总的来说,与传统壳寡糖相比,番木瓜几丁质酶水解制备的低脱乙酰度壳寡糖组分更加多样,可能具有更高的生物活性,为商业应用性奠定基础。

