酿酒酵母TPS2基因敲除菌的构建及其对细胞抗逆性的影响
焦宏亮,王梦飞,朱 红,张婷婷,周 华,蔡 恒
(南京工业大学生物与制药工程学院,江苏南京211800)
海藻糖是一种由两个葡萄糖分子以1,1-糖苷键所构成的非还原性二糖,因其糖苷键的结合方式不同而形成3种异构体,即海藻糖(α,α)、异海藻糖(β,β)和新海藻糖(α,β)[1-2]。其中,α,α-海藻糖广泛存在于藻类、细菌、昆虫、无脊椎动物及酵母等多种生物体内,但不存在于哺乳动物中。海藻糖不含还原端羟基,是一种不能参与糖基化反应的稳定分子[3-4]。在恶劣环境下,海藻糖能够在细胞表面形成独特的保护膜,从而有效地保护蛋白不因变性而失活,对生物体具有保护作用[5-6]。此外,海藻糖还具有分子伴侣特性,可防止蛋白质错误折叠或聚集,并通过促进自噬,有助于去除聚集的蛋白质,在治疗神经性疾病方面也有着一定的作用[7-9]。在胞外添加的雷帕霉素和海藻糖可以治疗小鼠的帕金森病(PD)模型的自噬激活和行为缺陷,这成了治疗PD的一种潜在方向[10]。胞外添加α-突触核蛋白(α-syn)聚集体则主要损害溶酶体活性,会导致受体细胞内的α-syn积累,而海藻糖作为一种重要的自噬诱导剂,能阻止溶酶体活性的改变并减少胞内的α-syn积累[11]。
海藻糖在酿酒酵母中是通过两步途径合成。第一步,在海藻糖-6-磷酸合成酶(由TPS1基因编码)作用下,由尿苷-5-二磷酸葡萄糖(UDP-葡萄糖)和葡萄糖-6-磷酸形成海藻糖-6-磷酸;第二步,海藻糖-6-磷酸在海藻糖-6-磷酸磷酸酶(由TPS2基因编码)的去磷酸化作用下形成海藻糖[12]。TPS1除了能编码合成海藻糖之外,还具有调节糖代谢的功能;酵母TPS1Δ突变株在葡萄糖存在的情况下引起生长缺陷[13-14]。迄今为止,大多数的高等植物基因组中都含有TPS基因家族,海藻糖在高等植物中有着重要的调节作用[15-16]。Tps1作为TPS复合物的关键亚基,未磷酸化的Tps3(海藻糖6-磷酸合酶/磷酸酶的调节亚基)可能作为Tps2的激活剂发挥作用,恢复海藻糖的合成[17]。Tps2和Pfk2(6-磷酸果糖激酶β亚基)的合成是酿酒酵母正常生长和热胁迫调节所必需的[18]。另外,TPS2基因的缺失对Tps1的活性无影响,但会导致海藻糖-6-磷酸磷酸酶活性完全丧失,并且在热应激时会积累过量的海藻糖-6-磷酸[19]。海藻糖并不能完全恢复因TPS1Δ或TPS2Δ突变菌所引起的生长缺陷[20]。然而有研究人员认为酿酒酵母对各种外界胁迫条件(氧化、渗透压、温度等)的耐受性依赖于海藻糖代谢途径而非海藻糖自己本身[21-22]。虽然海藻糖作为一种渗透性保护剂,与其在体内抗逆作用的相关性仍不完全明晰,但是TPS2基因的研究有助于解析细胞抗逆性系统的影响,为海藻糖用于治疗相关疾病奠定理论基础[23]。
酵母细胞与人体细胞有着类似的衰老代谢机制,因其具有多种优势;已作为真核生物模式菌被应用多年[24-25]。1996年酵母基因组测序完成后,发现其基因表达调控和信号转导机制与高等动植物具有高度同源性[26]。目前已有许多研究者以酿酒酵母为模式生物进行基础性研究,成为当今生物学研究的热点之一[27]。本研究采用 Cre-LoxP 系统、Kanr抗性标记和同源重组技术敲除TPS2基因,构建酿酒酵母TPS2基因缺失菌株,分析在外界胁迫条件下TPS2基因敲除对酵母菌海藻糖合成和细胞抗逆性的影响。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
酿酒酵母模式菌BY4741(S.cerevisiaeBY4741,MATahis3Δ1leu2Δ0met15Δ0ura3Δ0)为笔者所在实验室保藏菌株;质粒pUG6(含抗遗传霉素G418的Kanr筛选标记和LoxP位点)由广西大学杜丽琴教授惠赠;质粒pYX212(含有尿嘧啶筛选标记)由南京工业大学陈勇老师惠赠;以上2种质粒在大肠杆菌中均具有氨苄青霉素(Amp)抗性。
1.1.2 酶、试剂和仪器
rTaq酶、PrimeSTAR@Max DNA Polymerase、5×PrimeSTAR Buffer(Mg2+plus)、T4 DNA Ligase、10×T4 DNA Ligase Buffer、DNA Marker DL10000、DNA Marker DL5000、DNA Marker DL2000、dNTP Mixture、Agarose Gel DNA Purification、酵母基因组提取试剂盒、质粒小量提取试剂盒、小量琼脂糖凝胶DNA回收试剂盒及相关的常规限制酶,TaKaRa公司;G418、Amp,生工生物工程(上海)股份有限公司;PCR 仪,Biometra公司;凝胶成像系统、电转仪,美国 Bio-Rad 公司;高速冷冻离心机,德国Eppendorf公司;荧光显微镜,德国莱卡公司;超低温冰箱,日本Sanyo公司;培养箱、水浴锅,上海精宏实验设备有限公司;电泳仪,北京六一生物科技有限公司;其余试剂均为进口或国产市售分析纯。引物均由南京金斯瑞公司合成。
1.1.3 引物
根据SGD(Saccharomycesgenome database)数据库的TPS2基因(S000002481)和GenBank 的pUG6 序列(登录号:AF298793.1)设计引物,敲除引物命名为QC-F、QC-R,基因TPS2验证引物为A、B、C、D。根据Hind Ⅲ、SacⅠ酶切位点设计TPS2回补引物HB-F、HB-R。所涉及的引物及其序列见表1。

表1 PCR引物及序列
1.1.4 培养基
YPD培养基:酵母膏0.5 g、蛋白胨1 g、葡萄糖2 g,去离子水定容至100 mL,自然pH;若需配制平板则加入琼脂 2 g,用于酵母细胞的培养。
YPD+G418培养基:每50 mL培养基加入500 μL 10 mg/mL的G418母液,终质量浓度100 μg/mL;若需配制平板则加入琼脂 2 g,用于酵母转化子的筛选。
LB培养基:酵母提取物0.5 g、胰蛋白胨 1 g、NaCl 1 g、去离子水定容至100 mL;若需配制平板则加入琼脂 2 g,用于大肠杆菌的培养和保藏。
LB+Amp培养基:在100 mL培养基中加入100 μL 50 mg/mL的Amp母液,终质量浓度为50 μg/mL,用于含质粒大肠杆菌的培养与提取。
PBS缓冲液:KCl 0.2 g/L、KH2PO40.24 g/L、NaCl 8.0 g/L、Na2HPO41.44 g/L,调节pH至7.4。
以上培养基均须在高压蒸汽灭菌锅中121 ℃灭菌20 min,葡萄糖单独灭菌;G418与Amp须过滤除菌,在培养基降至合适温度后再加入。
1.2 方法
1.2.1 含G418抗性基因(kanr)及TPS2同源臂的PCR扩增
实验所用的质粒电转化至大肠感受态细胞中,参照分子克隆中的电击转化法操作。利用碱裂解法从大肠杆菌中提取质粒pUG6,以该质粒为模板,以 QC-F、QC-R 为引物进行 PCR 扩增获得同源臂TPS2基因敲除组件。扩增条件:退火温度54 ℃,延伸时间3 min,总体系为100 μL,30个循环;待PCR结束后取 2 μL PCR产物用0.8%琼脂糖凝胶电泳检测。
1.2.2 酿酒酵母电转化感受态细胞的制备
将酿酒酵母BY4741单菌落接种到50 mL YPD液体培养基中,在30 ℃、200 r/min条件下摇床过夜培养;按体积比2%接种量将种子液接种至100 mL YPD培养基中,接种4瓶,再于30 ℃、250 r/min摇床振荡培养3~5 h;将培养的菌液转移至冰预冷的离心管中,并于冰上冰浴30 min,并将离心机预冷至4 ℃,4 000 r/min 离心15 min,弃上清液;用200 mL冰预冷的超纯水洗涤重悬菌体,4 ℃、4 000 r/min离心15 min,重复洗涤2次;用100 mL冰预冷的1 mol/L山梨醇溶液洗涤并重悬菌体,4 000 r/min离心15 min,弃上清液;再用100 mL冰预冷的山梨醇溶液洗涤并重悬菌体,4 ℃、4 000 r/min离心15 min后弃上清液,用残留的山梨醇溶液将菌体溶解,不需加入新的山梨醇溶液溶解;溶解后的菌体,每管分装100 μL至冰预冷的1.5 mL EP离心管中,于-80 ℃保存。
1.2.3TPS2基因敲除菌的构建
将含G418抗性(kanr)及TPS2同源臂 PCR产物(约400 ng)加入 100 μL感受态细胞中,混匀后转移至2 mm电转杯预冷5 min,并使用Eppendorf公司的电转化仪进行电转化(参数:电压1.5 kV、电容25 μF、电阻400 Ω、电击间距2 mm)。电转后立即加入 1 mL预冷山梨醇溶液在30 ℃、180 r/min摇床振荡培养2~3 h进行复苏,结束后5 000 r/min 离心1 min,弃去部分上清液,留下100 μL浓缩液涂布于含 100 μg/mL G418 的 YPD筛选平板上,30 ℃培养2~3 d以观察是否有转化子。
1.2.4 酿酒酵母转化子的筛选与鉴定
将平板上出现的单菌落挑选至含 100 μg/mL G418 的YPD 液体培养基中,在30 ℃、200 r/min条件下摇床培养过夜后,12 000 r/min离心2 min收集菌体,使用试剂盒提取重组菌DNA,并以获得的基因组为模板,用 Taq DNA 聚合酶和引物对 A/B、C/D 进行PCR验证TPS2基因的敲除菌,验证成功的敲除菌命名为TPS2Δ。酵母基因提取步骤参照试剂盒说明书进行操作。
1.2.5TPS2基因回补菌的构建及验证
将酿酒酵母BY4741与TPS2敲除菌接种于YPD液体培养基中,于30 ℃、200 r/min条件下培养过夜后,离心2 min收集菌体,使用生工生物工程(上海)股份有限公司的试剂盒提取BY4741的总DNA,并以总DNA为模板,用高保真酶、引物对HB-F/HB-R进行PCR扩增,扩增好的序列先与质粒pUC18进行连接,再进行测序;测序成功后的序列再与pYX212质粒连接,进行电击转化,将转化子涂布于具有Amp抗性的LB平板上,筛选出连接成功的转化子,再提取质粒后电转化至TPS2敲除菌感受态中,涂布在尿嘧啶缺陷型培养基中进行重组子的筛选,然后用pYX212上多克隆位点(MSC)区域两端的验证引物YZ-F/YZ-R进行PCR验证,从而得到TPS2回补菌(记作TPS2Δ-tps2)。
1.2.6 不同应激条件下的表型实验分析
将BY4741、TPS2Δ-tps2和TPS2Δ菌培养过夜制备种子液,再将菌液稀释至相同OD600后分别接种后在以下条件下培养:在30 ℃和42 ℃ YPD液体中、含1 mol/L NaCl的YPD液体及含4 mmol/L H2O2的YPD液体中,180 r/min进行培养,每隔2 h取菌液测定OD600,一直持续到菌液OD600趋于平稳。
1.2.7 活性氧的测定
用活性氧(ROS)检测试剂盒(南京建成公司)测定酵母胞内ROS水平。将BY4741、TPS2Δ-tps2和TPS2Δ单菌落分别接种于YPD液体培养基中,在30 ℃、180 r/min条件下摇床过夜培养,隔夜培养物稀释于新鲜YPD中,调整OD600为0.1,在30 ℃、180 r/min条件下摇床培养4 h后,分别加入4 mmol/L H2O2进行氧化处理0.5 h,离心后加入PBS洗涤缓冲液2次,再用磷酸缓冲液(PBS)重悬,加入适量2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)探针,30 ℃孵育40 min,PBS洗涤重悬2~3次,取10 μL于荧光显微镜中观察。
1.2.8 海藻糖含量的测定
海藻糖的提取操作如下:将BY4741、TPS2Δ-tps2和TPS2Δ单菌落分别接种于25mL普通YPD液体培养基中,180r/min、30 ℃摇床过夜培养。将BY4741、TPS2Δ-tps2和TPS2Δ菌液各取l0 mL菌液分别于30和42 ℃进行处理2 h,结束后10 000 r/min离心10 min,弃上清液并用预冷的双蒸水洗涤菌体3次。向每个试管中加入4 mL 0.5 mol/L的三氯乙酸(TCA)溶液,将菌体悬浮后置于冰水浴中,30 min后提取海藻糖,重复3次后合并上清液。取1 mL上清液,加入4 mL的蒽酮试剂,摇匀后置于冰水中冷却,然后沸水浴中煮沸10 min,迅速取出放入冰水中冷却,室温静置10 min,在620 nm处测吸光值,每组设置2个平行[ 28]。
2 结果与讨论
2.1 TPS2Δ敲除菌的构建与验证结果
PCR扩增得到的G418抗性基因同时引入TPS2基因同源臂用于后续基因同源重组。以 QC-F、QC-R 为引物,利用 PCR 获得带有 2 个 LoxP位点和kanr筛选标记基因片段,进行电泳验证,结果如图1所示。由图1可知:扩增得到片段大小与理论预计(1 880 bp)一致,说明该PCR 产物即为TPS2基因敲除组件。
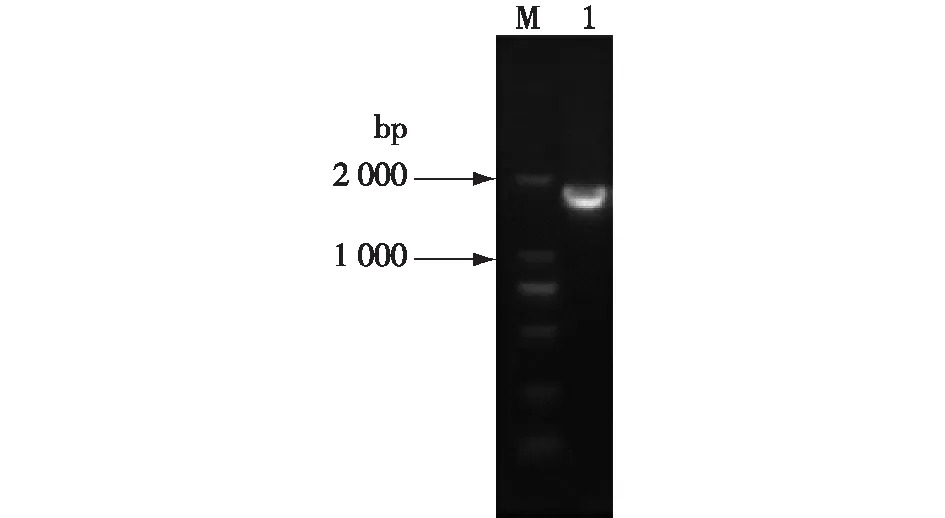
M—DL5000;1—TPS2Δ PCR产物图1 TPS2敲除组件的琼脂糖凝胶电泳分析Fig.1 Agarose gel electrophoresis analysis of TPS2 gene disruption cassettes
采用电击转化法将TPS2基因敲除序列组件转入酿酒酵母中。由于TPS2基因敲除序列组件中包含异源显性的kanr标记,将构建好的序列组件转入酵母细胞后,其两端与酵母基因组同源的序列将引发同源重组替换,最终以loxp-kanr-loxp取代基因组中的TPS2从而赋予转化子G418(遗传霉素)抗性。2~3 d后可在含G418的平板上获得转化子。
提取转化子基因组,以A/B、C/D为引物,进行PCR扩增,进行电泳验证,结果见图2。由图2可知:使用引物A与B配对得到261 bp左右的产物,使用引物C与D得到了840 bp左右的产物,由此说明TPS2基因敲除成功。
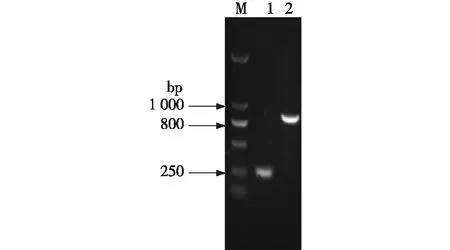
M—DL2000;1—A/B PCR产物;2— C/D PCR产物图2 TPS2基因A/B及C/D PCR产物的琼脂糖凝胶电泳分析Fig.2 Agarose gel electrophoresis analysis of TPS2 gene A/B and C/D products
为了进一步验证TPS2基因敲除成功,将扩增出的A/D PCR产物送南京金斯瑞公司测序,测序结果表明TPS2基因敲除成功。
2.2 TPS2回补菌的构建以及验证结果
通过将TPS2与pYX212质粒连接后,转化至大肠杆菌细胞中,随后提取质粒用Hind Ⅲ和SacⅠ进行双酶切,再进行琼脂糖凝胶电泳验证分析,结果见图3。由图3可知:质粒进行双酶切后产物大小分别约为8 300与2 700 bp。由此可见,TPS2基因已成功与pYX212质粒连接。
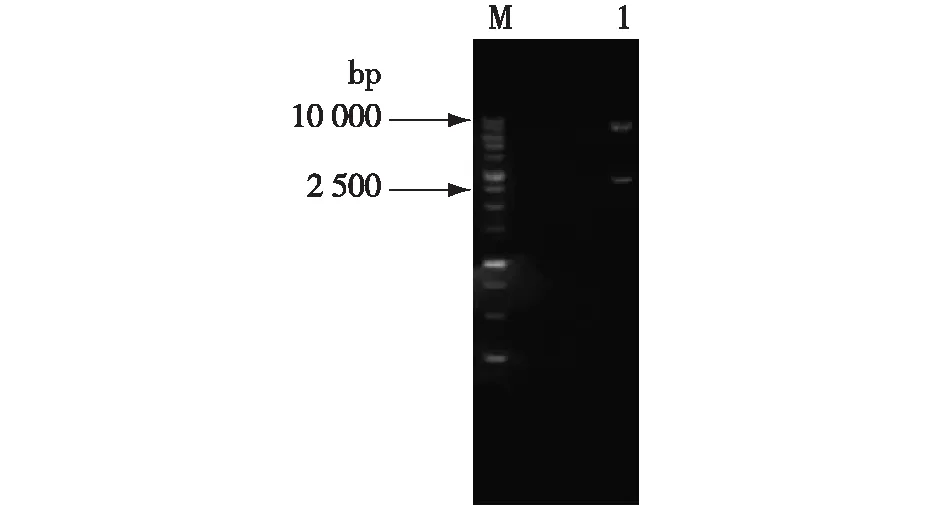
M—DL10000;1—重组子酶切产物图3 TPS2回补菌重组子酶切产物的琼脂糖凝胶电泳分析Fig.3 Agarose gel electrophoresis analysis of TPS2 replenishing bacteria recombinant digestion products
酶切验证成功后,通过将质粒pYX212-TPS2转入TPS2Δ中,并使用验证引物进行PCR后,然后进行凝胶电泳检测,结果见图4。由图4可知:PCR产物大小约为2 700 bp,由此可见,质粒pYX212-TPS2已成功转入TPS2Δ中,TPS2回补菌构建成功。
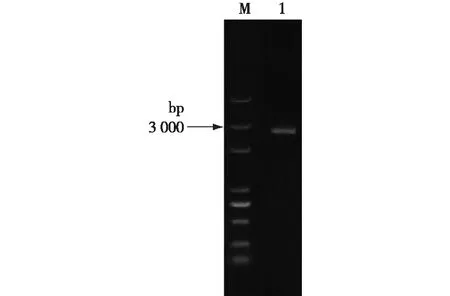
M—DL5000;1—转化子菌落PCR产物图4 TPS2回补菌PCR验证的琼脂糖凝胶电泳分析Fig.4 Verification of TPS2 replenishing bacteria PCR by agarose gel electrophoresis
2.3 不同应激条件下重组菌株生长曲线分析
将BY4741、TPS2Δ和TPS2Δ-tps2菌株进行过夜培养制备种子液,稀释至OD600相同后分别接种于25 mL 的普通YPD液体培养基中,通过在不同温度(30 或42 ℃)、不同盐浓度(0或1 mol/L NaCl)、不同H2O2浓度(0或4 mmol/L H2O2)进行培养,每过2 h取200 μL于96孔板上测定OD600,一直持续到菌液OD600平缓,结果见图5。
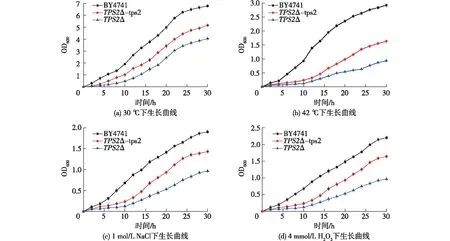
图5 BY4741/TPS2Δ/TPS2Δ-tps2在不同应激条件下的生长曲线Fig.5 Growth curves of BY4741/TPS2Δ/TPS2Δ-tps2 at different stress conditions
由图5可知:在30 ℃条件下,BY4741生长趋势高于回补菌TPS2Δ-tps2,而TPS2Δ-tps2生长情况略好于敲除菌TPS2Δ;在42 ℃高温胁迫条件下,BY4741、TPS2Δ、TPS2Δ-tps2均受到抑制,BY4741生长情况仍然是远好于TPS2Δ和TPS2Δ-tps2,而TPS2Δ-tps2生长情况略好于TPS2Δ;在1 mol/L NaCl盐胁迫条件下,BY4741、TPS2Δ、TPS2Δ-tps2的生长均受到严重抑制,但BY4741的生长情况略好于TPS2Δ-tps2,而TPS2Δ-tps2的略好于TPS2Δ;在4 mmol/L H2O2氧化胁迫条件下,BY4741、TPS2Δ、TPS2Δ-tps2的生长也受到严重抑制,BY4741的生长情况略好于TPS2Δ-tps2,而TPS2Δ-tps2的略好于TPS2Δ。由于TPS2基因的缺失导致TPS2Δ胞内海藻糖无法正常合成,而BY4741能够正常合成海藻糖,TPS2Δ-tps2只能合成少量的海藻糖,因此出现BY4741的生长情况好于TPS2Δ-tps2,TPS2Δ-tps2的生长情况好于TPS2Δ的现象。由图5还可知,在高温胁迫条件下,BY4741与TPS2Δ、TPS2Δ-tps2的生长情况差异最为明显,因而后续实验将在高温胁迫条件下进行。由此可推断TPS2基因的严重缺失会影响海藻糖的合成,导致细胞抗逆性减弱,进而影响到细胞生长。
2.4 ROS含量分析
将BY4741、TPS2Δ和TPS2Δ-tps2菌株接种于10 mL YPD培养基中,30 ℃过夜培养,离心收集菌体,加入PBS洗涤2次并用PBS悬浮菌液至OD600为0.1,加入1 μL DCFH-DA荧光探针,混匀后置于30 ℃摇床共孵育1 h,再次用PBS洗涤2~3次,吸取5~10 μL于载玻片上,在荧光显微镜下观察,结果如图6所示。

图6 胞内ROS水平Fig.6 Intracelular ROS level
由图6可知:与对照菌BY4741相比,TPS2Δ有较多的细胞被染成绿色荧光,由此可推断TPS2的缺失增强了细胞的氧敏感性,导致胞内ROS增多,这可能是因为无法正常合成海藻糖而导致细胞面对氧化胁迫无法做出应激反应;而TPS2Δ-tps2被染色的细胞比TPS2Δ的明显减少,由此可见TPS2基因的确会影响细胞抗氧化能力。
2.5 在不同温度下海藻糖含量的测定
通过不同质量浓度的海藻糖溶液(0、0.01、0.02、0.04、0.06、0.08和0.10 g/L)与蒽酮试剂进行反应,在620 nm的波长下测定吸光值,以吸光值为纵坐标,海藻糖浓度为横坐标,制作标准曲线,得到标准曲线y=7.206 2x-0.011 7。
将过夜培养的BY4741、TPS2Δ-tps2和TPS2Δ菌液(湿质量约0.02 g)进行30 ℃和42 ℃处理后,10 000 r/min离心10 min后弃上清液并用预冷的双蒸水洗涤菌体3次。向每个试管中加入4 mL 0.50 mol/L的TCA溶液,将菌体悬浮后置于冰水浴中,30 min后提取海藻糖,重复3次后合并上清液。取1 mL上清液,加入4 mL的蒽酮试剂,摇匀后置于冰水中冷却,然后沸水浴中准确煮沸10 min,迅速取出放入冰水中冷却,室温静置10 min,在620 nm处比色。根据海藻糖标准曲线,计算得到的结果如图7所示。
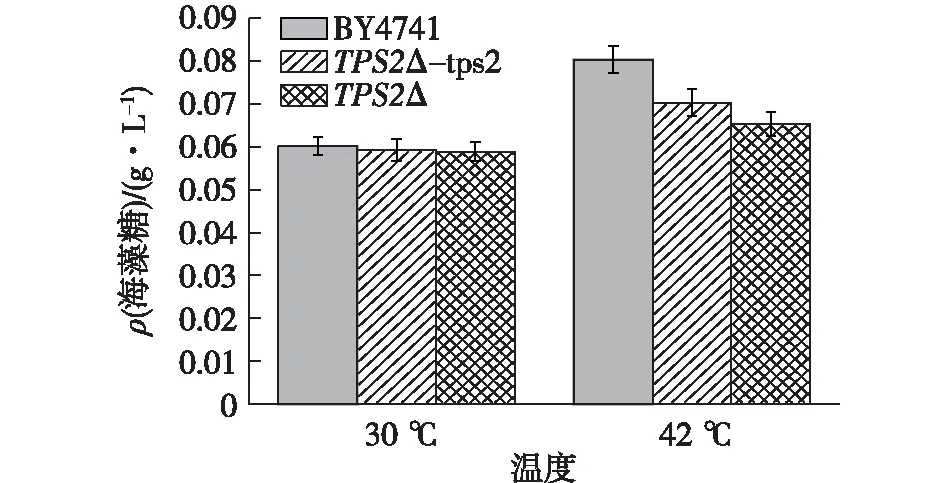
图7 BY4741/ TPS2Δ-tps2/ TPS2Δ在不同温度条件下的海藻糖含量Fig.7 Trehalose content in BY4741/TPS2Δ-tps2/ TPS2Δ at different temperatures
由图7可知:在30 ℃时,BY4741和TPS2Δ菌株中的海藻糖含量基本一致,然而生长表型却有差异,这可能由于30 ℃属于酵母细胞正常生长温度,并没有受到外界应激(高温),所以胞内海藻糖含量并不高,差异也不明显;在经过42 ℃处理后,BY4741的海藻糖含量明显高于TPS2Δ-tps2和TPS2Δ的,由此可见,TPS2基因的缺失确实影响了细胞海藻糖的合成,而TPS2Δ-tps2的海藻糖含量略高于TPS2Δ的,由此可见,在正常条件下,酿酒酵母胞内海藻糖含量较少,海藻糖合成的相关基因也处于低表达水平;而在高温、氧化等刺激条件下,胞内海藻糖迅速积累,回补菌中TPS2基因确实已表达并在一定程度上弥补了海藻糖的缺失。
3 结论
以酿酒酵母模式菌株 BY4741 为出发菌株,通过同源重组对酵母TPS2基因敲除,命名为TPS2Δ;在敲除菌的基础上重新构建TPS2基因回补菌,命名为TPS2Δ-tps2。在此基础上研究TPS2基因对酵母细胞抗逆性的影响,并得到以下结论:1)通过生长曲线表型实验结果说明,与对照菌BY4741相比,敲除菌TPS2Δ对高温比氧化胁迫和高盐条件更为敏感性,在高温条件下,BY4741与TPS2Δ、TPS2Δ-tps2的生长情况差异表现最为明显;2)胞内ROS水平检测结果说明,TPS2基因敲除增加了细胞胞内ROS水平,而BY4741-TPS2中TPS2基因少量表达降低了胞内ROS水平;3)不同温度下胞内海藻糖含量实验结果表明,不同温度下胞内海藻糖含量出现明显差异,这可能是由于TPS2基因敲除不能够正常合成海藻糖,而BY4741能够正常合成,TPS2Δ-tps2只能少量合成海藻糖;TPS2Δ-tps2因TPS2基因少量表达而在一定程度上弥补胞内海藻糖的不足,在多种胁迫条件下,TPS2Δ-tps2可以改善细胞抗逆性能。总之,TPS2基因的缺失降低了海藻糖的合成,导致细胞对于抗逆环境的适应调节能力减弱。

