天麻活性成分20C对6-羟基多巴胺诱导的PC12细胞损伤及帕金森病模型小鼠的保护作用
杜雨生,张 钊,何 新,3,陈乃宏
(1.天津中医药大学中药学院,天津 301617;2.中国医学科学院北京协和医学院药物研究所,北京 100050;3.广东药科大学中药学院,广东 广州 510006)
帕金森病(Parkinson disease,PD)是以黑质-纹状体系统多巴胺(dopamine,DA)能神经元进行性退变为主要病理特征的神经退行性疾病,临床表现为震颤和肌强直等运动症状以及嗅觉减退和睡眠障碍等非运动症状,尚无理想的治疗方法,给患者及家庭带来沉重的负担[1]。年龄因素是PD患病的重要的危险因素,65岁以上人群PD患病率随年龄的增加而上升[2]。随着我国人口老龄化的到来,PD患者会持续增加,必将对社会造成严重的经济负担。
天麻(Gastrodiae Rhizoma)为我国传统中药,可用于治疗头痛眩晕、惊厥抽搐、手足不遂等病症。在治疗PD的常用中药复方中,天麻常作为复方的核心药物[3]。现代药理实验结果表明,天麻能够改善PD模型动物黑质和纹状体病理损伤及行为学障碍[4]。天麻活性成分20C(简称20C)是天麻中的一种联苄类化合物。本实验室前期研究发现,20C能够改善鱼藤酮诱导的PC12细胞氧化应激损伤,抑制细胞凋亡[5-6],改善衣霉素诱导的PC12细胞内质网应激损伤[7],并可对脂多糖诱导的BV2细胞炎症模型产生抗炎作用[8],显示出很好的神经保护作用。20C能够改善1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)小鼠模型黑质和纹状体的病理损伤及行为异常,减少异常α突触核蛋白的聚集及炎症反应[9]。但20C对PD轴突逆行性损伤是否具有改善作用尚未见报道。6-羟基多巴胺(6-hydroxydopamine,6-OHDA)可通过DA转运体进入DA能神经元,在胞质中引起细胞氧化应激损伤[10]。本研究应用6-OHDA诱导PC12细胞氧化损伤,并采用小鼠单侧纹状体脑立体定位注射6-OHDA的方法制备小鼠PD模型,分别检测20C对PC12细胞氧化损伤和PD模型小鼠的保护作用。
1 材料与方法
1.1 药物、试剂和仪器
20C(化学结构见图1)由中国医学科学院药物研究所植化室合成,纯度98%,溶于二甲亚砜,母液浓度为 10 μmol·L-1;左旋多巴(levodopa,L-dopa)片(每片0.25 g,批号161201),北京曙光药业有限责任公司;RPMI Medium 1640培养基,美国Gibco公司;6-OHDA(162957-50 MG)、抗坏血酸(A4544-25G)、二甲亚砜、MTT和小鼠抗合成β肌动蛋白N端肽单克隆抗体(F3022)均购自美国Sigma公司;牛血清白蛋白,瑞士Roche公司;小鼠抗人源酪氨酸羟化酶(tyrosine hydroxylase,TH)单克隆抗体(sc-25269),美国Santa Cruz公司;小鼠抗8-羟基鸟苷-牛血清白蛋白-酪蛋白偶联物单克隆抗体(ab62623),美国Abcam公司;辣根过氧化物酶标记山羊抗小鼠IgG抗体(二抗),美国KPL公司;DAB显色剂,北京中杉金桥生物技术有限公司;BCA蛋白定量试剂和ECL发光液,北京普利莱基因技术有限公司;Hoechst 33342,日本DojinDo Labo⁃ratories公司;绿色荧光标记驴抗小鼠IgG抗体(二抗),美国Life Technologies公司。
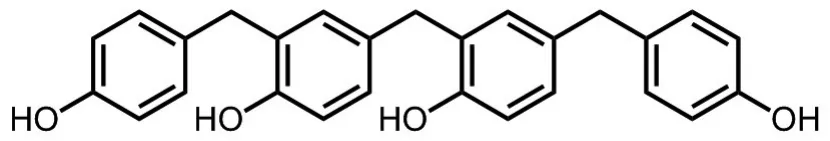
Fig.1 Chemical structure of 20C
超纯水仪(型号Direct Q-8),美国Millipore公司;超低温保存箱(型号DW-86L388A),中国Haier公司;电子天平(型号ME104),瑞士Mettmer Toledo公司;冷冻离心机(型号2-16PK),美国Sigma公司;酶标仪(型号1510),美国Thermo Fisher Sci⁃entific公司;显微镜(型号BX51),日本Olympus公司;激光共聚焦显微镜(型号LSM 710),德国Zeiss公司;倒置相差显微镜(型号Eclipse Ti-U),日本Nikon公司;脑立体定位仪(型号SA301),中国瑞沃德生命科技有限公司;冰冻切片机(型号CM3050S),德国Leica公司;化学发光成像分析仪(型号LAS 4000),美国GE公司;透射电子显微镜(型号H-7650),日本Hitachi公司。
1.2 细胞实验
1.2.1 细胞培养
大鼠肾上腺嗜铬细胞瘤(PC12细胞),购自美国Type Culture Collection公司。PC12细胞使用含5%胎牛血清和10%马血清的1640培养基,在37℃,5% CO2的恒温培养箱中培养,每3 d传代1次。
1.2.2 MTT法检测PC12细胞存活率
PC12细胞以1.5×108L-1的密度接种于96孔板,每孔100 μL,24 h后单独加入6-OHDA 100 μmol·L-1(模型组)或同时加入 6-OHDA 100 μmol·L-1和20C(0.01,0.10 或1.00 μmol·L-1,模型+20C 组),孵育6 h后小心吸去培养基,每孔加入新鲜培养基100 μL,同时每孔加入5 g·L-1的MTT 10 μL,置细胞培养箱,4 h后,每孔加三联液(十二烷基磺酸钠0.1 kg·L-1,HCl 0.01 mol·L-1,5% 异丙醇)100 μL,置细胞培养箱,次日,在酶标仪570 nm波长下检测吸光度值(A570nm)。重复实验3次,每组每次设置3个复孔。存活率(%)=各组平均吸光度值/细胞对照组平均吸光度。
1.2.3 免疫荧光染色检测细胞DNA和RNA氧化损伤
将圆形玻璃盖玻片放入24孔板中,每孔加入PC12细胞悬液500 μL,细胞密度1.5×108L-1;培养24 h后加6-OHDA 100 μmol·L-1(模型组),或同时给予 6-OHDA 100 μmol·L-1和 20C 1.00 μmol·L-1(模型+20C组)每组3复孔,孵育6 h后弃去培养基,PBS清洗;4%多聚甲醛固定15 min,PBS清洗;0.5%曲拉通X-100透化7 min,PBS清洗;5%牛血清白蛋白溶液室温封闭30 min;小鼠抗8-羟基鸟苷-牛血清白蛋白-酪蛋白偶联物单克隆抗体(1∶200)4℃孵育过夜,PBS清洗;用荧光素标记绿色荧光标记驴抗小鼠 IgG抗体(二抗)孵育2 h,Hoechst 33342染细胞核,PBS清洗后封片。使用激光共聚焦显微镜获得荧光图片,Image-Pro Plus 6.0软件计算平均荧光强度,反映细胞DNA和RNA氧化损伤程度。
1.3 动物实验
1.3.1 动物
SPF级雄性C57BL/6小鼠,体重24~26 g,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2016-0002。动物饲养于12 h:12 h昼夜交替空调房内,室温23~25℃,湿度50%~60%,自由进食饮水,动物适应1周后开始实验。所有实验遵循中国医学科学院药物研究所实验动物管理与动物福利伦理委员会规定(编号:00005246)。
1.3.2 小鼠单侧纹状体双位点脑立体定位注射
脑定位注射参考Cheng等[11]的方法,注射位点的确定参考小鼠脑立体定位图谱[12]。小鼠麻醉后固定于脑立体定位仪上,6-OHDA溶液浓度为3 g·L-1(使用0.02%抗坏血酸生理盐水溶解),左侧纹状体注射位点1:前囟前1.0 mm,中线左旁开2.1 mm,硬膜下2.9 mm;注射位点2:前囟后0.3 mm,中线左,旁开2.3 mm,硬膜下2.9 mm。每位点注射2 μL,注射速度为0.5 μL·min-1,留针4 min。
1.3.3 实验分组和给药
小鼠脑定位注射后休息3周,第4周开始分组给药。小鼠分为正常对照组(按照1.3.2方法注射等体积生理盐水)、模型组(按照1.3.2方法注射6-OHDA造模)、模型+L-dopa组(造模后第4周开始ig给予L-dopa 40 mg·kg-1)和模型+20C组(造模后第4周开始ig给予20C 100 mg·kg-1[9]),每组8只。L-dopa和20C均以0.5%羧甲纤维素钠配制成均一混悬液,给药容积为0.01 mL·g-1;正常对照组和模型组ig给予同体积溶剂。每天相同时间给药1次,连续给药4周。
1.3.4 免疫组化染色法观察纹状体和黑质区TH表达
小鼠分组给药(同1.3.3)后麻醉,灌流,取脑,在冰冻切片机上将纹状体和黑质部位切取厚度为20 μm的组织切片。使用枸橼酸盐缓冲液对纹状体和黑质组织冰冻切片进行高温抗原修复10 min,冷却至室温,PBS清洗3次;0.5%曲拉通X-100透化15 min,PBS清洗3次;3% H2O2灭活内源性过氧化物酶10 min,PBS清洗3次;5%牛血清白蛋白溶液室温封闭30 min,加抗TH抗体(1∶500)4℃孵育过夜;含0.1%吐温20的PBS(PBS-T)溶液清洗3次;辣根过氧化物酶标记的山羊抗小鼠IgG(二抗)(稀释比例1∶400)室温孵育2 h,PBS-T溶液清洗3次;DAB显色,自来水终止显色,梯度脱水、中性树脂封片。使用Olympus BX51显微照相系统拍照。
1.3.5 Western印迹法检测黑质TH蛋白表达水平
取分组给药(同1.3.3)后的小鼠注射侧的黑质组织,称重,组织匀浆机匀浆,组织裂解液冰浴裂解30 min,冷冻离心机4℃,12 000×g离心30 min,吸取上清液,用BCA法进行蛋白质定量。剩余上清液中加入上样缓冲液,100℃水浴变性10 min,-20℃保存。10% SDS-聚丙烯酰氨凝胶电泳分离,之后蛋白转移到聚偏二氟乙烯膜,用3%牛血清白蛋白溶液室温封闭2 h,加入一抗〔TH(1∶500)、β-肌动蛋白(1∶5000)〕,4℃孵育过夜。用TBS-T溶液洗涤3次,每次10 min;加辣根过氧化物酶标记的山羊抗小鼠IgG(二抗)(1∶5000)室温孵育2 h,TBS-T溶液洗涤3次,每次10 min;化学发光成像分析仪显示蛋白条带;Image J软件分析蛋白条带积分吸光度值。
1.3.6 透射电镜检测黑质区神经元超微结构损伤
小鼠分组给药(同1.3.3)后麻醉,灌流,取脑,在黑质部位切取1 mm3立方体,用2.5%戊二醛固定2 h;用PBS溶液洗涤,1%四氧化锇浸泡2 h;多次水洗后,在乙醇梯度下脱水,嵌入Epon树脂中;切成半薄切片,美蓝-天青染色,在光学显微镜下选取电镜所要观察的位置,并将其切成50~60 nm的超薄切片;超薄切片经乙酸铀酰和柠檬酸铅双重染色,透射电镜观察黑质区神经元超微结构损伤。
1.4 统计学分析
2 结果
2.1 20C对6-OHDA处理的PC12细胞存活率的影响
MTT法检测结果(表1)显示,与细胞对照组比较,模型组细胞存活率显著下降(P<0.01);模型+20C 0.10 和 1.00 μmol·L-1组细胞存活率显著高于模型组(P<0.05,P<0.01)。
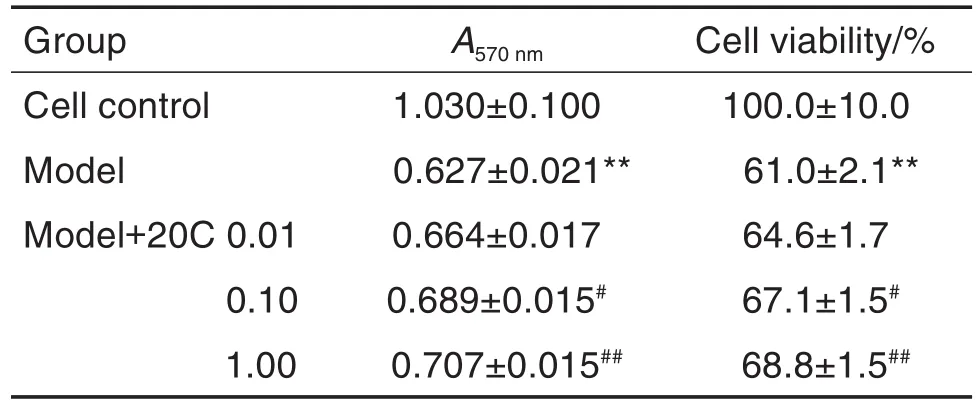
Tab.1 Effect of 20C,an active ingredient of Gastrodiae Rhizoma,on cell viability of PC12 cells treated with 6-hydroxydopamine(6-OHDA)by MTT assay
2.2 20C对6-OHDA处理的PC12细胞DNA和RNA氧化损伤的影响
细胞免疫荧光结果(图2)显示,PC12细胞6-OHDA造模6 h后,模型组细胞平均荧光强度显著高于细胞对照组(P<0.01),提示细胞DNA和RNA氧化损伤明显;与模型组比较,模型+20C 1.00 μmol·L-1组细胞平均荧光强度显著降低(P<0.05),提示细胞DNA和RNA氧化损伤明显缓解。
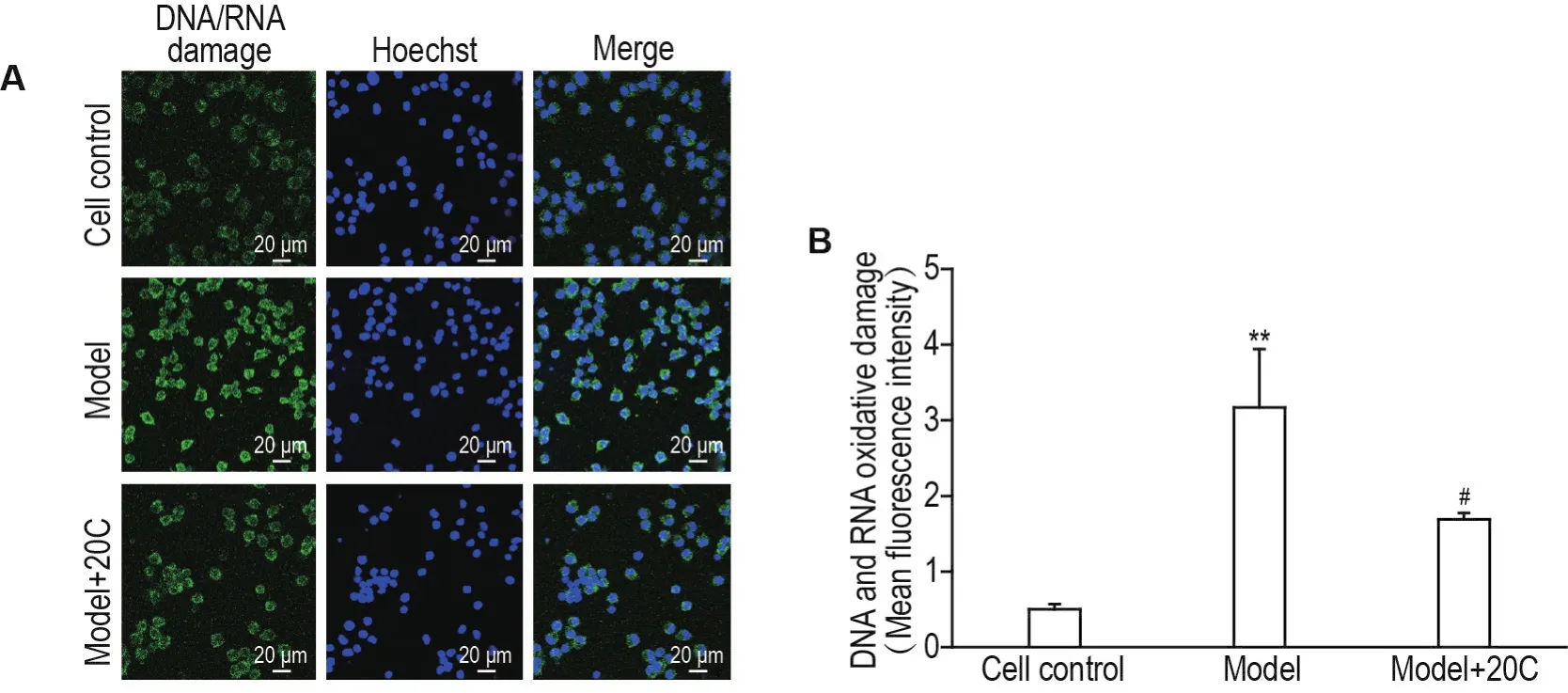
Fig.2 Effect of 20C on DNA and RNA oxidative damage of PC12 cells treated with 6-OHDA by immunofluorescence assay.PC12 cells were exposed to 6-OHDA 100 μmol·L-1and simultaneously given 20C 1.00 μmol·L-1for 6 h.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with cell control group;#P<0.05,compared with model group.
2.3 20C对6-OHDA诱导的PD模型小鼠黑质和纹状体TH表达的影响
免疫组化染色结果(图3)显示,TH阳性表达区域呈棕色。模型组小鼠注射侧黑质和纹状体TH阳性区域减少;而模型+20C组和模型+L-dopa组TH阳性区域增加,提示20C能够缓解6-OHDA引起的小鼠黑质和纹状体病理损伤。
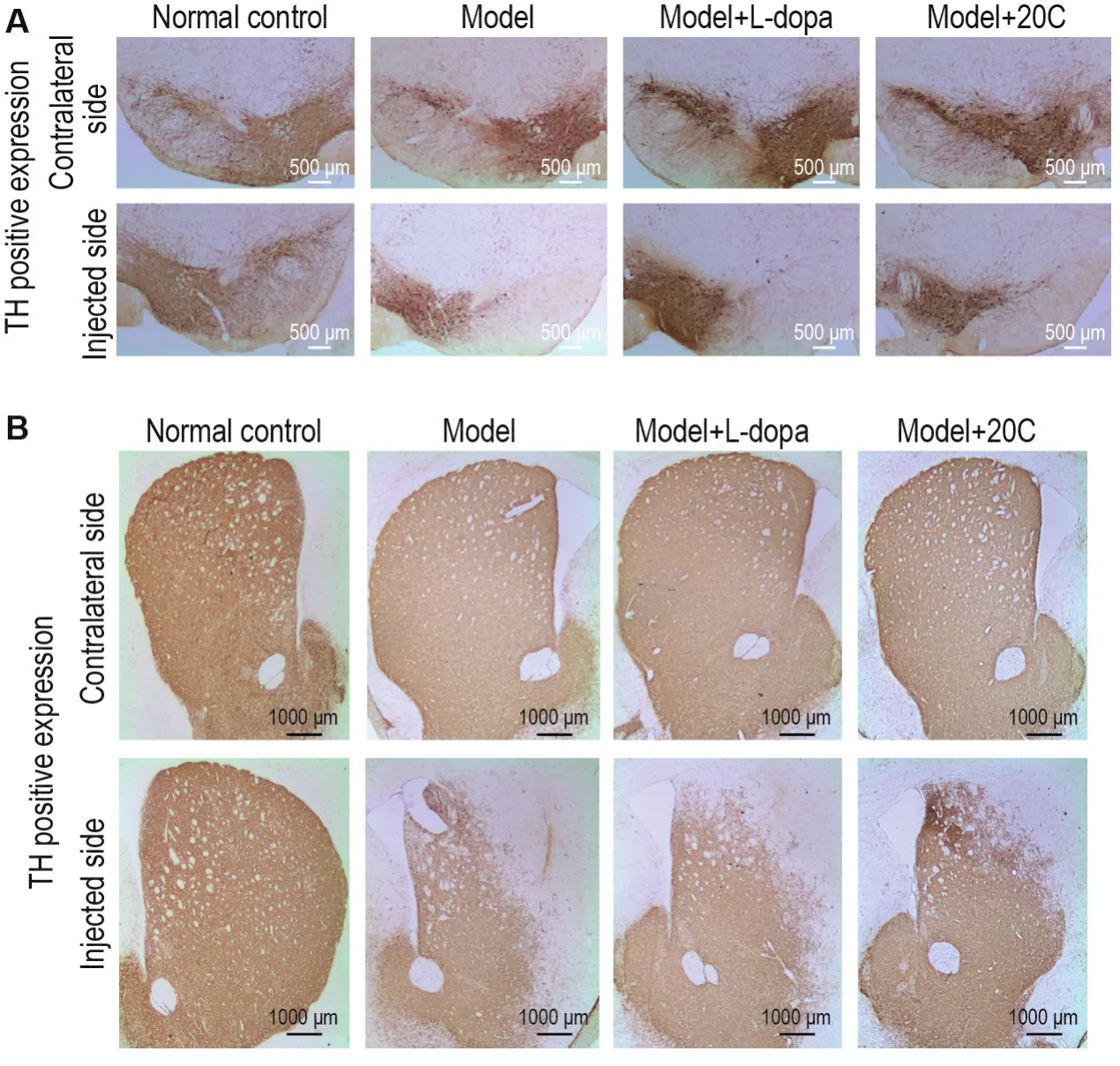
Fig.3 Effect of 20C on tyrosine hydroxylase(TH)positive expresion of substantia nigra(A)and striatum(B)in 6-OHDA-induced Parkinson disease(PD)model mice by immunohistochemical staining.Mice were divided into normal control,model,model+levodopa(L-dopa,40 mg·kg-1)and model+20C(100 mg·kg-1)groups.Mice were double site injected with 6-OHDA into the unilateral striatum to establish the PD model,except for those in normal control group.Three weeks later,L-dopa and 20C groups were ig given once per day for 4 weeks.
2.4 20C对6-OHDA引起的PD模型小鼠黑质多巴胺能神经元逆行损伤的影响
Western印迹结果(图4)显示,模型组小鼠黑质区TH蛋白表达水平较正常对照组显著减少(P<0.01);与模型组相比,模型+20C组TH蛋白表达显著增加(P<0.05),而模型+L-dopa组无明显变化;与模型+L-dopa组相比,模型+20C组小鼠黑质区TH蛋白表达显著增加(P<0.05)。提示20C能够缓解6-OHDA引起的小鼠黑质区TH阳性神经元的逆行损伤。
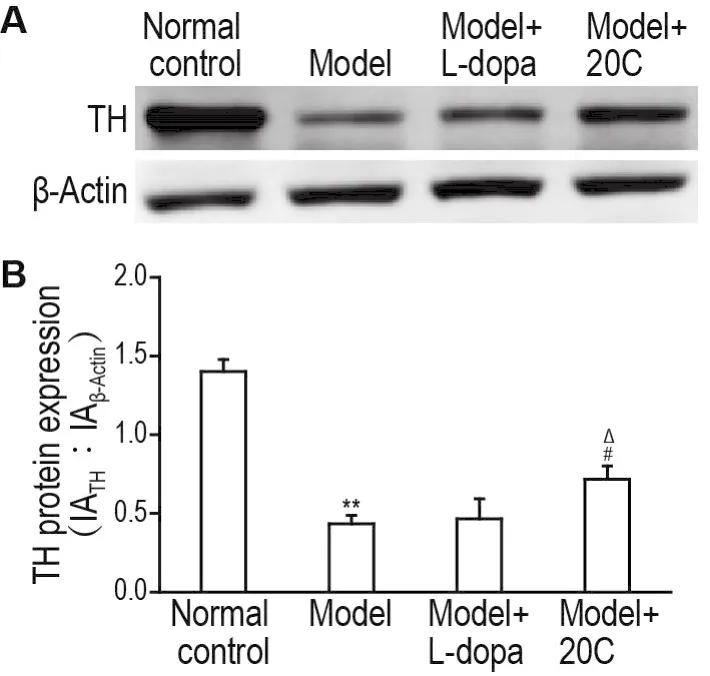
Fig.4Effect of 20C on TH expresion of substantia nigra in 6-OHDA-induced PD model mice by Western blotting.See Fig.2 for the mouse treatment.B was the semiquantitative result of A.IA:integrated absorbance.±s,n=3.**P<0.01,compared with normal control group;#P<0.05,compared with model group;ΔP<0.05,compared with model+L-dopa group.
2.5 20C对6-OHDA引起的PD模型小鼠黑质区神经元超微结构损伤的影响
透射电镜结果(图5)显示,模型组小鼠黑质区神经元核膜皱缩,电子密度较高,细胞周围肿胀;而模型+L-dopa组和模型+20C组小鼠黑质区神经元核膜较完整,电子密度变化和细胞周围肿胀均不明显,提示20C能够改善6-OHDA模型小鼠黑质区神经元超微结构的损伤。
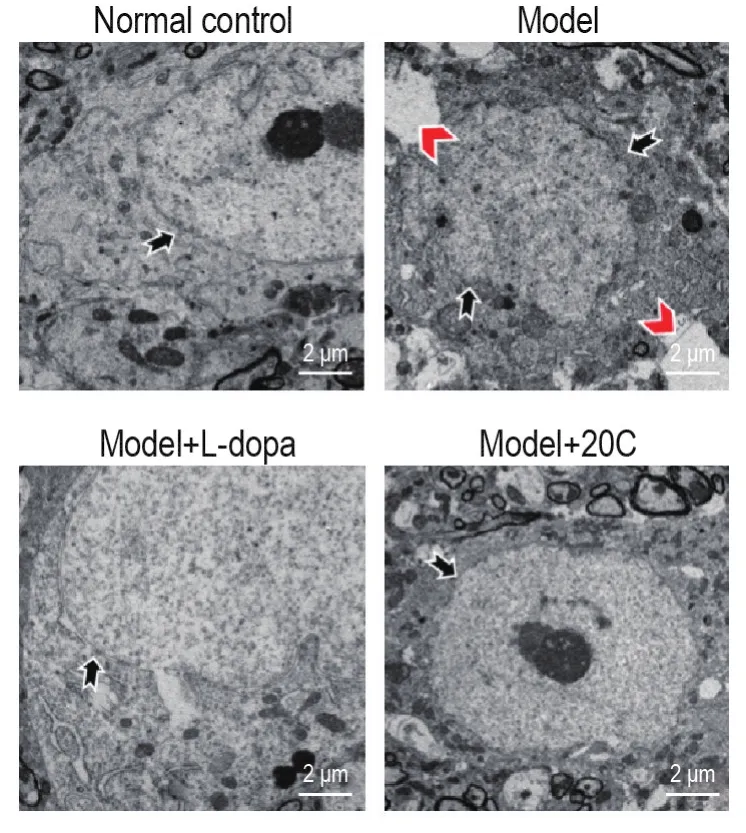
Fig.5 Effect of 20C on neuron ultrastructural damage of substantia nigra in 6-OHDA-induced PD model mice by transmission electron microscopy.See Fig.3 for the mouse treatment.The nuclear membrane(black arrows)of neurons of model mice appeared shrunken and incomplete,and the surround⁃ing cells were swollen(red arrows).
3 讨论
氧化应激被认为与PD发生发展有密切关系[13]。研究发现,DA在胞内蓄积后会进一步氧化产生毒性产物,对神经元造成损害是PD患者DA能神经元产生氧化应激损伤的最主要原因[14],并且DA氧化后的毒性产物中存在6-OHDA。本研究通过6-OHDA诱导的PC12细胞模型发现,与模型对照组比较,20C能够提高PC12细胞的存活率,缓解PC12细胞氧化应激损伤,初步验证了20C对6-OHDA诱导的PC12细胞具有保护作用。
本研究通过单侧纹状体注射6-OHDA建立PD小鼠模型,模拟临床PD患者病理进程中由纹状体DA能神经末梢向黑质DA能神经元胞体的逆行性损伤过程,反映PD患者临床病理改变进程[10]。TH为DA合成的限速酶,是检测DA能神经元损伤的标志物。小鼠纹状体损伤检测结果表明,PD模型小鼠纹状体明显损伤,TH阳性面积缩小;20C能阻止纹状体TH阳性面积的减少,改善纹状体损伤。小鼠黑质损伤检测结果表明,PD模型小鼠黑质表现出明显的逆行性损伤,TH阳性神经元丢失;20C能减少黑质区TH阳性神经元的丢失,提高TH蛋白表达水平。以上结果表明,20C对黑质-纹状体系统DA能神经元逆行性损伤具有改善作用。此外,通过观察黑质区神经元超微结构发现,PD模型小鼠部分黑质神经元结构严重受损,而20C可使黑质区结构受损的神经元数量减少,改善6-OHDA导致的黑质神经元超微结构损伤。
综上所述,20C能够降低6-OHDA诱导的PC12细胞死亡率及氧化损伤,并改善6-OHDA诱导的PD模型小鼠黑质和纹状体的病理损伤,其深入机制有待进一步研究。

