四君子汤改善吲哚美辛所致大鼠小肠黏膜损伤及其可能的作用机制
梁欣仪,王东旭,李茹柳,朱易平,时玉霞,胡 玲,陈蔚文
(广州中医药大学科技创新中心、脾胃研究所,广东 广州 510405)
脾虚证是多种胃肠病变的主要中医证型之一,脾虚患者可见胃黏膜损伤[1]和小肠黏膜损伤[2]。临床研究表明,益气健脾中药对胃和小肠黏膜病变有治疗作用[3-4],但作用机制尚未阐明。四君子汤源于宋代《太平惠民和剂局方》:“治荣卫气虚,脏腑怯弱,心腹胀满,全不思食,肠鸣泄泻,呕噎吐逆,大宜服之”,是益气健脾的代表方,临床协助治疗克罗恩病及溃疡性结肠炎等有良好疗效。小肠吸收功能障碍的脾虚患儿服用健脾粉(四君子汤加黄芪),脾虚症状可基本消失;木糖吸收率较低的脾虚患儿经此治疗后,临床症状和木糖吸收率亦有改善[5]。临床运用四君子汤加黄芪为基础方加减协助治疗克罗恩病能有效缓解症状并改善生存质量[4]。本课题组前期研究结果表明,四君子汤多糖(Sijunzi decoction polysaccharides,SJZDP)可作用于多胺及其调控的上皮细胞迁移和细胞连接等环节而起到胃肠黏膜保护作用,其中促进细胞迁移的作用与其影响多胺信号通路有关[6-7]。本研究以非甾体类抗炎药物吲哚美辛制备大鼠小肠黏膜损伤模型,观察四君子汤水提物(Sijunzi decoction aqueous extract,SJZDA)和SJZDP对小肠黏膜损伤的改善作用,并基于多胺及其调控机制探讨其作用机制及其药效物质基础。
1 材料与方法
1.1 动物、药物、试剂和主要仪器
SD大鼠,SPF级,雄性,体重180~220 g,广州中医药大学动物实验中心;实验动物质量合格许可证:SCXK(粤)2018-0034;饲养及实验于SPF级动物实验环境,广东省动物实验单位使用许可证:SYXK(粤)2018-0001。动物实验通过广州中医药大学动物实验伦理检查委员会审核(批准号:2016084)。
五加科植物人参(PanaxginsengC.A.Mey.)的干燥根、菊科植物白术(Atractylodesmacro⁃cephalaKoidz.)的干燥根(炒制)成、多孔菌科真菌茯苓〔Poriacocos(Schw.)Wolf.〕的干燥菌核和豆科植物乌拉尔甘草(GlycyrrhizauralensisFisch.)的根(蜜炙),均购于广州同康药业有限公司,由广州中医药大学中药鉴定教研室童家赟副教授鉴定。
D-无水葡萄糖标准品(中国食品药品检定研究院);色谱级甲醇和乙腈(德国Merck KGaA公司);BCA蛋白定量试剂盒(中国KeyGEN BioTECH公司);SDS-PAGE凝胶试剂盒(中国Beyotime公司)、鼠链霉卵白素-生物素法免疫组化试剂盒(SP-9001)、兔链霉卵白素-生物素法免疫组化试剂盒(SP-9002)和DAB试剂盒(北京中杉金桥公司);吲哚美辛、腐胺、精胺和精脒(美国Sigma公司);D-乳酸检测试剂盒(美国ATT Bioquest公司);Ca2+定量分析试剂盒(C045FC,加拿大HCB公司);小鼠抗大鼠E钙黏蛋白(ab231303)、β连环蛋白(ab32572)、α连环蛋白(ab51032)和GAPDH单克隆抗体(ab181602)(英国Abcam公司)(一抗);兔抗大鼠闭合蛋白(40-4700)、闭锁小带蛋白(61-7300)和封闭蛋白3多克隆抗体(PA5-16867)(美国Invitrogen公司)(一抗);生物素标记山羊抗兔IgG抗体和生物素标记山羊抗小鼠IgG抗体(二抗)(北京中杉金桥公司)。
UVmini-1240紫外分光光度计和AUW120D型分析天平(日本岛津公司);E2695高效液相色谱(HPLC)仪和2414示差折光检测器(美国Waters公司);1200型高效液相色谱仪(美国安捷伦公司);3300 ELSD蒸发光检测器(美国Alltech公司);Waters Ultrahydrogel Linear Column色谱柱(7.8 mm×300 mm,美国Waters公司);Hypersil ODS2色谱柱(5 μm,4.6 mm×250 mm,日本 Ecosil公司);iMark酶标仪(美国Bio-Rad公司);IX73型荧光显微镜(日本奥林巴斯公司);DNA Expert型多用途微量板检测仪(奥地利Tecan公司)。
1.2 SJZDA制备和SJZDP提取、纯化和检测
人参、白术、茯苓和炙甘草各300 g,12倍体积纯水常温浸泡2 h后煎煮2 h,收集滤液;滤渣同法煎煮并收集滤液;合并2次滤液,旋转蒸发仪减压浓缩,冷冻干燥,得SJZDA冻干粉425.0 g(得率35.4%)。
按上述步骤得1150 mL滤液,加4倍体积95%乙醇使之含醇为75%,4℃静置过夜,布式漏斗抽滤,取沉淀加适量纯水溶解;重复醇沉操作3次,末次沉淀加纯水溶解,8400×g离心15 min,弃沉淀,得水提醇沉液3100 mL。取上液加1/3体积Severge去除蛋白,分液漏斗振荡20 min,静置8 h至分层,取水层。重复操作5次,末次水层5000×g离心10 min,取上清水层,旋转蒸发仪减压浓缩至400 mL,冷冻干燥得SJZDP冻干粉83.1 g(得率7.2%)。苯酚-硫酸法测定其多糖含量(以葡萄糖计)。
HPLC法检测SJZDP多糖图谱。SJZDP多糖样品以超纯水配成1.0 g·L-1,0.45 μm水系滤膜过滤,加入样品瓶待测。色谱条件:Waters 2695色谱系统;2414示差折光检测器(RID);色谱柱:Waters色谱柱;检测器灵敏度:4;流动相:超纯水;流速:0.6 mL·min-1;检测器温度:30℃;柱温:30℃;进样量:20 μL。
1.3 动物分组和给药
SD雄性大鼠适应性喂养1周后按体重随机分组,分为正常对照组(n=8)、模型对照组(n=16)、模型+SJZDA 5和15 g·kg-1组(n=12)及模型+SJZDP 0.358和1.074 g·kg-1组(n=12)。SJZDP 0.358和1.074 g分别相当于SJZDA 5和15 g。大鼠造模前1 h,模型+SJZDA和模型+SJZDP组按10 mL·kg-1ig给予相应剂量SJZDA和SJZDP,正常对照组和模型对照组给予等体积纯水;1 h后除正常对照组外,各组大鼠均按10 mL·kg-1皮下注射吲哚美辛6 mg·kg-1;SJZDA、SJZDP和吲哚美辛均每天1次,共6 d。末次给药后,大鼠禁食不禁水24 h,ip给予10%水合氯醛麻醉,取腹主动脉血置肝素钠抗凝离心管,5500×g离心15 min,取上清,-80℃保存;摘除小肠并剪开,冰生理盐水冲洗,观察小肠黏膜大体损伤,拍照并评分;沿幽门向下约20 cm取损伤较明显的小肠约10 cm,在黏膜损伤明显处取2~3 cm小肠置4%多聚甲醛固定,常规石蜡包埋切片,HE染色,显微镜下进行组织病理学评分。余小肠冰上用载玻片刮取黏膜,冻存管收集,先置于液氮,取材结束后移至-80℃保存。
1.4 小肠黏膜损伤大体评分[8]和组织病理评分[9]
按溃疡和黏连分别评分,总分为两者之和。溃疡大体评分标准:0分,未出现明显损伤;1分,局部充血、水肿但未出现溃疡;2分,有溃疡,但不伴黏膜明显充血、水肿等炎症表现和肠壁增厚;3分,一处黏膜有溃疡伴炎症,溃疡<1 cm;4分,有多处溃疡伴炎症,溃疡<1 cm;5分,有多处溃疡伴炎症,至少一处溃疡>1 cm;若溃疡和(或)炎症>2 cm,病变范围每增加1 cm,计分加1分。黏连评分标准:0分,无黏连;1分,黏连较轻,少许力量可将小肠与其他组织分开;2分,黏连较重。
显微镜下观察小肠组织病理变化。0分:肠黏膜绒毛正常;1分:绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血;2分:上皮下间隙扩大,中度固有层水肿,中央乳糜管扩张;3分:固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落;4分:上皮细胞层变性坏死、脱落,部分绒毛脱落、固有层裸露,毛细血管扩张、充血;5分:绒毛脱落,固有层崩解,出血或溃疡形成。
1.5 柱前衍生HPLC法检测小肠黏膜多胺含量[10]
多胺对照品配制:称取腐胺0.041 g、精脒0.0255 g和精胺0.0238 g,分别加入色谱甲醇溶解,定容于50 mL,得腐胺、精脒和精胺分别为9.3×10-3,3.51×10-3和2.35×10-3mol·L-1的单一对照品溶液;再各取1 mL分别加色谱甲醇定容于100 mL,得腐胺、精脒和精胺分别为9.3×10-5,3.51×10-5和2.35×10-5mol·L-1的对照品。
BCA法检测黏膜组织蛋白质含量:称取待测小肠黏膜组织,加入RIPA裂解液和PMSF冰上匀浆,冰上放置30 min,4℃,12 000×g离心15 min,取上清液;设3复孔,酶标仪波长570 nm,绘制标准曲线并计算黏膜组织蛋白质含量。蛋白质含量(mg·g-1组织)=(黏膜组织匀浆蛋白质浓度×对应裂解液体积)/黏膜组织质量。
小肠黏膜组织多胺含量测定:称取约0.2 g小肠黏膜组织,加5%冷高氯酸1.5 mL,3000×g离心10 min,吸取上清液和多胺对照液各1 mL,分别加入2 mol·L-1NaOH 1 mL和苯甲酰氯8 μL,涡旋混匀,静置20 min;加入饱和NaCl和氯仿各2 mL,涡旋1 min,3000×g离心10 min;吸取下层有机相1.5 mL,氮气吹干,残渣置10 mL EP管以0.5 mL流动相〔甲醇:水=55:45(V/V)〕溶解;50℃水浴8 h,所得溶液加入NaOH 2 mol·L-1和氯仿各2 mL,涡旋混匀1 min;3000×g离心10 min,吸取1.5 mL下层有机相,氮气吹干;残渣以0.5 mL流动相溶解,0.22 μm有机系滤膜过滤,加入样品瓶。色谱条件:Hypersil ODS2 色谱柱;柱温 25℃;流速 1 mL·min-1;波长234 nm;流动相:甲醇:水=55∶45(V/V)。样品测定:进样40 μL样品,多胺标准品分别进样10,20,30,40,50,60和70 μL,绘制峰面积-多胺质量标准曲线,计算样品多胺含量。多胺(腐胺、精脒或精胺)含量(nmol·g-1蛋白)=多胺的测定质量/(黏膜质量×黏膜组织匀浆蛋白质含量)。
1.6 邻甲酚酞络合酮法检测小肠黏膜组织Ca2+含量
BCA法测定小肠黏膜组织蛋白质含量,按试剂盒说明书操作,用酶标仪于波长450 nm读取吸光度值(A450nm)。设标准品 0 μg·L-1的A450nm值为B0,其余各孔A450nm值为B,结合率(%)=B/B0×100%。以结合率(%)为纵坐标,标准品浓度(μg·L-1)为横坐标绘制标准曲线,计算黏膜组织Ca2+含量(μg·L-1)。
1.7 Amplite荧光法测定血浆D-乳酸浓度
按D-乳酸测定试剂盒说明书操作,运用DNA Expert型多用途微量板检测仪检测。发射波长532 nm,激光波长590 nm,读取吸光度,绘制标准曲线,计算血浆D-乳酸浓度。
1.8 免疫组织化学法检测小肠黏膜组织连接蛋白表达
小肠组织切片60℃加热20 min,常规脱蜡、水化,放入0.01 mol·L-1柠檬酸盐缓冲液,微波炉加热修复抗原,SP法阻断内源性过氧化物酶,封闭后与相应一抗(紧密连接蛋白:闭锁小带蛋白1∶200、闭合蛋白1∶100和封闭蛋白3 1∶100;黏附连接蛋白:E钙黏蛋白1∶100、α连环蛋白1∶100和β连环蛋白1∶500)4℃孵育过夜,37℃复温 45 min;PBS 洗3次,每次5 min;室温与二抗孵育15 min,冲洗后室温与辣根过氧化物酶标记链霉卵白素工作液孵育15 min,PBS洗3次后DAB室温显色10 min,显微镜下控制染色程度。自来水冲洗终止反应;苏木素复染,自来水冲洗;常规脱水,中性树胶封片、镜检。显微镜下见到胞膜和(或)胞浆出现棕黄色为待测蛋白免疫反应阳性。每张切片选5个视野(200×)用Image Pro Plus软件分析棕黄色积分吸光度(integrated absorbance,IA),平均吸光度(IA/目标面积)表示待测蛋白表达水平。
1.9 统计学分析
2 结果
2.1 SJZDP组成和多糖含量
HPLC测定结果(图1)所示,SJZDP主要有5个吸收峰,最大吸收峰(峰4)为较狭窄的对称峰,保留时间16.098 min,峰面积占79.2%,提示其为杂多糖。苯酚-硫酸法测得SJZDP多糖含量为81.6%。
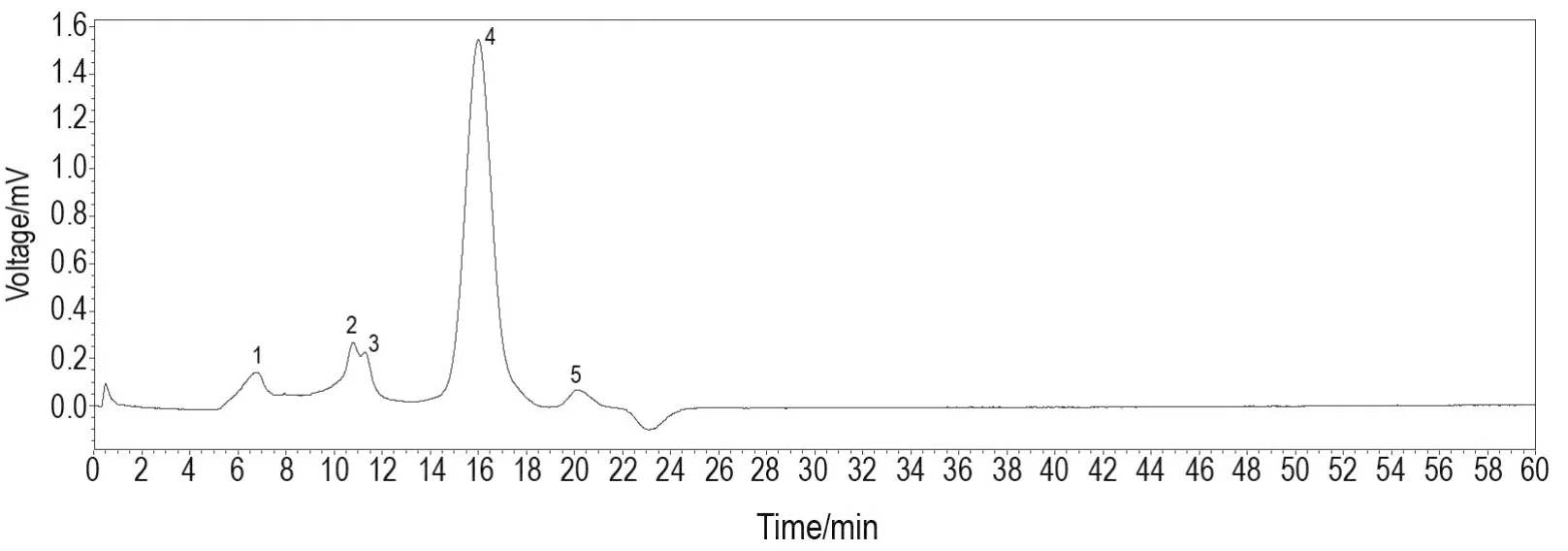
Fig.1 High performance liquid chromatography(HPLC)image of Sijunzi decoction polysaccharides(SJZDP).SJZDP was extracted from Sijunzi decoction aqueous extract(SJZDA)via ethanol precipitation and severge deproteinization.
2.2 SJZDA和SJZDP对吲哚美辛所致大鼠小肠黏膜损伤的改善作用
2.2.1 小肠黏膜损伤大体评分
实验结束时,模型对照组大鼠死亡7只(7/16),模型+SJZDA 5和15 g·kg-1组分别死亡6只(6/12)和3只(3/12),模型+SJZDP 0.358和1.074 g·kg-1组分别死亡4只(4/12)和2只(2/12)。大鼠死亡原因均为小肠穿孔。
各组存活大鼠小肠黏膜损伤大体观察(图2)可见,正常对照组大鼠小肠肠管无黏连,肠黏膜未见明显异常。模型对照组小肠肠管均有不同程度黏连,小肠黏膜充血、糜烂,部分肠段可见多发溃疡灶,大体评分较正常对照组明显增高(P<0.01),提示小肠黏膜损伤模型制备成功。模型+SJZDA 5和15 g·kg-1组小肠肠管黏连,黏膜充血;但前者部分肠段可见溃疡,大体评分与模型对照组比较无显著差异;后者无明显溃疡,大体评分较模型对照组下降(P<0.01)。模型+SJZDP 0.358 和1.074 g·kg-1组小肠肠管有不同程度黏连,黏膜可见充血和水肿;前者部分大鼠小肠可见溃疡形成,损伤评分较模型对照组降低(P<0.05);后者肠壁局部结节样增厚,损伤评分较模型对照组降低更加明显(P<0.01)。
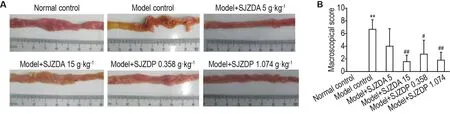
Fig.2 Effect of SJZDA and SJZDP on small intestinal mucosal injuries of rats induced by indomethacin.The rat intestinal mucosal injury model was induced by injecting subcutaneously with indomethacin 6 mg·kg-1,once daily,for 6 d.The rats were ig given SJZDA(5 and 15 g·kg-1)or SJZDP(0.358 and 1.074 g·kg-1)1 h before injection of indomethacin,every day,except those in normal and model control groups.B was the intestinal mucosal injury score of A.±s,n=6-10.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
2.2.2 小肠黏膜组织病理评分
如图3所示,正常对照组大鼠小肠黏膜完整,肠绒毛上皮未见脱落。模型对照组小肠黏膜上皮变性、坏死,绒毛脱落,固有层崩解,溃疡形成。模型+SJZDA 5 g·kg-1组小肠黏膜绒毛面上皮细胞脱落,固有层崩解,组织病理评分与模型对照组比较无统计学差异;模型+SJZDA 15 g·kg-1组仅见小肠黏膜少数绒毛顶端上皮脱落,大部分绒毛面完整,组织病理评分降低(P<0.01)。模型+SJZDP 0.358 g·kg-1组小肠黏膜部分绒毛面上皮细胞脱落,固有层裸露,组织病理评分降低(P<0.05);模型+SJZDP 1.074 g·kg-1组小肠黏膜绒毛面上皮细胞基本完整,仅见个别上皮细胞缺失,组织病理评分下降更为明显(P<0.01)。
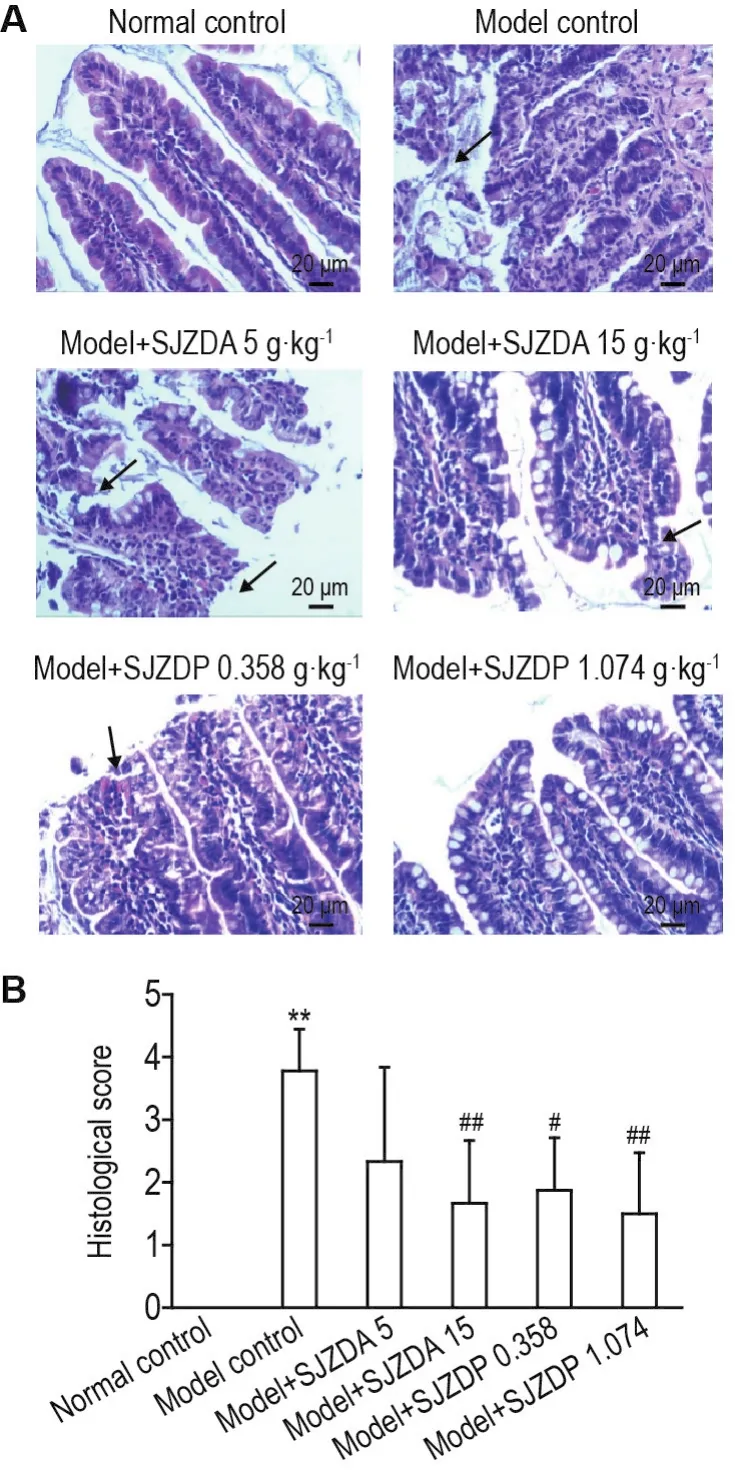
Fig.3 Effect of SJZDA and SJZDP on small intestinal mucosal pathological injuries of rats induced by indomethacin.See Fig.2 for the rat treatment.The arrows show areas of intestinal mucosal injury.B was intestinal mucosal injury path⁃ological scores of A.±s,n=6-10.*P<0.05,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
2.3 SJZDA和SJZDP对小肠黏膜损伤模型大鼠小肠黏膜组织多胺含量的影响
如表1所示,模型对照组大鼠小肠黏膜组织精脒含量较正常对照组降低(P<0.05);与模型对照组比较,模型+SJZDA 15 g·kg-1、模型+SJZDP 0.358和1.074 g·kg-1组小肠黏膜组织精脒含量明显提高(P<0.05,P<0.01)。各组腐胺和精胺含量均无明显变化。
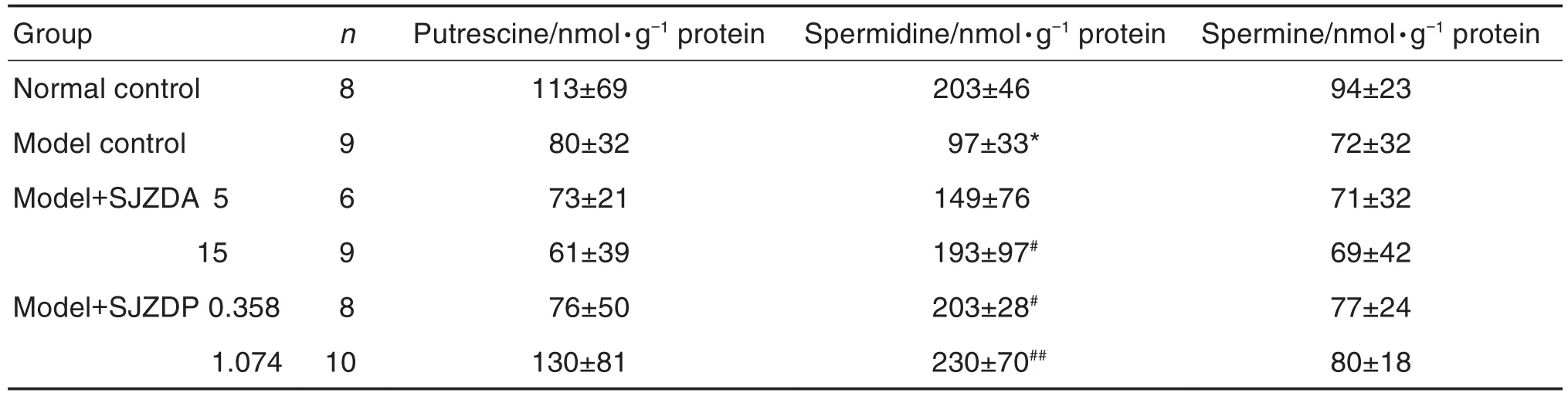
Tab.1 Effect of SJZDA and SJZDP on polyamines of intestinal mucosa tissue of rats with small intestinal mucosal injuries induced by indomethacin
2.4 SJZDA和SJZDP对小肠黏膜损伤模型大鼠小肠黏膜组织Ca2+含量的影响
如图4所示,模型对照组大鼠小肠黏膜组织Ca2+含量较正常对照组无明显变化;与模型对照组比较,模型+SJZDA 15 g·kg-1和模型+SJZDP 1.074 g·kg-1组小肠黏膜组织Ca2+含量明显提高(P<0.05)。
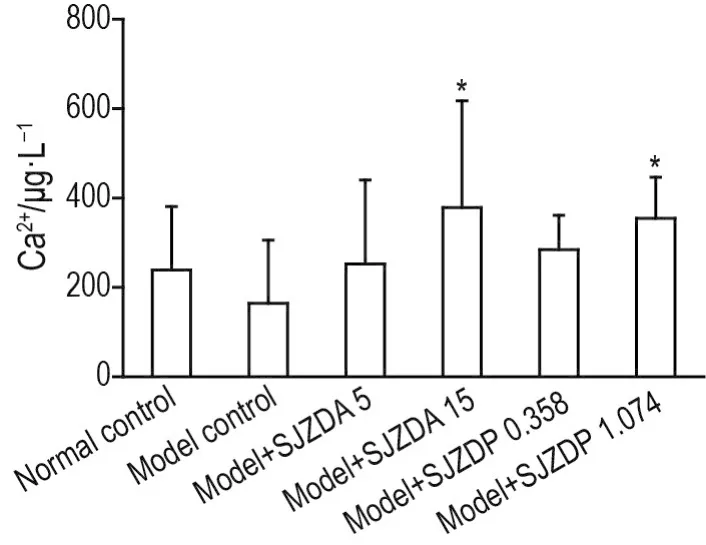
Fig.4 Effect of SJZDA and SJZDP on Ca2+content of intestinal mucosa tissue of rats with small intestinal mucosal injuries induced by indomethacin.See Fig.2 for the rat treatment.Ca2+content was measured with O-cresol⁃phthalein complexone method.±s,n=6-10.*P<0.05,compared with model control group.
2.5 SJZDA和SJZDP对小肠黏膜损伤模型大鼠血浆D-乳酸浓度的影响
如图5所示,模型对照组大鼠血浆D-乳酸浓度较正常对照组升高(P<0.01);与模型对照组比较,模型+SJZDA 15 g·kg-1、模型+SJZDP 0.358 和1.074 g·kg-1组大鼠血浆D-乳酸水平降低(P<0.05,P<0.01)。
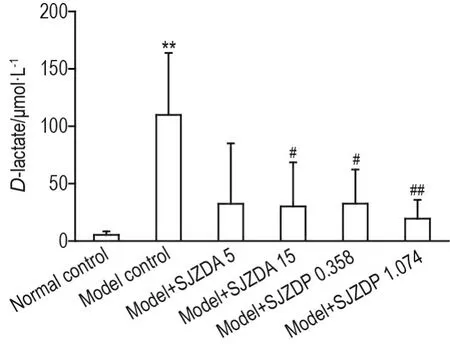
Fig.5 Effect of SJZDA and SJZDP on plasma D-lactate concentration of model rats with small intestinal mucosal injuries induced by indomethacin.See Fig.2 for the rat treatment.The D-lactate concentration in plasma was detected by Amplite fluorescence method.±s,n=6-10.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
2.6 SJZDA和SJZDP对小肠黏膜损伤模型大鼠小肠黏膜组织连接蛋白表达的影响
如图6和图7所示,与正常对照组相比,模型对照组大鼠小肠黏膜组织紧密连接蛋白(闭锁小带蛋白、闭合蛋白、封闭蛋白3)和黏附连接蛋白(E钙黏蛋白和α连环蛋白)表达下降(P<0.01)。与模型对照组比较,模型+SJZDA 5和15 g·kg-1及模型+SJZDP 1.074 g·kg-1组小肠黏膜组织中闭锁小带蛋白表达升高(P<0.01);模型+SJZDP 0.358和1.074 g·kg-1组小肠黏膜组织中闭合蛋白表达升高(P<0.01);模型+SJZDA 15 g·kg-1、模型+SJZDP 0.358和1.074 g·kg-1组小肠黏膜组织中封闭蛋白3、E钙黏蛋白和α连环蛋白表达升高(P<0.01);模型+SJZDA 15 g·kg-1和模型+SJZDP 1.074 g·kg-1组小肠黏膜组织中黏附连接蛋白β连环蛋白表达升高(P<0.05,P<0.01)。
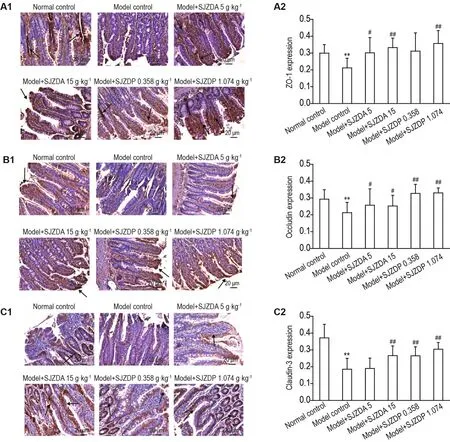
Fig.6 Effect of SJZDA and SJZDP on expression of ZO-1(A),occludin(B)and claudin-3(C)of intestinal mucosa tissue of model rats with small intestinal mucosal injuries induced by indomethacin.See Fig.2 for the rat treatment.The arrows showed positive expressions of the tested proteins.The expression levels of the tested proteins were indicated by mean integrated absorbance.A2,B2 and C2 were the semi-quantitative results of A1,B1 and C1,respectively.±s,n=6-10.*P<0.05,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
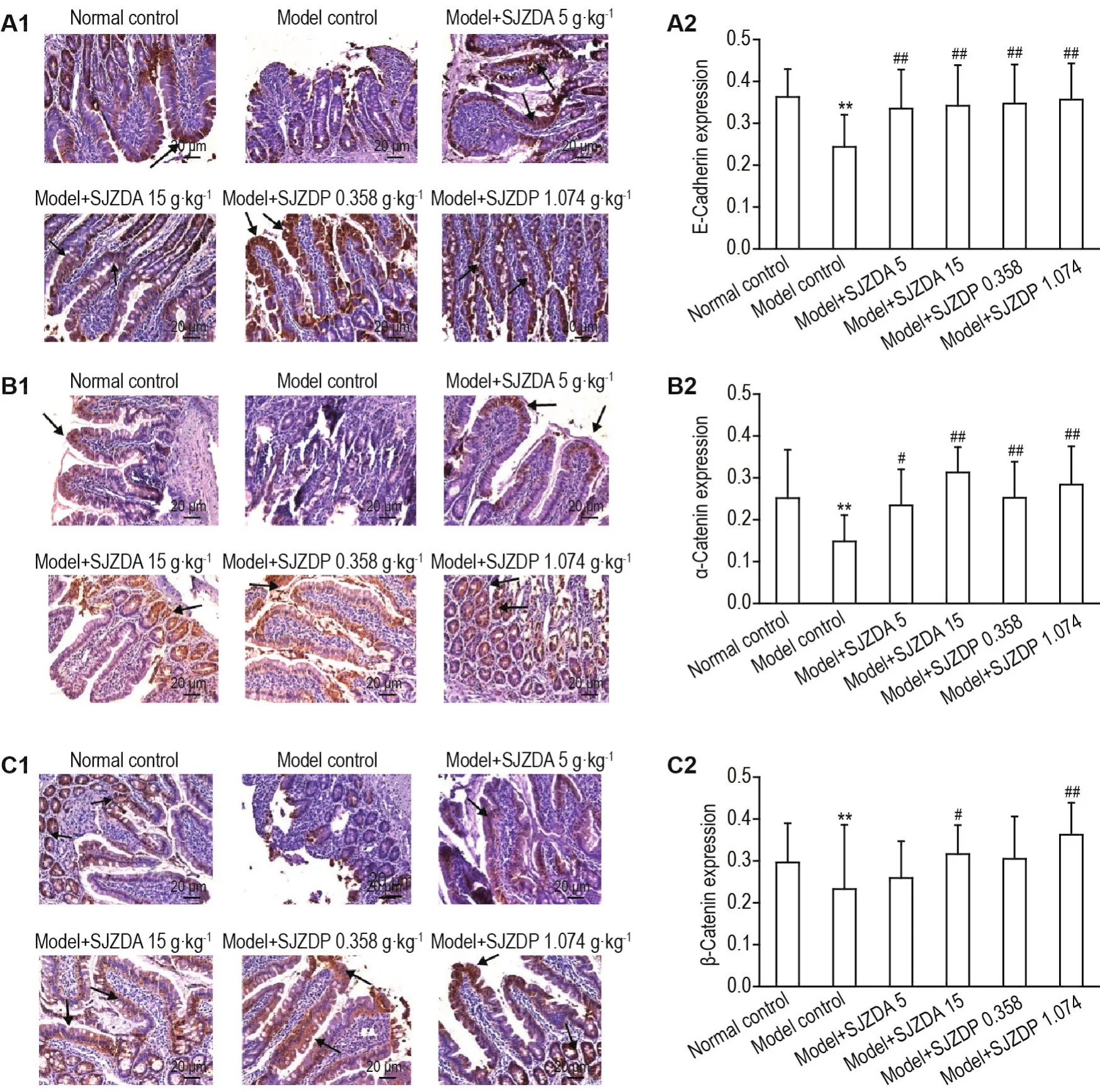
Fig.7 Effect of SJZDA and SJZDP on expressions of E-cadherin(A),α-catenin(B)and β-catenin(C)of intestinal mucosa tissue of rats with small intestinal mucosal injuries induced by indomethacin.See Fig.2 for the rat treatment.The arrows show positive expressions of the tested proteins.A2,B2 and C2 were the semi-quantitative results of A1,B1 and C1,respec⁃tively.±s,n=6-10.*P<0.05,compared with normal control group;#P<0.05,##P<0.01,compared with model control group.
3 讨论
本研究制备吲哚美辛皮下注射诱导小肠黏膜损伤大鼠模型,观察了SJZDA和SJZDP对小肠黏膜损伤的改善作用。研究结果表明,SJZDA 15 g·kg-1、SJZDP 0.358和1.074 g·kg-1可明显减轻模型大鼠小肠肠管黏连、黏膜充血和溃疡等小肠黏膜大体损伤,而且可改善模型大鼠小肠黏膜绒毛面上皮细胞脱落等小肠黏膜组织的病理改变,提示SJZDA和SJZDP对吲哚美辛诱导大鼠小肠黏膜损伤具有改善作用。
紧密连接和黏附连接作为细胞连接的主要元件是肠黏膜上皮屏障的关键构成部分,对维护肠屏障功能起重要作用。功能性消化不良患者十二指肠黏膜紧密连接蛋白明显减少,导致肠黏膜屏障损伤从而引起肠黏膜损伤[12]。以E钙黏蛋白为基础的黏附连接对调节肠上皮稳态过程(如刷状缘的建立、上皮细胞迁移和增殖)有重要作用[13]。多胺对紧密连接和黏附连接的形成和稳定起重要作用,多胺耗竭能降低小肠上皮细胞紧密连接和黏附连接蛋白表达而致上皮屏障异常[14-15]。多胺还对肠黏膜损伤其他修复环节如上皮细胞迁移、增殖及黏膜重建发挥重要作用[16],其中Ca2+调节在多胺介导的信号通路中起关键作用,Ca2+升高可促进小肠上皮细胞迁移及黏膜修复[17]。E钙黏蛋白表达依赖Ca2+,多胺通过提高Ca2+水平而促进E-钙黏蛋白和β连环蛋白表达[18]。
为此,本研究从多胺及其调控机制方面探讨SJZDA和SJZDP改善模型大鼠小肠黏膜损伤的作用机制。研究结果表明,SJZDA和SJZDP可提高模型大鼠小肠黏膜组织多胺(精脒)含量和Ca2+水平,改善肠道通透性(降低血浆D-乳酸水平),并增加小肠黏膜组织紧密连接蛋白(闭锁小带蛋白、闭合蛋白和封闭蛋白3)和黏附连接蛋白(E钙黏蛋白、α连环蛋白和β连环蛋白)的表达。本课题组前期观察了四君子汤对吲哚美辛所致大鼠胃黏膜损伤的影响,研究结果与本研究结果相符[19]。另外,本课题组前期用小肠上皮细胞(IEC-6)研究亦表明,党参、白术、黄芪和甘草提取物(多糖或黄酮或皂苷等)可通过多胺及其调控的上皮细胞增殖、迁移、分化和细胞连接等环节而发挥对肠黏膜的保护作用[20-26]。
多糖是中药发挥药理作用的主要物质基础之一。SJZDP 0.358和1.074 g·kg-1相当于四君子汤复方生药5和15 g·kg-1,对吲哚美辛导致的小肠黏膜损伤均有改善作用,进一步表明SJZDP为四君子汤发挥小肠黏膜损伤改善作用的有效组分。
综上提示,多胺及其调控的信号通路可能是SJZDA和SJZDP改善小肠黏膜损伤的作用靶点之一,SJZDP是四君子汤发挥该作用的主要物质基础之一。本研究为探讨四君子汤胃肠黏膜保护作用及其机制提供了参考,为临床选择益气健脾复方用于防治非甾体类抗炎药物所致小肠黏膜损伤提供了实验依据。

