有机磷化合物的胆碱酯酶动力学研究进展
李克新,刘艳芹,刘玉龙,郭 磊,谢剑炜
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
包括军用制式神经性毒剂(nerve agents,NA;又称有机膦神经性毒剂)和有机磷农药在内的有机磷化合物(organophosphorus compounds,OP)是一类典型的强胆碱酯酶抑制剂[1],其按照骨架结构可划分为13类(图1),包括磷酸盐、膦酸盐、次膦酸盐、硫逐磷酸酯、硫逐膦酸酯、硫赶磷酸酯、硫赶膦酸酯、二硫代磷酸酯、三硫代磷酸酯、氨基磷酸酯、硫代氨基磷酸酯、氟磷酸酯和氟膦酸酯[2]。事实上,NA的研发肇始于二战期间德国对杀虫剂的开发,曾用于局部军事冲突或恐怖袭击,对人员健康造成了严重威胁。
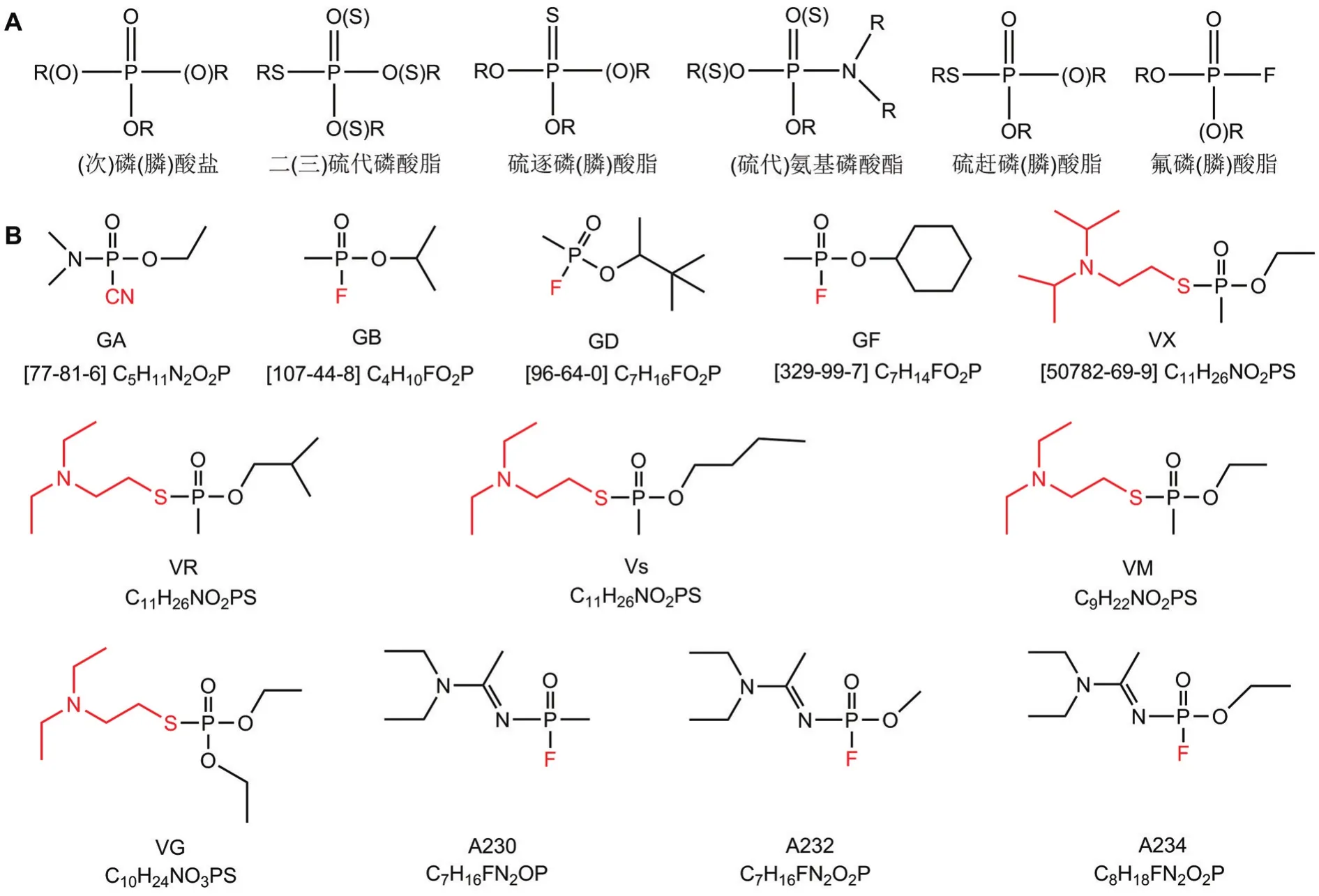
图1 有机磷化合物(OP)骨架结构(A)与神经性毒剂(NA)结构式(B).GA:塔崩;GB:沙林;GD:梭曼;GF:环沙林;VX:维埃克斯;VR:俄罗斯维埃克斯;Vs:维埃斯.
OP对胆碱酯酶(cholinesterase,ChE)的动力学研究是所有OP毒性机制和抗毒药物研究的重要基础。过去几十年来积累了大量针对不同结构OP和不同种属ChE的抑制、老化和重活化的动力学数据,为OP毒性研究和重活化剂重活化作用的构效关系分析提供支持,也为寻找更有效的重活化剂奠定了基础[3-4]。目前,虽然已合成了上千种重活化剂,仍未发现一种重活化剂能有效对抗不同结构OP导致的ChE中毒;且对于梭曼(soman,GD)等导致ChE快速老化的抑制剂,还未发现十分有效的重活化剂。本文针对特定重活化剂对不同结构OP的重活化作用不一及老化酶难于重活化等难点问题,从酶动力学角度全面综述了NA和部分OP对ChE的抑制、老化与重活化动力学研究,以期为全面了解OP的毒性特征、有效评估ChE重活化剂,以及开发更有效的治疗方案等提供有益参考。
1 OP种类及毒作用机制
NA主要包括G类和V类2大类,G类毒剂包括塔崩(tabun,GA)、沙林(sarin,GB)、GD和环沙林(cyclosarin,GF)等,多具有较强挥发性和低持久性;V类毒剂包括维埃克斯(VX)、俄罗斯维埃克斯(VR)、维埃斯(Vs)、VM和VG等,挥发性较差,但在环境中持久性较强[5]。2020年6月,禁止化学武器组织首次正式修订《禁止化学武器公约》,将诺维乔克类(novichoks)毒剂在化学品禁控清单1中增列为1A13-1A15[6]。诺维乔克类毒剂被定义为第四代化学战剂,又被称为A类NA。有报道显示,其毒性是VX的5~8倍[7],但也有报道其毒性略低于VX[8]。
有机磷农药种类繁多,按照毒性强弱可分为高毒、中毒和低毒3类,高毒类农药包括对硫磷、内吸磷和磷胺等,中毒类农药包括敌敌畏和甲基对硫磷等,低毒类农药包括敌百虫、乐果和马拉硫磷等。其中甲胺磷、甲基对硫磷、对硫磷、久效磷和磷胺等有机磷农药已于2007年起在国内全面禁止生产、销售和使用;此外,氧乐果、甲拌磷和克百威等毒性较大的农药也将被进一步被淘汰。而毒死蜱由于其广谱、高效、低残留,是替代高毒有机磷农药的首选,在我国市场占据重要地位[9]。
在机体中,OP主要通过对乙酰胆碱酯酶(acetyl⁃cholinesterase,AChE)活性的抑制发挥毒性作用。AChE主要存在于中枢神经系统、外周神经系统、神经肌肉连接处和红细胞膜等部位,位于突触间隙的AChE负责催化神经递质乙酰胆碱迅速水解为胆碱和乙酸,终止神经信号传导。但当OP存在时,OP与AChE反应形成磷(膦)酰化酶(中毒酶),导致神经突触间隙ACh过度累积,进而导致胆碱能受体过度激活,使胆碱能神经系统功能亢进,产生毒蕈碱样、烟碱样和中枢神经系统中毒症状,甚至造成机体死亡。中毒治疗即主要根据中毒症状,采用重活化剂、抗胆碱能药物和抗惊厥药物等联合用药[10]。
2 胆碱酯酶动力学文献计量聚类分析
在中国知网以“胆碱酯酶动力学”“有机磷化合物”和“神经性毒剂”等为主题词,在Web of Science核心合集下分别以“cholinesterase kinetics”、“organophosphorus”“nerve agent”和“enzyme kinetics”等为关键词,对1995-2021年的ChE动力学文献进行检索,文献题录导入Endnote X9文献管理软件,去重后共得到669篇文献,使用文献计量分析软件 VOSviewer[11],进行国家、作者和关键词聚类分析(图2),并对ChE动力学的发展按年代进行梳理分析(图3)。
对Web of Science核心合集的文献进行国别分析,设置发表文献数>5的国家,发现美国、德国和法国依次占据前三位,我国发表文献数量排在第9位,而总被引次数排在第18位(图2A)。
其次进行作者分析,在57位发表篇数>5篇的作者中,德国联邦国防军药理毒理研究所的Thiermann Horst和Worek Franze课题组、及俄罗斯喀山联邦大学神经药理学实验室Masson Patrick等在该领域具有较深入研究(图2B)。
关键词聚类分析时,设置显示出现次数>15次的关键词,进行同义词合并、去除无用关键词后得到58个关键词和4个聚类(图2C)。聚类Ⅰ集中于ChE自身的酶动力学机制及活性位点分析;聚类Ⅱ集中于OP抑制ChE的老化和重活化动力学研究;聚类Ⅲ集中于以分子对接手段发现新型重活化剂或用于治疗阿尔茨海默症的胆碱酯酶抑制剂;聚类Ⅳ则集中于有机磷农药的分析毒理学等。此外,虽然AChE贯穿这4个聚类,但丁酰胆碱酯酶(butyryl⁃cholinesterase,BChE)的研究也不容忽视。
按照年份进行分析,近年来ChE动力学研究主要集中于通过分子对接手段寻找新型重活化剂,继而集中于OP抑制ChE的重活化动力学研究等方面(图2D,图3)。
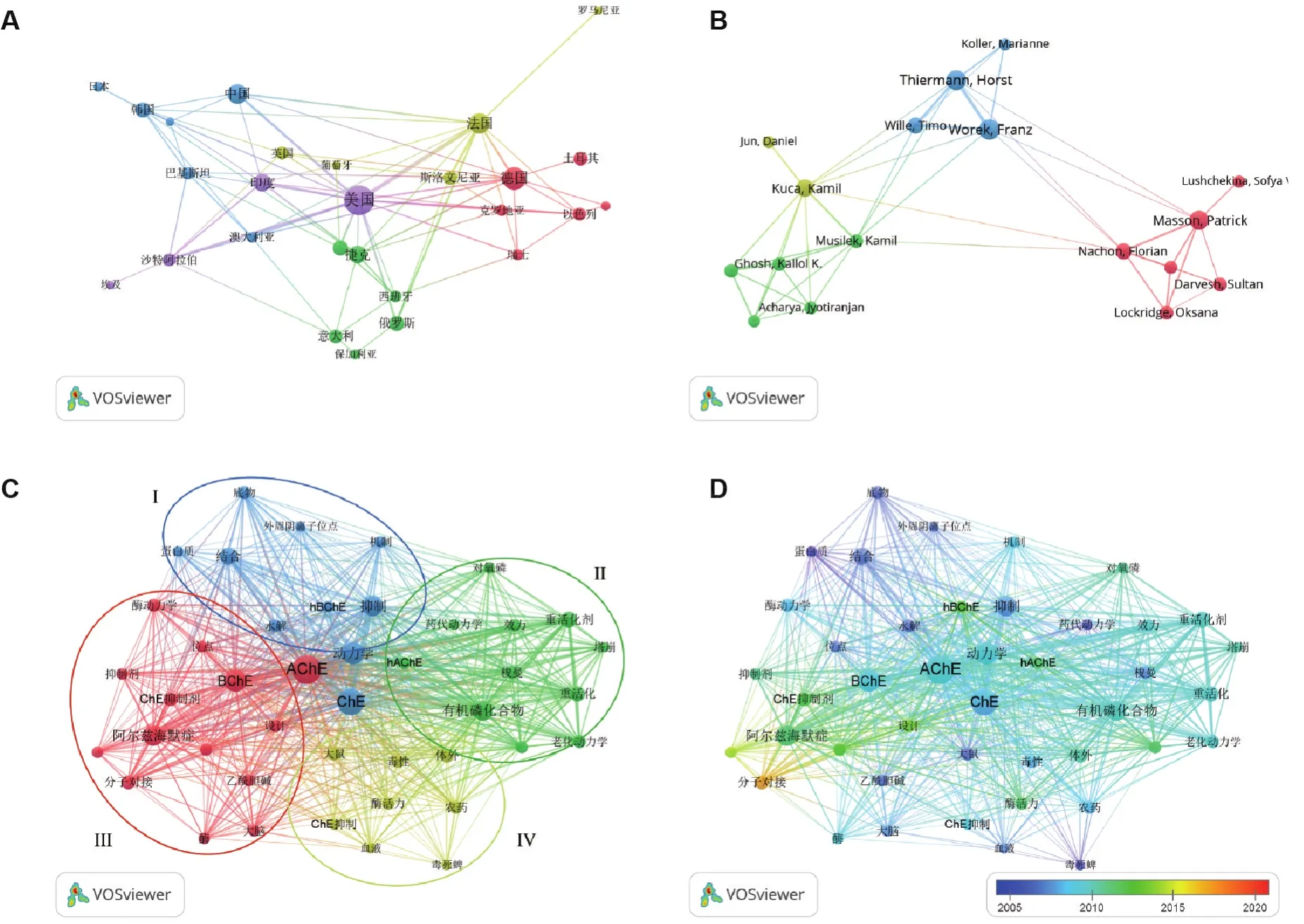
图2 采用文献计量软件VOSviewer对胆碱酯酶(ChE)动力学研究文献的分析结果.(A)国别分析;(B)作者分析;(C)关键词聚类分析;(D)年份分析.AChE:乙酰胆碱酯酶;hAChE:人乙酰胆碱酯酶;BChE:丁酰胆碱酯酶;hBChE:人丁酰胆碱酯酶.图C中聚类I~IV分别用蓝色、绿色、红色和黄色表示.
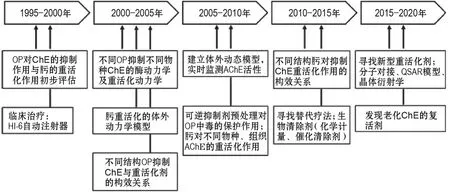
图3 ChE动力学研究发展趋势.HI-6:酰胺磷定;QSAR:定量构效关系.
3 OP的胆碱酯酶动力学研究
3.1 OP抑制ChE的反应机制
OP主要通过强抑制AChE活性发挥毒性作用,在此以氟膦酸酯类结构为代表,绘制了OP抑制ChE的反应机制(图4)。在生理条件下,位于AChE活性位点的丝氨酸-组氨酸-谷氨酸(Ser-His-Glu)催化三联体的电子由Glu残基、His残基连续转移至Ser残基的羟基基团,随后亲核进攻OP的磷原子,此时氟离子离去、膦酰化酶形成。该膦酰化酶可进行自发水解(自发重活化)而恢复活性,然而由于OP的磷原子与AChE的Ser羟基之间形成了共价键,其自发重活化过程非常缓慢(图4,途径A)。
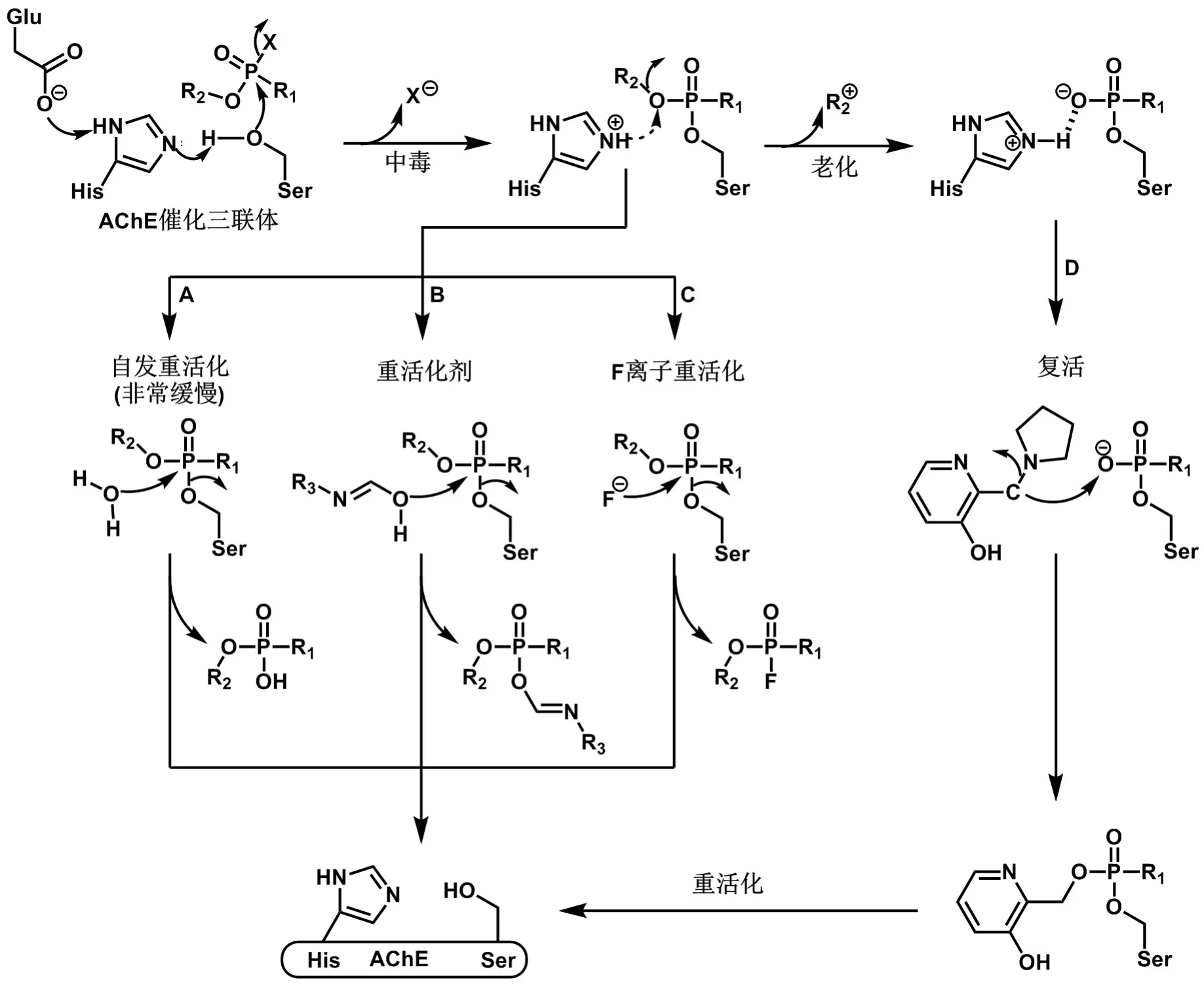
图4 OP中毒、老化和重活化与复活机制.
一般而言,除难于重活化的少部分膦酰化酶外,膦酰化酶可通过重活化剂(如肟,图4,途径B)或氟离子(图4,途径C)重活化而恢复活性,此时重活化剂或氟离子进攻该膦酰化酶的磷原子形成膦酰化肟和氟膦酸酯离去,从而恢复AChE活性,该进程较自发重活化更为迅速。此外,该膦酰化位点会发生脱烷基反应,这一过程称为“老化”,老化酶的羟基氧原子与催化三联体中的质子化His形成盐桥得以稳定。原来的观点曾认为,由于老化后磷原子的正电性较弱,会阻止肟类重活化剂的负电性亲核基团进攻该磷原子,该酶将永久失活。然而,2018年Hada等[12]揭示了一种曼尼希碱类重活化剂,该类重活化剂能够进攻老化酶中膦酰化基团的羟基氧原子,使该膦酰化基团重烷基化,再通过重活化剂的重活化作用恢复AChE的活性。这一通过重烷基化作用恢复老化AChE活性的过程称为复活(resur⁃rection)(图4,途径D)。
3.2 ChE动力学研究方法
近70年来,已积累了大量ChE的抑制、老化和自发重活化与重活化动力学研究数据,主要包括抑制速率常数(ki)、自发重活化速率常数(ks)、老化速率常数(ka)以及重活化速率常数,其中重活化速率常数包括解离常数(KD),最大一级重活化速率常数(kr),和总二级重活化速率常数(kr2)。KD与中毒酶对重活化剂的亲和力成反比,近似于中毒酶的解离常数。
Ellman法是ChE动力学研究的经典方法,通过测定OP抑制和重活化后的ChE活性,从而对OP的毒性及重活化剂的重活化能力进行评价[13-14]。基本原理为,底物碘化乙酰硫代胆碱在AChE作用下发生分解反应生成硫代胆碱,显色剂5,5′-二硫代双(2-硝基苯甲酸)与硫代胆碱迅速反应生成黄色的5-巯基-2-硝基苯乙酸,针对该产物在其最大紫外吸收波长(412 nm)处的变化进行测定。
在Ellman法基础上,目前已发展了多种不同底物〔如3-(乙酰氨基)-N,N,N-三甲基苯胺和苯甲酰基硫代胆碱[15]〕和不同荧光探针(如能与含硫醇的化合物快速发生亲核反应的香豆素衍生物Calbio⁃chem Probe Ⅳ[16])等,从而拓展方法适用范围。此外,对于ChE活力测定,还有Test-mate ChETM法、Michel(△pH)法、WRAIR WB法和Amplex Red AChE检测试剂盒等,主要用于OP暴露人员的筛查与确证。其中,WRAIR WB法以4,4′-联吡啶二硫醚作为硫代胆碱显色剂,可最大程度地避免血红蛋白对吸光度的影响,针对4℃保存或-80℃冻存的微量人全血能够同时测定红细胞(red blood cell,RBC)AChE和血浆BChE酶活力[17]。
虽然ChE动力学研究已发展了数十年,但尚需注意和综合考量多种因素,如酶的种属、类型、浓度、温度,甚至缓冲液类型等,以及适用的拟合方式、评价目的等,方能获得可靠结果。例如,OP抑制ChE动力学研究大多在磷酸盐类缓冲液(0.1 mol·L-1)中进行,但磷酸盐类缓冲液会加速OP水解[18],而包括三羟基甲基氨基甲烷和三羟甲基甲胺基乙磺酸在内的“Good′s buffer”缓冲液会与OP形成加合物[19],因此使用上述类型的缓冲液时,尚需根据使用目的和分析物等进行选择,以排除其不利影响。另外,在重活化动力学实验中,不同来源的ChE存在显著差异,与啮齿类动物和猪源相比,人源ChE对OP更加敏感,且更易重活化[20]。
然而,即使在缓冲液体系与ChE类型均一致的条件下,各研究工作的重活化动力学数据也难于直接进行比较。首先是温度的影响,37℃下重活化剂对中毒酶的重活化作用优于25℃;其次,当中毒酶浓度<5 nmol·L-1时,反应性常数kr随其浓度升高而降低,导致了各实验数据间的不可比较性,而当中毒酶浓度> 5 nmol·L-1时,kr值基本不变,因此应将中毒酶浓度控制在该浓度范围内[21]。考虑到重活化剂kr与KD的测定受中毒酶和重活化剂浓度影响均较为显著,一般通过比较kr2来评估重活化剂对中毒酶的重活化作用。在kr2的评估过程中,依赖于最大重活化率的非线性回归方法容易造成在任何给定重活化剂条件下的一级重活化速率常数(Kobs)的高估,此时可采用初始部分的线性回归方法。在重活化率较差(<20%)的情况下,一般通过比较最大重活化率和达到最大重活化率的时间对重活化剂的重活化能力进行评价。
目前主要使用的酶包括人红细胞(human RBC,hRBC)AChE、重组人AChE(recombinant human AChE,rhAChE)、脑AChE和hBChE等。Herkert等[22-23]发现RBC AChE可作为OP中毒后突触AChE的合适替代生物标志物,且脑AChE和RBC AChE的抑制和重活化动力学具有高度可比性。对于有机磷农药中毒患者,RBC AChE的体外动力学数据也与体内AChE状态存在密切相关性[24]。虽然BChE的生理功能尚不清楚,但由于血浆BChE是OP的生物清除剂[25],多数研究中均开展了AChE和BChE间动力学参数的差异比较研究。重活化剂作用的主要机制是从ChE的Ser活性位点上去除磷(膦)酰化基团,一般而言,BChE对OP和重活化剂的敏感性低于AChE,且自发重活化速率较低[26],因此对于重活化剂疗效的评估,测定AChE的活性较BChE更为可靠[27]。
3.3 ChE抑制动力学
关于不同结构OP对ChE的抑制、老化与自发重活化动力学研究,汇总了NA和部分有机磷农药对hAChE和hBChE的ki,ka和ks值(表1)。Worek等[28]深入研究了G类和V类NA对于hAChE的抑制动力学,测定了抑制速率常数ki。两类NA对hAChE均存在极强抑制作用,ki值在106~108L·mol-1·min-1之间。对OP结构与ki值的构效关系进行分析,有助于深入了解OP毒性特征。如针对hAChE体系,带有C1-C5侧链基团的系列GB类似物,随正烷基链和异烷基链延长(除GB外),其ki值逐渐增加,毒性逐渐增强[29]。

表1 不同结构OP对ChE的抑制(ki)、老化(ka)和自发重活化(ks)速率常数
有机磷农药的毒性较NA低,部分农药的ki值远低于NA,大多在1×102~1×106L·mol-1·min-1之间[30-31]。此外,Schopfer等[32]研究了生物素化有机磷酸酯(FP-biotin)抑制hAChE和hBChE的酶动力学,FP-biotin结构特征为O-乙基氟膦酰化基团与生物素标签共价结合,虽然体积较大,但所得到的酶动力学参数与GB和GF较为相近。另外,FP-biotin可用于鉴定与OP反应的蛋白质,适用于寻找OP暴露的新生物标记物。
3.4 ChE老化与重活化动力学
一般而言,以适当浓度的OP与hAChE作用一定时间(抑制率达95%~98%),采用透析法除去过量OP后,可用于中毒酶的老化与重活化动力学研究。对于NA,除GD可使hAChE在数分钟内快速老化外,GB在数小时内老化,GA和GF在1 d内老化,V类毒剂的老化速度较慢,一般为数天;自发重活化动力学方面,hAChE除与V类毒剂和丁基沙林作用后能检测到自发重活化外,与其他G类毒剂作用后均未检测到自发重活化[28]。此外,由有机磷农药抑制产生的二甲基和二乙基磷酰化hAChE的老化和自发重活化可以同时发生[30-31]。中毒酶的重活化动力学研究主要围绕几种临床常用的肟类药物展开,包括奥比醛肟(双复磷,obidoxime,OBI)、酰胺磷定(asoxime,HI-6)、醛肟吡胺(解磷定,prali⁃doxime,2-PAM)、甲肟(methoxime,MMB-4)、双解磷(trimedoxime,TMB-4)和双吡啶二肟(HLö7)等。采用连续程序进行重活化动力学研究时,为避免肟对AChE的抑制作用,使用肟的最大浓度一般不超过 100 μmol·L-1;在肟重活化作用较低的情况下,可采用不连续程序进行重活化动力学研究,此时允许使用的肟浓度最高可达5 mmol·L-1。
对于hAChE,不同OP和肟之间相互作用的动力学参数存在显著差异[28],代表性OP抑制hAChE的肟致kr2如图5所示。对除GA外的G类和V类NA抑制hAChE,重活化作用HLö7>HI-6>OBI,HLö7和HI-6的kr2值均>10 L·mmol-1· min-1,OBI的kr2值均>5 L·mmol-1·min-1(除 GD 和 GF);2-PAM 和MMB-4的重活化作用较差,对G类毒剂抑制hAChE的kr2值几乎均<1 L·mmol-1·min-1,对V类毒剂抑制hAChE的kr2值在1~10 L·mmol-1·min-1之间[38-39]。对GA抑制hAChE(>80%抑制),OBI,TMB-4和HLö7作用30 min后重活化百分比>50%,而HI-6,2-PAM和MMB-4作用30 min后重活化百分比<20%[40]。对有机磷农药抑制的 hAChE,OBI的重活化作用较强,HLö7次之,HI-6和2-PAM的重活化能力一般,MMB-4的重活化作用较差[28]。一般认为,2-PAM和MMB-4是大多数OP抑制hAChE的弱重活化剂;HI-6对氨基磷酸酯类OP抑制的hAChE重活化作用较弱,对其他NA抑制的hAChE的重活化作用较强;OBI能有效重活化包括氨基磷酸酯在内的大部分OP抑制的hAChE;HLö7可认为是对OP具有广泛重活化作用的广谱重活化剂,但该肟在溶液中很不稳定。

图5 OP抑制hAChE的肟致总二级重活化动力学常数(kr2)[28,30,33-35,37,45,56].MMB-4:甲肟;OBI:奥比醛肟;HI-6:酰胺磷定;HLö7:双吡啶二肟.
3.5 不同物种的ChE动力学研究
为了加深对物种差异的理解,使动物数据更可靠地外推到人类,对不同物种ChE动力学常数的准确测定十分必要[41]。多数研究以小鼠、大鼠、豚鼠和兔等为模型展开,但越来越多的证据表明,啮齿类动物和人类AChE的动力学特性存在显著差异,并不适合作为评估重活化剂重活化作用的动物模型[36,42],而大型动物模型更为适用。Dalton等[43]在腹部拉皮术中,在患者(38~63岁)完全知情同意情况下,获取了人腹部皮肤。利用豚鼠、猪和人的皮肤比较了VX的体外皮肤吸收动力学,发现猪和人的皮肤通透性无显著性差异,对VX的稳态渗透速率常数分别为333±226 和(207±62)μg·cm-2·h-1,因此猪是人体VX经皮暴露的合适动物模型。此外,由于与人类的相似性,非人灵长类动物如恒河猴已成为针对OP中毒医疗对策研发中最常用的大型动物模型,用于评估OP毒性和重活化剂的重活化作用。非人灵长类动物血液循环中的AChE活性水平与人相似,且不同NA如GB和VX抑制AChE的ki值和半数抑制浓度(median inhibition concentration,IC50)与人类一致[41,44];Luo等[45]使用3种NA和4种肟研究发现非人灵长类动物和人类AChE的老化及重活化动力学结果一致。
3.5.1 体外动力学模型
ChE抑制剂的毒代动力学、解毒剂的药动学性质和剂量以及重活化剂的重活化能力间的物种差异,阻碍了动物数据向人类的外推。Worek等[46]开发了一种体外动力学模型,可以计算不同OP抑制和肟重活化时的hAChE活性随时间变化情况;并通过农药中毒患者相关数据验证了该模型,同时使用公开数据对静脉内GB、GF和乐果暴露,经皮VX和VR暴露,以及不同重活化剂(OBI,HI-6和2-PAM)治疗进行模拟[47-48];进一步还涵盖了氨基甲酸酯预处理hAChE的药动学和酶动力学[49]。该模型所提供的基于物种特异性的动力学数据,预计可将动物数据更可靠地外推至人类,是定义重活化剂有效浓度和优化治疗的有效工具。
3.5.2 体外动态模型
体外静态实验中,对于膜上AChE活性测定,大多采用表面活性剂溶解的酶进行酶动力学测定。为了研究不同物种、不同组织AChE的酶动力学,Eckert等[50]发展了一种通用的体外动态模型,即将AChE固定在生物反应器中,再以OP连续灌流,能够实时监测不同物种、不同组织AChE的活性,以揭示物种依赖的动力学相互作用。通过该体外动态模型,Herkert等[51]测定了GB或对氧磷抑制猕猴、猪和豚鼠RBC AChE的肟致重活化作用,结果与体外静态实验吻合,证实了该模型可用于人和动物RBC AChE、OP和肟之间的相互作用研究;此外,该模型还可用于阐释包括氨基甲酸酯类在内的ChE可逆抑制剂的预处理对OP中毒的保护作用[52]。利用该体外动态模型研究不同组织AChE的酶动力学特性,发现人RBC、肌肉和脑AChE的米氏常数几乎相同(人肋间肌条来自胸外科手术患者,人脑组织样本来自脑癌手术患者);在所有受试物种中,脑AChE和RBC AChE的抑制和重活化动力学具有高度可比性[23]。
对于GD、N,N-二乙基GA和N,N-二正丙基GA等难于重活化的NA,体外动态模型能够排除其他因素,降低副反应影响,是研究抑制hAChE的肟致重活化动力学的良好策略之一[42]。如Worek等[53]在体外动态模型上研究了GA及2种类似物抑制hAChE的肟致重活化动力学,因为该体外动态模型可实现连续灌流,因此推测GA及其类似物抑制hAChE难于被肟重活化的原因仍然可能是其与hAChE峡谷中的残基发生相互作用,阻止了肟的进攻,从而难以有效重活化,而非由于膦酰化肟的再次抑制。
4 新型重活化剂
自1955年发现第一个供临床使用的肟类药物2-PAM以来,科学家已经合成了数千种肟类化合物,但仍没发现一种能够重活化被所有不同结构OP抑制的ChE,新型重活化剂的研究方兴未艾[54]。早期工作主要集中于荷电型季铵盐类单吡啶肟和双吡啶肟的合成与评价,例如,为深入了解与被抑制AChE具有足够亲和力和反应性的肟类化合物的结构要求,Kuca等[55]对肟的季铵盐结构、吡啶环间连接链的长度和刚性、肟基结构、肟基所在位置及数量这五大因素进行比较分析,发现双吡啶肟重活化作用更强,且肟基位置对不同OP影响较明显。Sahu等[56]分析了一系列丁烯基连接的双吡啶单肟对GA,GB,VX和对氧磷抑制AChE的重活化作用,结果显示,含不同功能基团的丁烯基连接的双吡啶单肟是良好重活化剂。Winter等[57]和Horn等[58]对具有不同连接基、肟基不同位置和部分附加取代基的双吡啶单肟和双吡啶二肟进行研究,发现肟基在双吡啶环上的位置及OP的种类对肟的重活化效能起决定性作用,如在吡啶环4位上的2个肟基对GA抑制AChE的重活化是必需的;连接基团如亚甲基、氧基二亚甲基或三亚甲基对肟的重活化作用影响并不一致[59]。
由于单种肟治疗对不同结构OP抑制ChE缺乏广谱重活化作用,在发现更有效的重活化剂之前,可将联用多种重活化剂作为解决方案。Worek等[60]通过体外动态实验发现OBI与HI-6虽无协同作用,但可拓宽重活化范围。Kassa等[61]通过体内实验深入研究了经典肟OBI和HI-6与新型双吡啶肟K727和K733联用对不同OP中毒动物的治疗作用,表明肟的联用可降低OP的急性毒性,提高动物存活率。
由于血脑屏障的存在,季铵盐肟类重活化剂无法进入中枢,因而难以恢复中枢系统内中毒AChE的活性,因此近年来研究主要集中于向非荷电型肟类和非肟类重活化剂中引入不同取代基来改善其作用特征[62-63],使利于进入并恢复中枢系统内中毒AChE的活性。目前4-氨基-2-(吡咯烷-1-基甲基)苯酚是已报道的重活化作用最强的非肟类重活化剂,但其本身对hAChE存在一定抑制作用(IC50值为 6.3 μmol·L-1);对不同 NA 抑制的 hAChE,4-氨基-2-(吡咯烷-1-基甲基)苯酚 100 μmol·L-1作用30 min可分别重活化50%(GB)、75%(GF或对氧磷),甚至100%(VX)[64]。
中毒AChE的老化问题一直难以通过任何治疗方法来解决,直到2018年,Zhuang等[12]提出老化AChE的重烷基化可能恢复老化AChE活性,这一过程称为复活。对老化的甲基膦酰化和异丙基膦酰化电鳐AChE,曼尼希碱类重活化剂〔2-(吡咯烷-1-基甲基)吡啶-3-醇〕作用4 d能使其活性恢复至32.7%和20.4%,但该过程仅在pH9条件下快速进行。此外,老化AChE的复活和重烷基化仍具有挑战性,例如底物必须以活性构象选择性地结合在活性位点上,从而产生关键的反应性中间体,以实现所需的重烷基化,然后重烷基化的膦酰化Ser才能被良好的亲核试剂重活化。
为开发更有效的广谱重活化剂,研究与ChE催化活性位点和外周阴离子位点同时作用的重活化剂是一个重要方面[5,65]。同时,结合晶体衍射学及分子对接等方法,可以寻找重活化剂结构与ChE活性位点间的关系,从而更好地进行结构筛选[66-67]。通过新型药物剂型,将重活化剂递送至中枢等亦是一种有效的努力方向。
5 生物清除剂
目前仍未找到任何一种重活化剂能对不同结构OP抑制的ChE进行重活化,且机体暴露于大剂量的或持久性较强的OP时,也会导致重活化剂的治疗效果不足,因此其他替代疗法亦具有重要价值。
化学计量生物清除剂和催化清除剂等可以防止全身性OP中毒、降低体内OP浓度。血浆BChE作为化学计量清除剂,较其他肟类重活化剂及抗惊厥药物在血浆中停留时间较长,可提供较强保护作用[68]。其缺点在于需要大量血浆BChE来结合低浓度OP,且只有在OP到达目标组织之前给药才能发挥作用。而催化清除剂显示出预防和治疗OP中毒的可行性,其不会被OP消耗,可以在较低剂量下使用。目前对OP解毒最有前途的酶是来自缺陷假单胞菌的磷酸三酯酶,已经筛选了多种不同突变体来提高其对毒性较高OP对映异构体的立体选择性,并可将催化活性提升4个数量级[69]。然而催化清除剂仍存在底物特异性高和催化活性低、体内稳定性差、和免疫原性等问题,具有反向立体选择性的酶突变体是一种改善催化活性的有效途径[70]。
此外,Zandona等[71]发现肟类重活化剂〔4-溴苄基-3-(羟基亚氨基)喹啉溴化铵〕与血浆BChE结合,可发挥催化清除剂的作用,在2 h内降解GF的速率比血浆BChE高100倍。Zhang等[72]通过原子转移自由基聚合与“点击”反应合成了BChE-聚合物-肟偶联物,其中肟能够重活化被抑制的BChE,从而加速OP消除。加入OP达到完全抑制后,该BChE-聚合物-肟偶联物在5~6 h能自发重活化55%~84%。即使经历了3个抑制-自发重活化循环,也依然具有较好的酶活力,能够有效清除游离OP。
6 结语
OP作为AChE的强抑制剂,对人类生命安全构成显著威胁。OP的ChE动力学研究,目前研究挑战在于ChE动力学研究方法、不同物种ChE动力学常数的准确测定及外推、体内外评价模型的可比性和可靠性等方面。针对这些问题,①可发展适用范围广(如涵盖全血)、高灵敏、抗干扰的新ChE动力学研究方法;②引入多参量实验设计全面考察多因素影响,以获得高可信度的准确结果;③综合考虑包括羧酸酯酶等其他酯酶的催化清除作用;④发展更准确的体内外动力学动态测定及拟合模型等。考虑到不同结构OP抑制ChE的动力学差异较明显,仍需获取更多种类OP的ChE动力学参数,并在定量构效关系等方面加强研究。OP抑制ChE的重活化动力学研究仍是主要研究方向。包括新型复活剂——曼尼希碱类非肟类重活化剂在内的新型重活化剂是近年的研究热点,但老化AChE的复活仍具有挑战性。在现有重活化剂基础上,通过结构改造和修饰、或经由适当的药物剂型改善作用效果等手段,研发理想的新型重活化剂,使其具有易穿透血脑屏障、广谱、起效快、或能复活老化ChE等特点将是今后努力的方向。

