全身暴露动态吸入一氧化二氮对清醒大鼠电生理指标的影响
张彦瑾,刘宇轩,单煜恒,聂志勇,王永安
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;2.解放军总医院第一医学中心神经内科,北京 100853)
一氧化二氮(nitrous oxide,N2O)俗称“笑气”,是使用最广泛的麻醉剂[1],因麻醉效力低,早期在牙科手术中常作为麻醉辅助剂与其他麻醉药联用[2]。由于吸入N2O可引起成瘾、致幻和欣快感[3],N2O已成为一种滥用的吸入药物[4]。根据2016年全球药物调查结果[5],N2O已经成为第七大最常滥用的药物。滥用N2O可中毒,最终出现不可逆的神经损伤,但其致伤机制仍不明确。近年来,N2O滥用在我国也越来越严重,临床病例逐渐增加。因此,开展N2O吸入致伤效应、机制及防治措施研究具有重要意义。建立N2O全身暴露动态吸入装置,是实现模拟N2O吸入评价的支撑和基础。
N2O的致幻和致欣快作用与脑电和心电等电生理指标密切相关。电生理遥测技术可从有意识自由活动的机体中获取生物信号,经接收器将模拟频率信号转换成可分析的电生理信号[6]。无线遥测技术可最大程度地减少实验环境的干扰,还原机体真实的生理体征变化,现已被应用于多种实验动物进行血压[7]、心率、心电图(electrocardiogram,ECG)、脑电图(electroencephalogram,EEG)[8]和体温等数据的采集。因而,建立模拟N2O动态吸入暴露的装置,并实现与损伤效应实时评价(如电生理遥测)技术的联用,是探讨吸入N2O对大鼠产生影响的一种有效手段。
目前,对于吸入N2O如何致大鼠电生理指标变化仍不清楚,大多是基于N2O与其他镇静和麻醉药物同时使用情况下的研究[9],可能改变或混淆N2O特有的生理学特征。本研究通过建立全身暴露动态吸入N2O装置并与电生理遥测技术联用,对清醒自由活动大鼠血压、体温、心电以及脑电进行数据采集和分析,考察吸入N2O对大鼠电生理指标的影响,探讨N2O致伤机制。
1 材料与方法
1.1 动物、试剂和仪器
SD大鼠,雄性,体重200~220 g,购自北京市维通利华实验动物技术有限公司,许可证编号:SCXK(京)2016-0006,饲养在恒温动物房中(约25℃),12/12 h光黑交替,自由进食标准颗粒饲料及饮水。手术前12 h禁食,麻醉后进行遥测植入子的植入手术,手术后单笼饲养,待其恢复后进行N2O吸入实验。本研究涉及与动物相关的内容和程序都遵循军事科学院军事医学研究院实验动物伦理委员会的规定(编号:IACUC-2020-108)。N2O(纯度:99.999%),北京北氧联合气体有限公司;O2(纯度:99.999%),北京环宇京辉京城气体科技有限公司;注射用青霉素钠(批号:0171909304),中诺药业(石家庄)有限公司;戊巴比妥钠(批号:140828),国药集团化学试剂有限公司;0.9%氯化钠注射液(批号:2006103205),石家庄四药集团有限公司;碘伏(批号:200621),山东利尔康医疗科技股份有限公司。单臂数显脑立体定位仪(ZS-FD),北京众实迪创科技发展有限责任公司;DSI植入式生理信号无线遥测系统〔包括TL11M2-C50-PXT型植入子、TL10M3-F50-EEE型植入子、RPC信号接收器(RPC-1)、环境压力参考装置(APR-1)、数据交换矩阵(DEM 6607)、Ponemah Physiology Platform电生理数据采集分析系统以及Neuroscore脑电信号分析系统〕,美国DSI公司;流量控制器(Red-y smart)和GET RED-y 5气体流速控制系统,瑞士福特林公司;DACO控制软件和空气压缩机(GX4 FF),德国TSE公司。
1.2 大鼠全身暴露动态吸入装置的构建
首先建立全身暴露动态吸入N2O装置(图1),包括气体供给单元、动物暴露单元、气体过滤处理单元和控制单元等。气体供给单元包括空气压缩机、N2O气体钢瓶和O2气体钢瓶等。动物暴露单元是指用于动物吸入及气体浓度监测的暴露舱,其采用符合空气动力学原理的圆锥体结构设计,能够使气体得到均匀的释放,且整个暴露舱体积约为15 L,可使气体快速达到平衡;暴露舱上端设有进气口、采样口、传感检测器接口等,下端设有出气口,并预留电生理遥测接收器所需空间,暴露舱采用电生理遥测信号能够穿透的有机玻璃(聚甲基丙烯酸甲酯)构建,保证了与电生理遥测仪的联用。气体过滤处理单元包括真空泵及废气吸附与净化器等,其中真空泵用于将暴露舱内气体抽出,以形成动态的气体吸入(给药)环境,废气吸附与净化器用于气体净化。控制单元包括流量控制器及多通转接头等,用于气体流速和流量精准控制。

Fig.1 Schematic diagram of nitrous oxide(N2O)whole-body dynamic inhalation exposure device for rats.
1.3 遥测模型的制备
1.3.1 心电和血压遥测模型
使用TL11M2-C50-PXT型植入子,在洁净保温无菌环境下,大鼠ip给予2%戊巴比妥钠60 mg·kg-1麻醉,切开腹部皮肤和肌肉,分离腹主动脉,将血压导管插入腹主动脉内,将2根心电电极的正极置于大鼠剑状软骨左侧1.5~2.0 cm处的肌肉表面,负极置于大鼠右侧胸肌部位肌肉表面,调整心电电极线长度,用结扎线固定于相应位置。缝合皮肤,碘伏消毒。
1.3.2 脑电遥测模型
使用TL10M3-F50-EEE型植入子,大鼠采用1.3.1方法麻醉大鼠后固定于脑立体定位仪上,切开背部皮肤,将脑电植入子固定于皮下;切开头部皮肤,在矢状缝左侧约2 mm,分别距前卤下方、后卤上方各约2 mm处将1导联的1对电极弯曲放置在左钻孔内;在矢状缝右侧约2 mm,分别距前卤上方约2 mm和距冠状缝和人字缝中点位置,将2导联1对电极弯曲放置在右侧钻孔内;调整3导联的1对电极线长度,用结扎线固定于头夹肌相应位置。缝合皮肤,碘伏消毒。
1.3.3 术后恢复
手术后,置大鼠于保温状态下直至完全苏醒。所有大鼠均单独饲养,并ip给予青霉素钠(用氯化钠注射液配成母液2×108U·L-1)4×105U·kg-1,每天1次,连续3 d,待存活大鼠恢复正常状态(一般在术后1周)、初步测试可获取相应信号后,分组进行后续实验。
1.4 全身暴露动态吸入N2O
将心电、血压模型大鼠和脑电模型大鼠各分为4组,分别为空气对照组及30%,50%和70% N2O组,每组5只,染毒流速设置见表1。将模型大鼠置于染毒暴露舱中,通入空气使其适应环境,监测数据变化,待大鼠各生理指标处于正常稳定状态后,以每分种采集1次的频率,连续采集6 h(吸入前2 h、吸入2 h、吸入后2 h)的行为状态及血压、体温、心电和脑电参数等生理数据。
核电站址资源丰富,开发潜力大,是广东省未来能源需求的重要来源。考虑目前已明确核电项目厂址按照每个厂址6台机组规模,后续新增核电暂按单机1 250 MW,以上厂址可装机36 GW。另外,广东省还储备了一批核电厂址,按照每个厂址4台机组规模,后续新增核电暂按单机1 250 MW,以上厂址可装机20 GW。
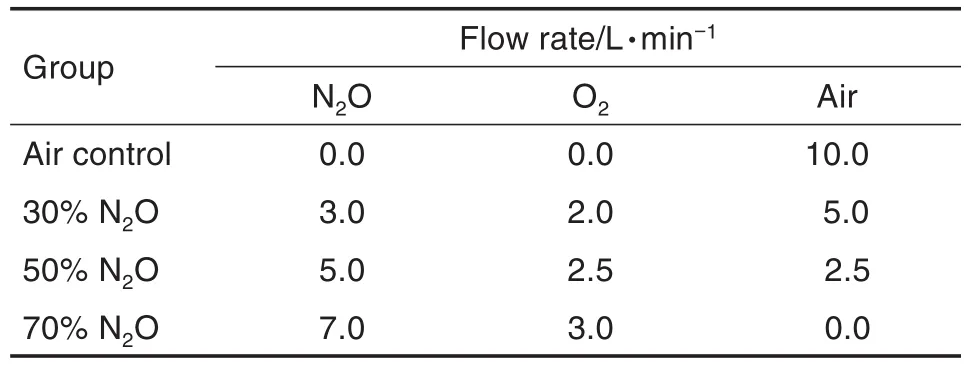
Tab.1 Flow rate of nitrous oxide inhalation exposure
1.5 数据提取和指标分析
基于采集到的电生理数据,利用Ponemah Physiology Platform软件重点对心电、血压遥测模型大鼠的心率(heart rate,HR)、R波、P波、T波、QT间期、QRS间期、PR间期、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、平均动脉压(mean arterial pressure,MAP)以及体温(temperature,T)等数据进行提取和分析。利用Neuroscore软件,重点对脑电遥测模型大鼠进行功率谱分析,首先提取δ波(0.5~4 Hz)、θ波(4~8 Hz)、α波(8~12 Hz)、β波(12~30 Hz)和γ波(30~48 Hz)波段的绝对功率,而后进行相对功率的分析。相对功率(%)=各功率带(δ,θ,α,β和γ)的绝对功率/功率总和(δ+θ+α+β+γ)×100%。
1.6 统计学分析
2 结果
2.1 吸入N2O对大鼠行为的影响
吸入N2O后,大鼠变得警觉、急躁,出现站立攀爬现象,随后出现后肢无力,无法站立、频繁甩动前肢情况;停止通入N2O后约5 min恢复正常状态。
2.2 吸入N2O对大鼠血压和体温的影响
与空气对照组相比,30% N2O组大鼠血压在吸入N2O过程未出现明显变化;50%组和70% N2O组吸入开始后大鼠SBP(图2A)、DBP(图2B)和MAP(图2C)均上升(P<0.05),且随N2O浓度的增加而增加(r分别为0.897,0.932和0.916)。由实时监测血压图(图2D)也可看出,与空气对照组相比,吸入N2O大鼠血压随N2O吸入浓度的增加而增加。

Fig.2 Blood pressure in response to nitrous oxide in rats.Rats were exposed to air,30%,50% and 70% N2O separately,and data were collected once per minute for continuous 6 h.-120-0 min,2 h before inhalation of N2O;0-120 min,inhaled N2O for 2 h;120-240 min,2 h after inalation of N2O.A:systolic blood pressure(SBP)recorded for 6 h.B:diastolic blood pressure(DBP)recorded for 6 h.C:mean arterial pressure(MAP)recorded for 6 h.D:typical graph of blood pressure(BP)changes in 2 sec.1 mmHg=0.133 kPa.±s,n=5.*P<0.05,**P<0.01,compared with corresponding air control group.
图3中可以看出,与空气对照组相比,30% N2O组大鼠T未出现显著性差异;50%和70% N2O组T显著下降(P<0.05,P<0.01),且T随N2O吸入浓度的增加而降低(r=-0.970);吸入结束后,T均逐渐恢复至正常状态。

Fig.3 Effect of nitrous oxide inhalation on body temperature of rats.See Fig.2 for the rat treatment.±s,n=5.*P<0.05,**P<0.01,compared with corresponding air control group.
2.3 吸入N2O对大鼠心电指标的影响
与空气对照组相比,30% N2O组大鼠各心电指标在吸入N2O过程中均无明显变化;50%和70% N2O组心率、R波、P波和T波均显著上升(P<0.05)(图4A~D),且随N2O浓度的增加而增加(r分别为0.955,0.950,0.932和0.908);QT间期显著下降(P<0.05,P<0.01)(图4E),且随N2O浓度增加而降低(r=-0.949);QRS间期和PR间期均未出现显著变化(图4F和G)。从图4A可以看出,50%和70% N2O组大鼠心率在吸入开始后出现上升;吸入N2O约40 min达最高值,随后保持稳定;吸入结束后约10min恢复正常水平。由大鼠心电图(图4H)可见,与空气对照组相比,随N2O浓度的增加,大鼠心率间期缩短、心率加快,同时R波、P波和T波振幅增加(图4B~4D)。
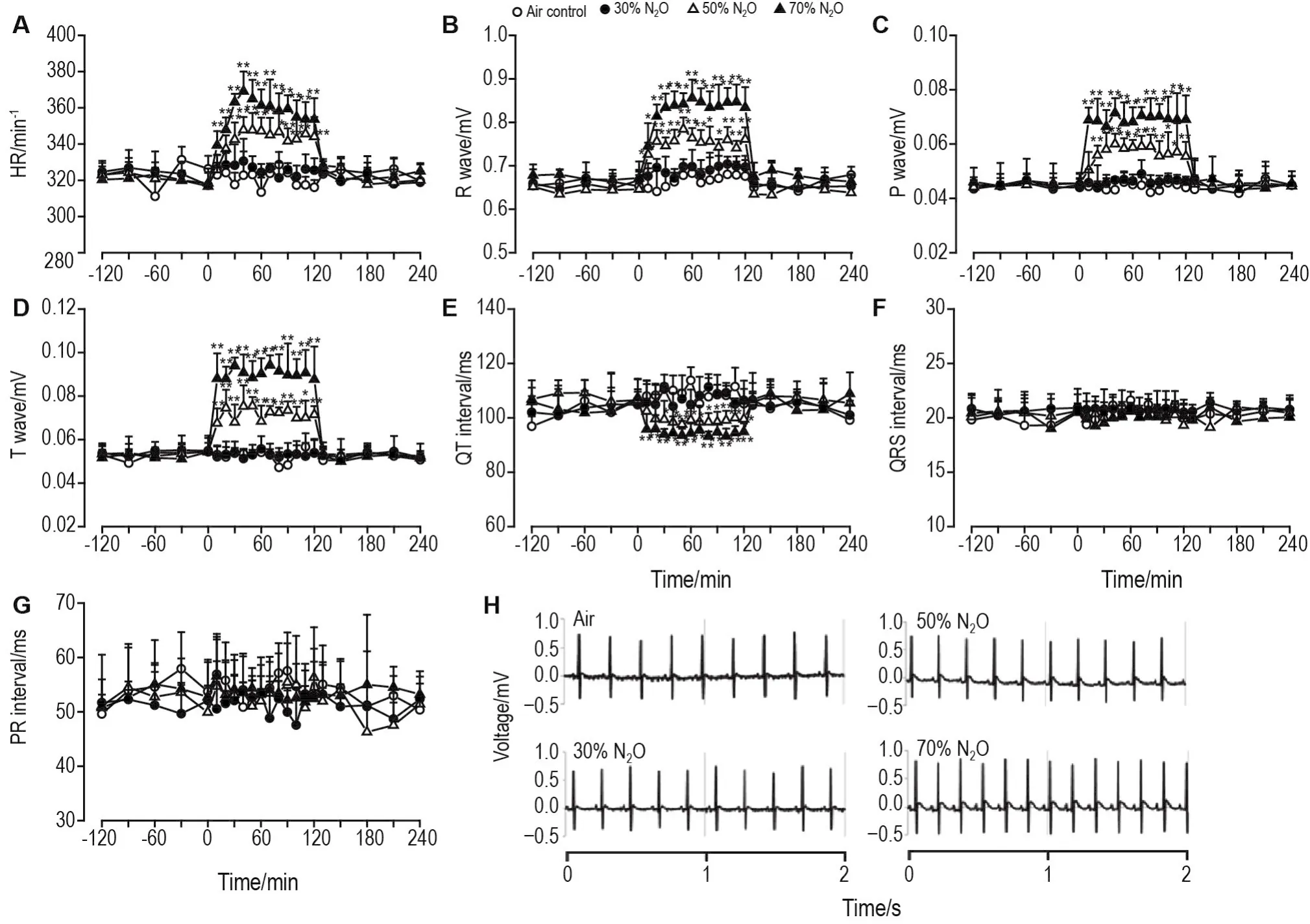
Fig.4 Electrocardiogram activity in response to nitrous oxide in rats.See Fig.2 for the rat treatment.A:HR(heart rate);B:R wave;C:P wave;D:T wave;E:QT interval;F:QRS interval;G:PR interval;H:voltage.±s,n=5.*P<0.05,**P<0.01,com⁃pared with corresponding air control group.
2.4 吸入N2O对大鼠脑电指标的影响
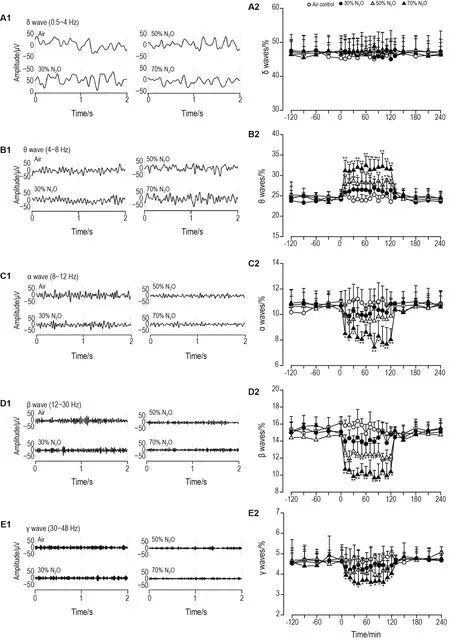
Fig.5 Electroencephalogram activity in response to nitrous oxide in rats.See Fig.2 for the rat treatment.A1-E1:repre⁃sentative waveforms of δ,θ,α,β and γ wave,respectively.A2-E2:absolute power values of waves in A1-E1.Relative power(%)=P(δ,θ,α,β,γ)/P(δ+θ+α+β+γ)×100%.±s,n=5.*P<0.05,**P<0.01,compared with corresponding air control group.
3 讨论
本研究基于空气动力学原理、采用可被电生理遥测信号穿透的有机玻璃,成功建立了大鼠全身暴露动态吸入N2O模型与电生理遥测的联用系统,为吸入N2O致伤机制提供了技术平台和支撑。另外,本研究考虑到雌性大鼠有发情周期,激素的周期性变化可能会对电生理指标产生影响,为保证单一变量并排除无关因素的影响,本研究选择雄性大鼠作为实验对象。
N2O致心率和血压升高现象可能是因为N2O作为N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体拮抗剂,可以抑制γ-氨基丁酸(γ-amino⁃butyric acid,GABA)能神经元上的NMDA受体,使GABA能抑制作用下调[10],激活多巴胺(dopamine,DA)能神经元兴奋性信号传导途径,从而激活脑内奖赏系统,使中脑边缘系统DA浓度增加而产生欣快感[11]。脑内DA激动交感神经,使交感神经兴奋,易引起心率加快、血压升高[12],这与本研究结果相符。另外,QT间期代表心室开始兴奋去极化至完全复极化所经历的时间,QT间期的长短与心率呈负相关,即心率越快,QT间期越短,也进一步验证了大鼠吸入N2O使心率加快。而脑内DA浓度增加可能也是吸入N2O致成瘾的重要生物学基础[13]。
吸入N2O后大鼠体温降低。NMDA受体是谷氨酸受体的一个亚型,是配体门控受体复合物,参与学习记忆、体温调节[14]、神经退行性疾病等许多过程。NMDA受体与下丘脑中的温度敏感神经元密切相关,并通过内源性谷氨酸敏感系统来调节体温[15]。N2O作为NMDA受体拮抗剂则通过阻断NMDA谷氨酸能受体,从而导致体温的下降。
大脑节律性神经活动被认为在认知中起着基础性的作用,脑电图活动以特定的频段与认知功能进行联系[16]。在脑电图的不同脑电频段中,θ波段的脑电活动与记忆能力的关系最为密切[17]。本研究结果表明,大鼠吸入N2O后,θ波出现升高,并随着N2O浓度的增加而增加,表明大鼠吸入N2O可能对记忆能力造成影响。α波活动与记忆和注意力相关[18],并随着意识的丧失而出现α波消失现象。本研究结果表明,大鼠吸入N2O后,α波随着N2O浓度的增加而下降,这与Yamamura等[19]报道的受试者吸入N2O致α波的振幅和频率降低一致。β波被认为在感觉运动功能和注意力的维持中发挥作用[20],γ波与感觉和非感觉区域的注意力和记忆有关[21],且β波和γ波振幅均与学习记忆功能呈正相关。本研究结果表明,大鼠吸入N2O后β波和γ波均降低,并随着N2O浓度的增加而下降,表明吸入N2O可能会降低大鼠的学习和记忆能力。因此,大鼠吸入N2O后引起不同脑电频段的变化可能与吸入N2O致认知障碍有关。
综上,N2O吸入可致大鼠心率和血压升高、体温下降,对脑电波的节律性振荡产生改变,均可能与N2O致成瘾性和认知障碍密切相关。

