基于毒性效应通路荧光细胞传感模型的T-2 毒素毒性筛查
孙嘉笛, 高 璐, 张银志, 孙秀兰
(江南大学食品学院,江苏无锡 214122)
单端孢霉烯族毒素(trichothecenes)是自然界中广泛分布的一类真菌毒素, 由多种霉菌属产生,主要包括镰刀菌属 (Fusarium)、 单端孢属(Trichothecium)、头孢霉(Cephalosporium)等[1]。 单端孢霉烯族毒素在多种谷类作物如大麦、小麦、燕麦、玉米、马铃薯[2-3],以及肉、蛋、奶,甚至动物饲料中都能被检测到[4-5]。 T-2 毒素是由镰刀菌属代谢产生的一种A 型单端孢霉烯族毒素,是毒性最强的真菌毒素之一[6]。1973 年,世界卫生组织将T-2 毒素归类为农产品、人类食品和动物饲料中不可避免的污染物[7]。
T-2 毒素对人体健康和畜牧业有害, 其通常在储存条件气候寒冷或潮湿的谷物中被发现,特别是在燕麦、大麦、小麦和动物饲料中[8-10]。T-2 毒素的毒性强、污染范围广、检出水平高。根据Biomin 对全球饲料中真菌毒素含量进行的调查,有19%的样品被T-2 毒素污染,我国饲料样品中T-2 毒素的污染率为79.5%, 这些样品中T-2 毒素的水平最高可达735 ng/g[11]。 大骨节病(kashin-beck disease,KBD)流行地区(如青海省和四川省)的饮用水以及中药中也检测到T-2 毒素[12]。此外,虽然大骨节病的病因尚不清楚,但有理由怀疑T-2 毒素是导致该病症的主要因素之一, 在KBD 流行的地区,T-2 毒素的含量相对较高,小麦污染的平均水平为78.91 μg/kg,面粉污染的平均水平为47.47 μg/kg[4,13-14]。
T-2 毒素的毒性包括神经毒性[15]、肝毒性[16]、生殖毒性[17]和肠毒性[18]。 目前,对于T-2 毒素毒性的评价方法主要有两种,一种是动物染毒实验(体内评价),另一种是细胞毒性评价(体外评价)。 基于实验动物的体外评价模型已见报道,然而该方法操作复杂、实验周期长。 传统的细胞毒性实验大多是通过测定细胞常规的生理生化指标来进行毒性评价,然而该方法取得的结果特异性差,不够直观。 因此,亟需开发一种可以直接观察、实时监测、能真实筛查T-2 毒素细胞毒性的方法。
作者建立了一种可视化的荧光细胞传感器并对T-2 毒素的细胞毒性进行筛查。利用T-2 毒素毒性通路中的关键靶点应答元件TRE 与mCherry 的启动子构建独立的质粒, 通过转染将其导入HEK293 细胞, 成功建立了能稳定表达荧光的细胞株,当T-2 毒素及其代谢产物刺激细胞后,细胞内特异性受体及其信号通路被激活,应答元件TRE 通过信号通路启动所连接的荧光蛋白表达,可直接示踪细胞内部变化过程。 使用该荧光细胞筛查T-2 毒素的毒性,采用倒置荧光显微镜和宽场高内涵成像仪观察和记录细胞受到T-2 毒素刺激后的荧光变化, 建立毒素质量浓度与细胞荧光强度的剂量-效应关系,完成对T-2 毒素的实时、精确、定量筛查。
1 材料与方法
1.1 材料与试剂
T-2 毒素标准品、HT-2 毒素标准品:Sigma 化学试剂有限公司产品;Lipofectamine 3000(Invitrogen,CA):美国Thermo fisher 公司产品;无内毒素质粒小提中量试剂盒:TIANGEN 生物科技公司产品;LB 培养基、琼脂粉:国药集团产品;氨苄霉素、G418 抗生素:Aladdin 公司产品。
1.2 材料与设备
1.3 实验方法
1.3.1 细胞培养细胞完全培养基的配制:人胚肾HEK293 细胞完全培养基为含有10%胎牛血清和1%双抗的RPMI-1640 培养液(均为体积分数)。 细胞常规培养:将细胞置于37 ℃培养箱中培养,保持95%湿度以及体积分数5%的CO2。 HEK293 细胞为贴壁生长,2 d 更换一次细胞培养液。 当细胞密度达到80%~90%时,除去培养皿中的完全培养基。 加入PBS 溶液清洗3 次,以清洗残留的培养基,之后加入1 mL 含质量分数0.25% EDTA 的胰酶消化液,在培养箱中孵育2~3 min,立即加入1 mL 的完全培养基终止消化。 收集细胞至无菌离心管中,800 r/min 离心5 min,弃去培养液,按照1∶3 的传代比例加入相应的完全培养液重悬细胞,转移至新的细胞培养皿内进行培养。 选择处于对数生长期的细胞用于后续实验。
1.3.2 pcDNA3.1-TRE-mCherry 荧光质粒的构建载体pcDNATM 3.1 (+) 包含一个多克隆位点(multiple cloning site,MCS)。 将TRE (5′-TGAC/GTCA-3′) 改造为8 串联重复序列结构(5′-TGACTCATGACTCATGACTCATGACTCATGACTCA TGACTCATGACTCATGAC-3′)[19-20], 将获得的串联序列与mCherry 的启动子连接以获得目标基因序列,将设计的靶基因序列插入pcDNA3.1 的MCS 中以构建重组DNA,酶切位点为Sac I-Xho I。 AmpR设计用于筛选原核生物抗性,NeoR 设计用于筛选真核生物抗性。
氨苄霉素用于筛选原核表达。 配置固态和液态LB 培养基,高压灭菌冷却至50~60 ℃时,加入氨苄霉素用于抗性筛选, 得到含50 μg/mL 氨苄霉素的LB 培养基。 无菌状态下,挑取TRE-mCherry 感受态菌种(菌种由天津卡酶德公司构建)划线,37 ℃倒置过夜培养。 挑取单克隆菌落,接入上述培养基,摇床37 ℃过夜培养。 依据EndoFree 质粒抽提手册,提取大量重组DNA,保存于-20 ℃,避免反复冻融。
1.3.3 荧光质粒的细胞转染细胞铺板于6 孔板,当细胞融合度为90%时,弃去培养基,细胞转染的主要试剂是阳离子脂质体3000,根据说明书进行操作。 以6 孔板为例,取两支灭菌离心管,一管中加入125 μL 无血清培养基、2.5 μg TRE 标记的DNA 质粒和5 μL P3000 试剂, 另外一管中加入7.5 μL Lipofectamine 3000 转染试剂, 室温下静置5 min后,将第二管中混合试剂加入第一管中,轻轻混匀,室温静置15 min, 将得到的DNA-脂质复合物均匀滴加到细胞培养板中, 混匀后放回到培养箱中2~4 d,传代培养并使用新霉素进行真核筛选,然后进行转染细胞分析[21-22]。
1.3.4 HEK293 细胞转染后细胞增殖活性分析T-2毒素质量浓度为:0.2、0.5、1、2、5、10、20、50 ng/mL,计算增殖抑制率,根据抑制率分析HEK293 细胞转染前后增殖活性。
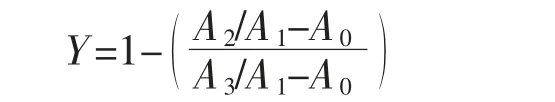
式中:Y 为细胞增殖抑制率,%;A0为空白组吸光度;A1为对照组吸光度;A2为转染组吸光度;A3为无毒素添加转染组吸光度。
1.3.5 转染HEK293 细胞活性氧检测多功能荧光酶标仪测定细胞内荧光相对强度,根据荧光强度值分析HEK293 细胞转染前后活性氧含量。
人教版初中语文教材九年级上册第四单元是“小说”单元,从“文体”角度彰显九年级新教材组元的结构特征。入选课文有鲁迅的《故乡》、莫泊桑的《我的叔叔于勒》和曹文轩的《孤独之旅》。其中,《故乡》《我的叔叔于勒》是“教读课文”,《孤独之旅》是“自读课文”,三篇文章都是从“成长小说”方面来推进的。下文中,笔者以“自读课文”《孤独之旅》的课堂操作为例,探讨在小说的课堂教学中培养学生独立阅读能力的有效途径。
1.3.6 转染HEK293 细胞凋亡检测用流式细胞仪检测,采用Cell Quest 软件对检测结果进行分析。
1.3.7 荧光HEK293 细胞传感器筛查T-2 毒素的毒性基于T-2 毒素的细胞毒性通路作用, 通过HEK293 细胞荧光传感器所表达的荧光强度对T-2毒素进行毒性筛查。 经过质粒转染并稳定表达的HEK293 细胞收集后接种于无菌96 孔板中,培养箱中过夜,待细胞贴壁后弃去培养基,加入100 μL 含有10 ng/mL T-2 毒素的细胞培养液,同时设置不含毒素的对照组以及未进行质粒转染的空白组。 处理完成后立即置于酒精擦拭过的宽场高内涵成像仪中, 连续进行12 h 实时荧光监测mCherry 表达,每1 h 进行细胞荧光成像拍摄及荧光强度检测, 分析得到关于时间响应的T-2 毒素毒性。
将稳定转染的HEK293 细胞收集, 接种于96孔板中,培养箱中过夜,待细胞贴壁后弃去培养基,加入100 μL 含不同质量浓度的T-2 毒素的培养液,分别为:0.5、1、2、5、10、15、20、25、30 ng/mL。 适宜时间后对mCherry 表达进行检测, 在倒置荧光显微镜下进行荧光成像拍摄,并通过多功能酶标仪检测荧光强度。 根据荧光强度值与T-2 毒素关系进行线性拟合,计算检测限(LOD)。
1.3.8 样品加标实验
用三氯甲烷-无水乙醇溶液 (体积比为4∶1)提取面粉样品,使用中性氧化铝/活性炭柱纯化,然后制成样品溶液[23]。 对处理后的面粉样品进行加标实验,T-2 毒素的终质量浓度为0、2、5、10、20 ng/mL,对该溶液进行无菌过滤并用于细胞荧光传感分析。
1.3.9 荧光HEK293 细胞对T-2 毒素代谢产物的毒性筛查研究表明,真菌毒素的代谢产物与原毒素结构相似,并且同样有极高的毒性作用[24-25]。 T-2毒素是单端孢霉烯家族中毒性最强的一种。 T-2 毒素发生去乙酰化后代谢成HT-2 毒素, 两者的结构十分相似,且在体内主要以HT-2 形式存在[26]。 为了对T-2 毒素的代谢衍生物进行毒性检测,利用不同质量浓度的HT-2 毒素(0.2、0.5、1、5、10、20、30、40、50 ng/mL) 与稳定转染的HEK293 细胞孵育8 h,拍摄细胞荧光成像,监测细胞荧光强度。
2 结果与分析
2.1 HEK293 细胞荧光传感器原理
mCherry 是常用的示踪剂之一, 其颜色和单体分子的光稳定性优于其他荧光蛋白标记[27]。 HEK-293 细胞易于转染, 是表达异源基因的常用细胞模型[28-29]。 研究发现,HEK293 细胞构建的生物模型具有更好的荧光响应, 因此将mCherry 和HEK293 细胞应用于生物模型的构建。
由图1 所示, 在生物模型的构建中,以pcDNA3.1 为质粒载体,mCherry 的启动子序列与AP-1 识别元件TRE 相连,TRE 相当于级联信号的“启动子”,mCherry 荧光蛋白报告基因作为模型中的输出信号。 利用脂质体可以和细胞膜融合的特点,将pcDNA3.1-TRE-mCherry 质粒转染导入HEK293细胞。当T-2 毒素刺激细胞,激活细胞内AP-1 信号因子,引起识别元件TRE 启动和荧光蛋白表达。
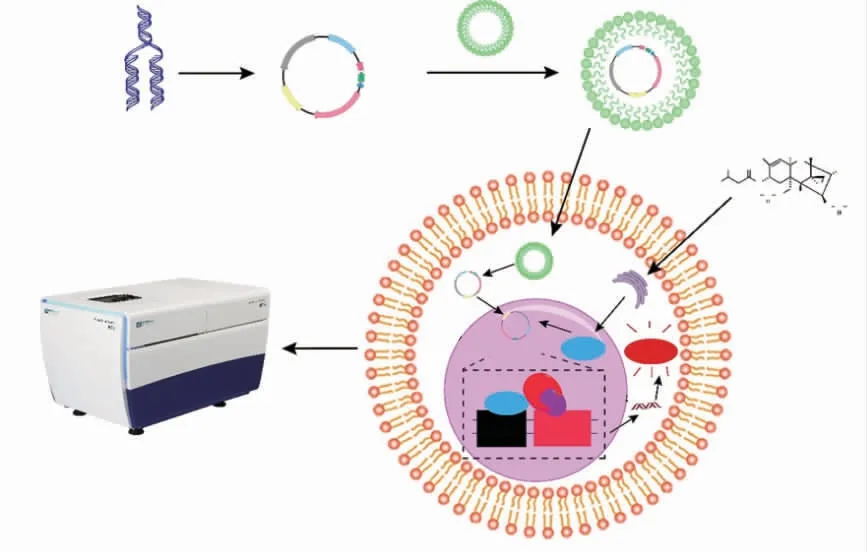
图1 HEK293 细胞荧光传感器工作原理Fig. 1 A schematic illustration of the working principle of a HEK293 cell sensor
2.2 pcDNA3.1-TRE-mCherry 荧光质粒的构建
如图2(a)所示,通过克隆TRE 序列得到串联序列, 以提升信号的响应速度, 将串联序列与mCherry 的启动子连接以获得目标基因序列TREmCherry, 将其插入空载质粒pcDNA3.1 的MCS 多克隆位点中,从而构建pcDNA3.1-TRE-mCherry 质粒。如图2(b)所示,最终获得4 719 bp 的重组质粒,证明了pcDNA3.1-TRE-mCherry 质粒的成功构建。
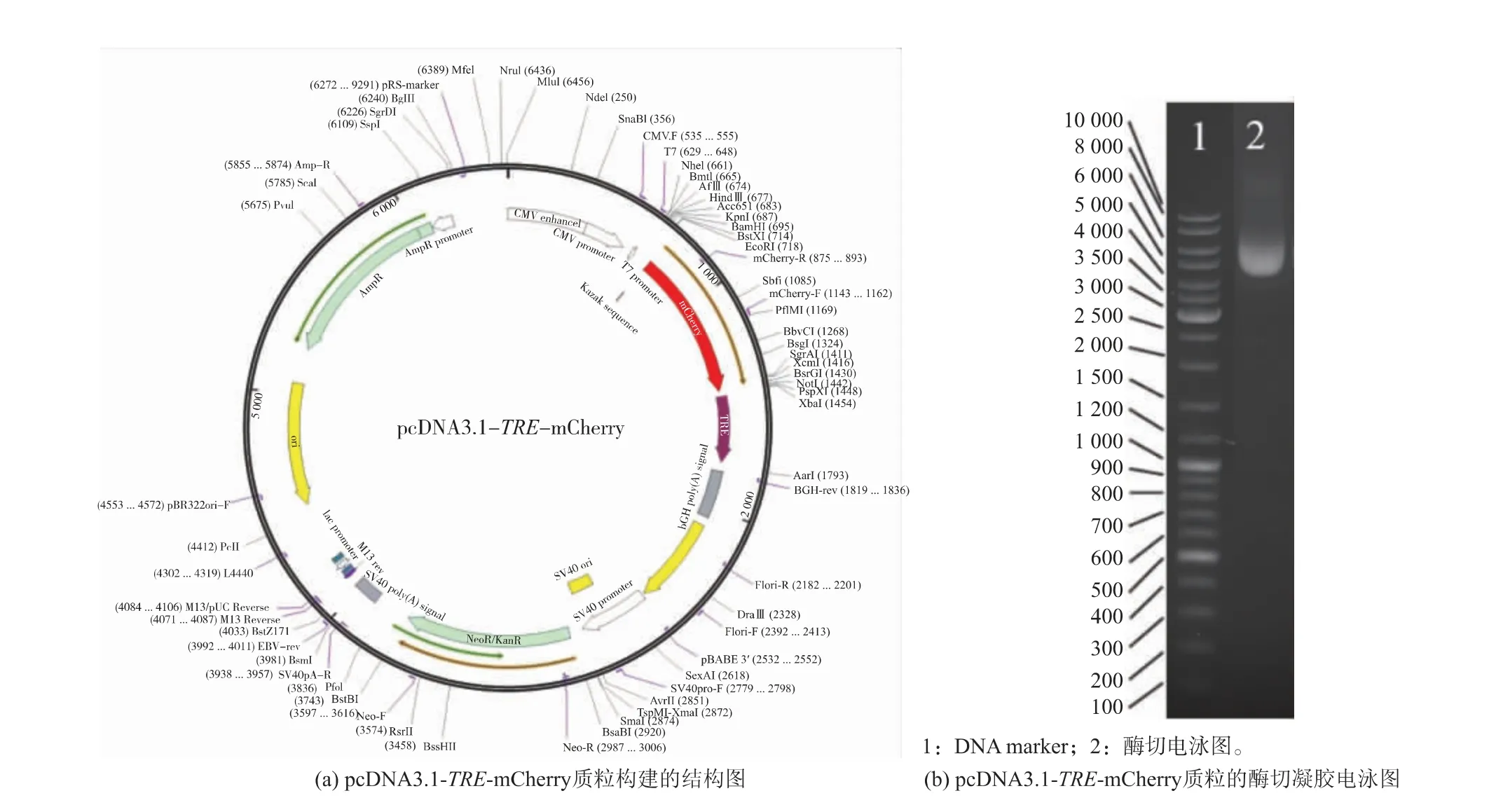
图2 pcDNA3.1-TRE-mCherry 质粒的构建与酶切凝胶电泳图Fig. 2 Construction of pcDNA3.1-TRE-mCherry plasmid and enzyme gel electrophoresis
2.3 荧光质粒转染对细胞活性的影响
2.3.1 荧光质粒转染对细胞生长活性的影响将转染前后的细胞置于光学显微镜中拍照观察细胞形态,如图3(a)所示,对照组与转染组中细胞生长状况正常,细胞形状完整,从形态上可以满足实验要求。
为确保转染后的HEK293 细胞能维持正常的细胞活性, 用CCK-8 法对转染细胞的活性进行检测。 如图3(b)所示,转染pcDNA3.1-TRE-mCherry质粒的转染组细胞相对活性97.87%,与对照组细胞相对活性基本一致。 不同质量浓度T-2 毒素刺激细胞后, 转染前后HEK293 细胞增殖抑制率大致相同,见表1。 说明转染后细胞活性基本保持不变,未对细胞的正常生理生长产生明显影响。
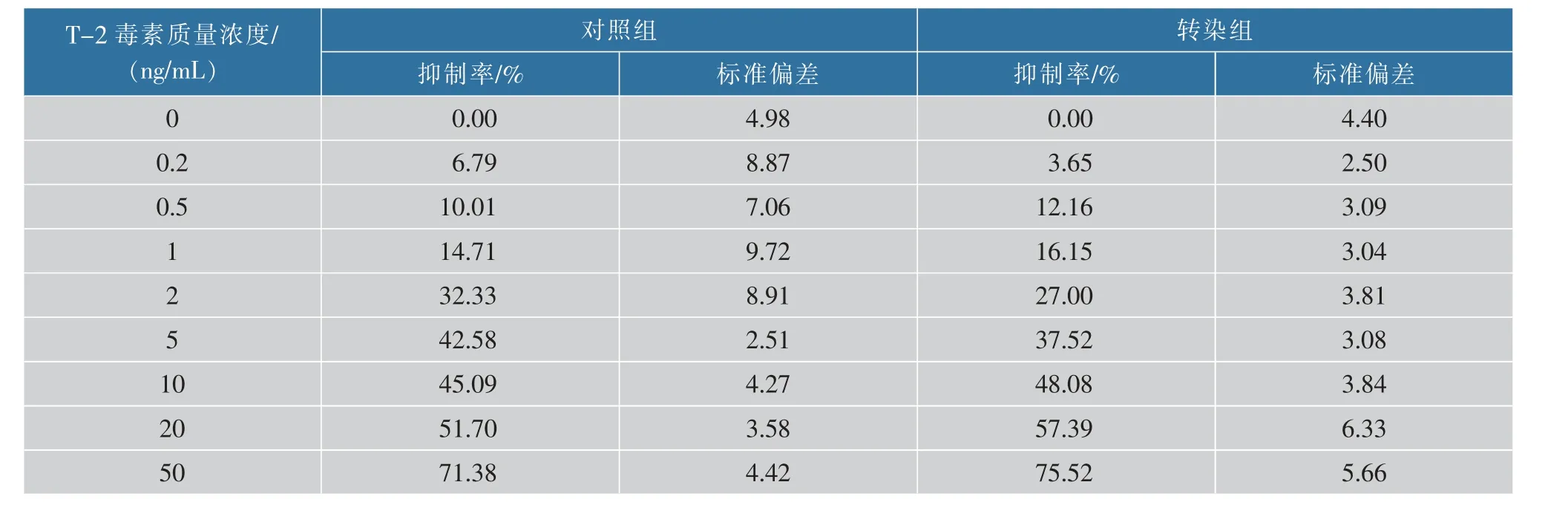
表1 T-2 毒素暴露对转染前后HEK293 细胞增殖抑制率的影响Table 1 Effects of T-2 toxin exposure on proliferation inhibition rate of HEK293 cells before and after transfection
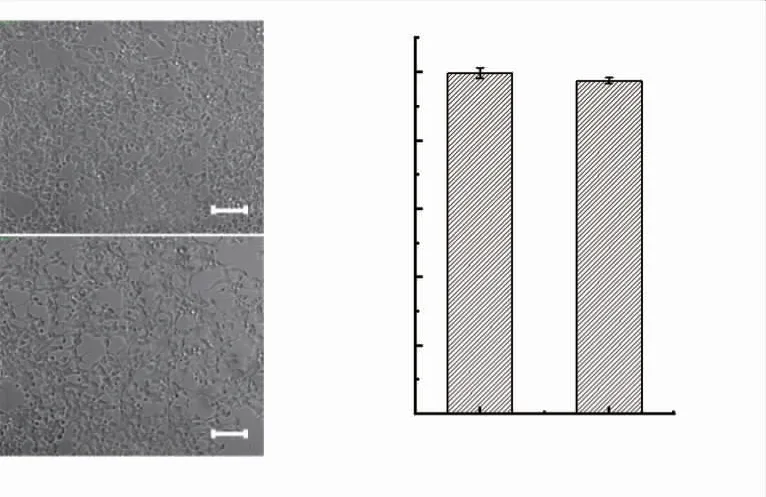
图3 HEK293 细胞质粒转染效果图及其转染后细胞活性Fig. 3 Effect of plasmid transfection on HEK293 cells and its effect on cell activity after transfection
2.3.2 荧光质粒转染对细胞活性氧水平的影响通过荧光相对强度变化可反映活性氧含量变化,HEK293 细胞转染前后荧光相对强度见图4。 与对照组相比, 转染组的荧光相对强度并没有显著变化,此外,转染前与转染后细胞的荧光相对强度均与空白组相差1 倍以内, 由此说明荧光质粒转染HEK293 细胞没有产生大量的活性氧物质, 未造成氧化应激损伤,对细胞正常生理活性未造成影响。
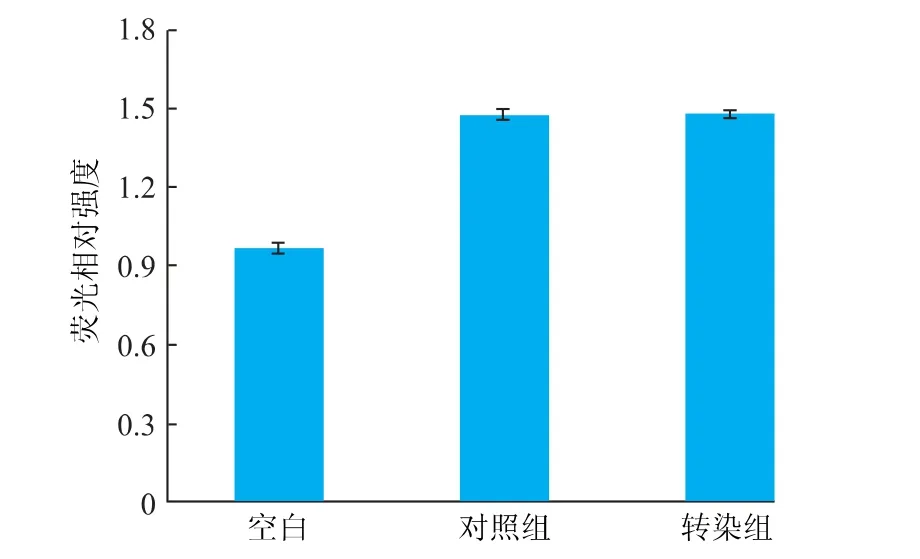
图4 荧光检测转染对细胞活性氧水平的影响Fig. 4 Effect of transfection on reactive oxygen species level detected by fluorescence
2.3.3 荧光质粒转染对细胞凋亡的影响通过细胞凋亡试剂盒测得转染前后细胞凋亡率,并通过流式细胞仪对早期凋亡和晚期凋亡细胞进行检测。 由于HEK293 细胞自身贴壁不牢,极易从细胞皿上脱落,造成细胞自噬,因此,图5 中对照组细胞凋亡率在17%左右, 但转染前后细胞凋亡无明显差异,说明细胞转染对细胞凋亡未产生不良影响。
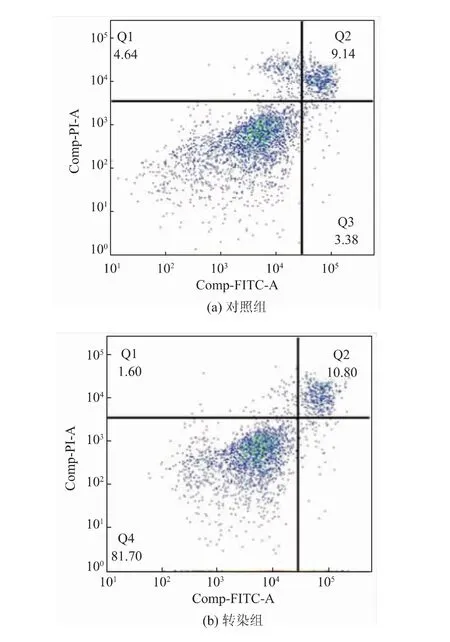
图5 转染对细胞凋亡影响的流式细胞仪检测图Fig. 5 Flow cytometry analysis of the effect of transfection on apoptosis
综合细胞活性、细胞内活性氧水平以及细胞凋亡结果,发现转染pcDNA3.1-TRE-mCherry 质粒后的HEK293 细胞符合后续实验要求。
2.3.4 HEK293 细胞荧光传感器对T-2 毒素毒性筛查T-2 毒素刺激细胞后, 引起TNF 显著上调,并激活MyD88、JNK 和p38 信号因子, 参与细胞应激反应,导致AP-1 活化,在细胞增殖、凋亡、炎症等病理过程中起重要作用。 基于HEK293 细胞荧光传感模型,进行T-2 毒素毒性作用与时间响应关系分析。 用10 ng/mL T-2 毒素刺激HEK293 细胞,在宽场高内涵成像仪中进行12 h 的实时荧光监测。如图6(a)所示,转染后的HEK293 细胞呈现荧光强度变化,说明该荧光传感模型可以对T-2 毒素进行毒性检测。 HEK293 细胞荧光相对强度随时间延长而升高, 在4 h 时开始出现红色荧光,4 h 后荧光逐渐增强,8 h 时荧光接近最大值, 之后荧光值趋于稳定,说明该荧光传感模型对T-2 毒素毒性作用呈现时间响应正相关(见图6(b)),为接下来使用HEK293细胞荧光传感模型进行不同质量浓度T-2 毒素和HT-2 毒素的毒性筛查提供支撑。
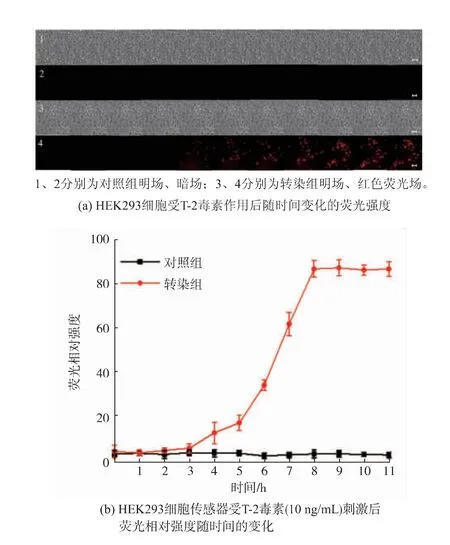
图6 10 ng/mL T-2 毒素刺激HEK293 细胞后荧光强度变化Fig. 6 Fluorescence intensity changes of HEK293 cells stimulated by T-2 toxin of 10 ng/mL
基于HEK293 细胞荧光传感模型,进行T-2 毒素毒性作用与剂量响应关系分析。 配制不同质量浓度的T-2 毒素暴露于转染后的细胞,T-2 毒素质量浓度为0.5、1、2、5、10、15、20、25、30 ng/mL,8 h 后将细胞置于倒置荧光显微镜下,对细胞荧光表达和强度进行检测。 由图7(a)可知,在T-2 毒素质量浓度为0.5 ng/mL 时,细胞内仅有微弱的荧光,随着T-2毒素质量浓度的不断升高,细胞呈现的荧光不断增强;当T-2 毒素质量浓度达到25 ng/mL 时,荧光强度最大,且荧光值增长速度随着质量浓度的增加而变缓慢。 此外,根据T-2 毒素质量浓度-荧光相对强度曲线,计算得出T-2 毒素的EC50为16.27 ng/mL。将T-2 毒素的质量浓度(1~25 ng/mL)与对应的荧光强度进行线性拟合,得到线性方程:y=1.149 38x+64.72,R2=0.969,LOD 为0.691 ng/mL。
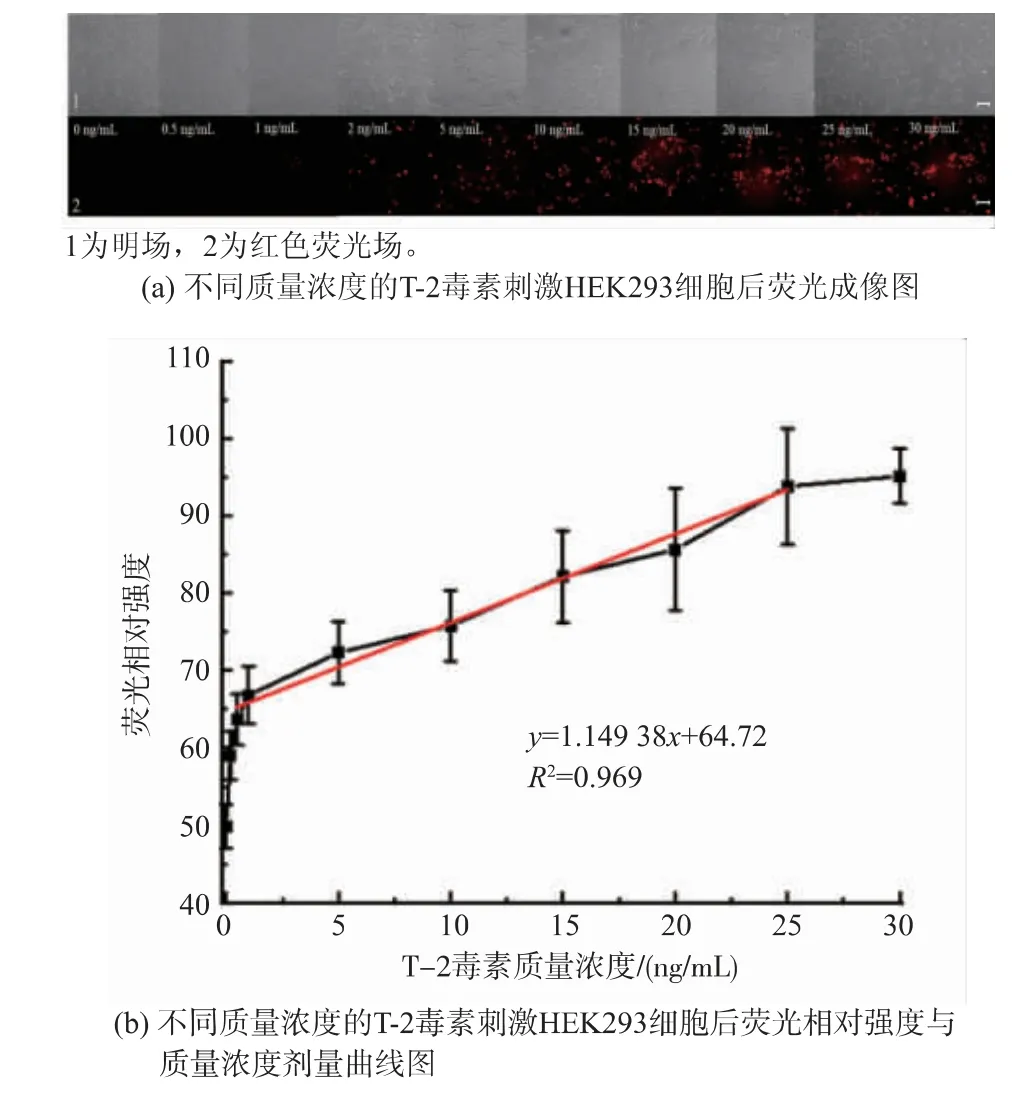
图7 HEK293 荧光细胞传感器对T-2 毒素的毒性筛查Fig. 7 Toxicity screening of T-2 toxin by HEK293 cellbased sensor
2.4 实际样品实验
进行样品添加标准品实验,将0、2、5、10、20 ng/mL的T-2 毒素添加到提取后的面粉样品中,经过无菌处理后用细胞荧光传感器进行毒素毒性筛查,结果见图8。

图8 样品添加T-2 毒素刺激HEK293 细胞后的荧光成像图Fig. 8 Fluorescence imaging of HEK293 cells stimulated by T-2 toxin
基于HEK293 细胞荧光传感器,可通过测得的荧光相对强度对应T-2 毒素质量浓度。 样品平均加标回收率是86.13%~126.20%,见表2。 结果表明该方法具有较高的准确性, 可用于实际样品中的T-2毒素可视化筛查。
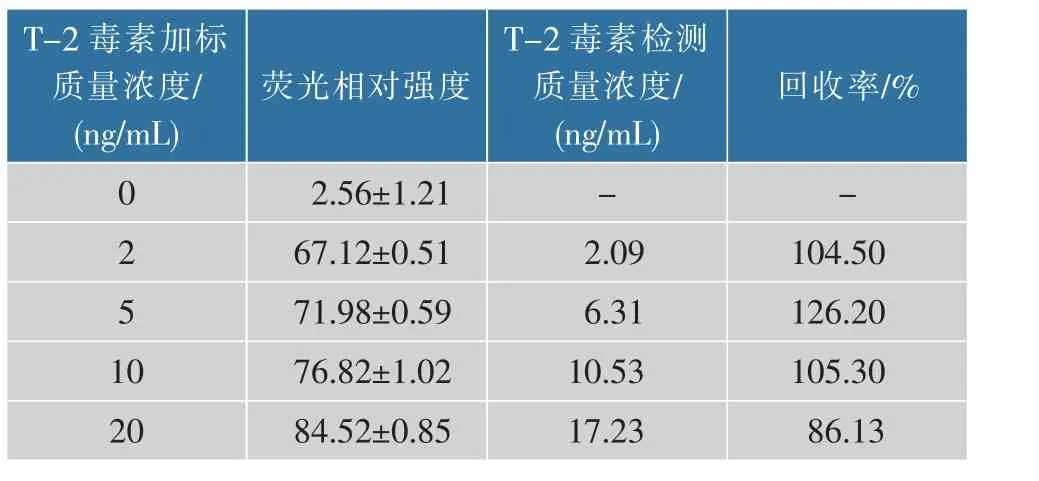
表2 样品加标实验回收率Table 2 Result of recovery rate of spiked sample
2.5 HEK293 细胞荧光传感器对T-2 毒素代谢产物毒性筛查
T-2 毒素代谢产物HT-2 毒素的化学结构和理化特性与T-2 毒素极为相似,仅有C-4 位置处的官能团不同,推测可以使用HEK293 细胞荧光传感模型进行HT-2 毒素的毒性筛查。 分别用0.2、0.5、1、5、10、20、30、40、50 ng/mL 的HT-2 毒素刺激转染后的HEK293 细胞,8 h 后将细胞置于倒置荧光显微镜下,对细胞荧光强度进行监测。 由图9(a)所示,HT-2 毒素刺激后,细胞内mCherry 表达,说明该荧光传感模型可以进行HT-2 毒素的毒性筛查。 随着HT-2 毒素质量浓度增加, 细胞内荧光相对强度不断升高,根据HT-2 毒素质量浓度-荧光相对强度曲线, 计算得出HT-2 毒素的EC50为27.65 ng/mL,说明HT-2 毒素的细胞毒性小于T-2 毒素, 与之前相关报道基本一致[30-31]。
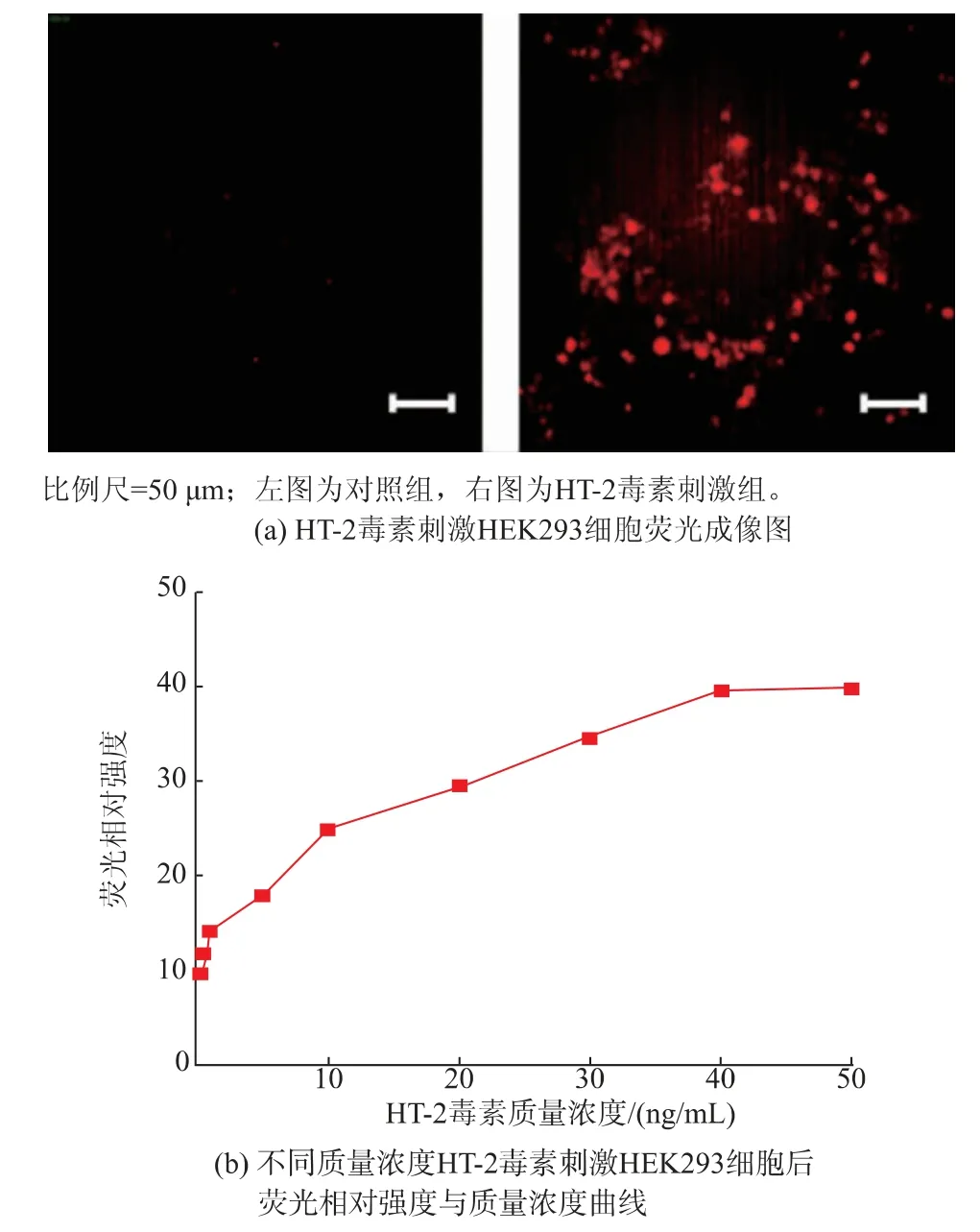
图9 HEK293 细胞荧光传感器对T-2 毒素代谢产物HT-2的毒性筛查Fig. 9 Toxicity screening of T-2 toxin metabolite HT-2by HEK293 cell-based fluorescence sensor
3 结 语
基于T-2 毒素的毒性特定信号通路,选取毒性关键靶点基因AP-1 识别元件TRE 以及mCherry,构建原核表达载体质粒pcDNA3.1-TRE-mCherry,建立细胞荧光传感模型用于筛查T-2 毒素的毒性。T-2 毒素可以诱导HEK293 细胞传感器的红色荧光蛋白表达,根据实时荧光强度结果显示,8 h 时红色荧光蛋白表达稳定, 根据质量浓度-荧光相对强度曲线得出T-2 毒素的EC50为16.27 ng/mL,T-2 毒素质量浓度在1~25 ng/mL 进行线性拟合,线性方程为y=1.149 38x+64.72,R2=0.969,LOD 为0.691 ng/mL。进行实际样品加标实验, 样品平均加标回收率是86.13%~126.20%。 由于T-2 毒素的代谢产物是HT-2 毒素,与T-2 毒素具有相同的毒性官能团,因此,也对HT-2 毒素进行了毒性筛查。 HT-2 毒素的EC50为27.65 ng/mL,与已有研究结论一致。 以上结果表明,该荧光细胞传感器可实现对T-2 毒素及其代谢产物毒性的准确筛查,为食品中其他真菌毒素及其代谢产物安全、可靠的毒性筛查提供了新的手段和思路。
——一道江苏高考题的奥秘解读和拓展

