高温热处理对鲭鱼异尖线虫基因和蛋白质的影响
杜文琪, 谭 毅, 董冬丽, 吴希阳, 唐书泽*
(1. 暨南大学理工学院,广东广州 510632;2. 中华人民共和国宁波海关,浙江宁波 315012)
近年来,中国沿海地区鲭鱼罐头出口南美国家遭遇多次退货,理由是鲭鱼罐头中检出异尖线虫幼虫残留,并作出了“鱼罐头因存在寄生虫对消费者健康产生风险”的判定。 随后,秘鲁国家竞争防卫和知识产权保护中心在24 个城市内开展了332 次抽查行动,超过230 万个关联鱼罐头下架,导致我国相关企业产生巨大经济损失[1]。
在目前公认的9 种异尖线虫中[2],简单异尖线虫 (Anisakis simplex sensu stricto)、 派氏异尖线虫(Anisakis pegreffii) 和抹香鲸异尖线虫(Anisakis physeteris)是被欧洲食品安全局(EFSA)认可的与临床过敏反应相关的渔业产品关联寄生虫[3]。 大多为消费者食用含第三阶段幼虫的生鱼后发生感染,并伴随过敏反应。 血清学检测结果显示,活体异尖线虫在病人体内分泌代谢产物会致使人产生过敏反应,少数过敏反应由异尖线虫虫体过敏蛋白引发[4-7]。
迄今为止,冷冻和加热是灭活异尖线虫幼虫最有效的方法。文献指出,将产品中心部分加热至60 ℃以上超过1 min,可确保杀灭异尖线虫幼虫[8-9]。 然而,异尖线虫致敏患者血清测试的免疫印迹研究证明,热处理后异尖线虫的一些致敏蛋白并没有完全失活[10-11]。 一些学者研究发现,接触非活性异尖线虫物质会导致过敏患者出现过敏症状,这表明异尖线虫幼虫过敏原对通常烹饪过程中的热处理有抵抗力,经过罐头加工处理的异尖线虫的幼虫也可能是过敏原来源之一,这似乎与寄生虫过敏原存在耐热性和抗胃蛋白酶的性质有关[12];有学者在罐头产品中分离出的异尖线虫幼虫中证实了两种具有热稳定性的过敏原,Ani s 1 和Ani s 4[13]。 日本也有病例显示,经过轻度热加工后,异尖线虫幼虫残留的过敏蛋白仍有致病能力[14-15]。
海鱼经现代加工技术(罐头加工工艺)处理后,其产品(如鱼肉罐头)中一般很难用肉眼观察到异尖线虫虫体的存在, 无法确定其中是否有虫体残留。 因此,快速检测加工食品中异尖线虫幼虫残留对于鱼类产品致敏风险排查尤为重要。 海鱼罐头等食品经高温灭菌处理后,残存的异尖线虫幼虫虫体过敏蛋白能否被破坏并降低致敏风险已成为进出口部门关注的热点。
作者以最容易被异尖线虫寄生的鲭鱼为对象,选取常用的两种热加工方法(高温灭菌和油炸),研究PCR 和q-PCR 能否快速检出鲭鱼罐头食品中异尖线虫幼虫残留以及高温热加工技术能否有效破坏异尖线虫幼虫体蛋白质并降低过敏风险,为海鱼食品风险隐患排查和安全出口提供科学依据和技术支撑。
1 材料与方法
1.1 材料与试剂
异尖线虫、鲭鱼:宁波佳必可食品有限公司提供;兔多克隆抗体:江苏省寄生虫病防治研究所提供;羊抗兔IgG-HRP:广州创伟生物科技有限公司产品;DNA 提取试剂盒(TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver5.0):宝日医生物技术有限公司产品;Taq PCR Master Mix 预混液:广州瑞真生物技术有限公司产品;改良型BCA 蛋白浓度测定试剂盒:生工生物工程(上海)有限公司产品;SDS-PAGE 凝胶配置试剂盒:上海碧云天生物技术有限公司产品。
1.2 仪器与设备
ABI StepOne Plus 实时荧光定量PCR 仪: 美国应用生物系统公司产品;Tanon 2500 凝胶图像分析系统、Tanon 5200 蛋白免疫印迹自动曝光仪: 广州誉维生物科技仪器有限公司产品;AG 22331 Hamburg 梯度PCR 仪: 德国Eppendorf 公司产品;JY-SPCT 型水平电泳槽:北京君意东方电泳设备有限公司产品;Infinite M200 PRO 光栅型多功能微孔板检测仪:瑞士帝肯(上海)贸易有限公司产品;HF-24 高速组织研磨仪: 上海贺帆仪器有限公司产品;Legend Micro 17R 冷冻高速离心机: 赛默飞世尔科技(中国)有限公司产品;JY92-IIN 超声波细胞粉碎机: 宁波新芝生物科技股份有限公司产品;XY-280压力蒸汽灭菌锅: 合肥华泰医疗设备有限公司产品;Chirascan plus 圆二色谱仪: 英国应用光物理公司产品。
1.3 方法
1.3.1 形态学分类将收集到的异尖线虫三期幼虫按照文献[16]的方法进行形态学初步分类。
1.3.2 样品总DNA 提取与纯度分析取单条虫体用蒸馏水反复冲洗, 取尾部三分之一后研碎提取DNA。DNA 提取按DNA 抽提试剂盒说明书操作,采用紫外分光光度法对基因组DNA 含量(以OD260表征)和DNA 纯度(以OD260/OD280表征)进行检测。
1.3.3 内转录间隔区(ITS)序列PCR 扩增以异尖线虫总DNA 为模板,用异尖线虫ITS 序列的通用引物SS1 (5′-GTTTCCGTAGGTGAACCTGCG-3′)和NC2(5′-TTAGTTTCTTTTCCTCCGCT-3′)进行扩增,目的片段大小约1 000 bp。扩增总体系50 μL,其中含25 μL 2×PCR Buffer Mix ( 含有Taq DNA Polymerase、2×Taq PCR Buffer、3 mmol/L MgCl2和400 μmol/L dNTP mix)、1 μL 引物SS1(10 μmol/L)、1 μL 引物NC2(10 μmol/L)、2 μL DNA 模板,加灭菌双蒸水至50 μL,混匀,低速离心后置于梯度PCR仪中。 扩增条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸70 s,30 个循环;72 ℃延伸7 min,置4 ℃保存。将扩增产物用质量分数1%的琼脂糖凝胶进行电泳鉴定。
1.3.4 PCR-RFLP 分型根据测序结果, 利用Primer Premier 5.0 软件选择2 个限制性内切酶HinfⅠ和TaqⅠ, 对通用引物扩增的PCR 产物进行酶切。酶切按以下条件进行:反应体系20 μL,其中含10 μL PCR 产物、3 μL 10×Buffer (含牛血清白蛋白)、2 μL TaqⅠ或HinfⅠ,加灭菌双蒸水至20 μL。TaqⅠ于65 ℃水浴1 h,HinfⅠ于37 ℃水浴4 h。 反应结束后取7 μL 酶切产物用质量分数2%的琼脂糖凝胶进行电泳鉴定。
1.3.5 引物设计及特异性检测根据GenBank 中公布的异尖线虫核糖体DNA 内转录间隔区ITS2(基因座AY826724), 用Primer Premier 5.0 软件设计一对特异性引物, 将设计好的引物序列在NCBI网站进行序列特异性比对, 并对引物之间的二聚体、发夹结构、错配等情况进行分析。 引物序列为DUF:5′-GAATTACGGTGAACTGTCTTC-3′,DUR:5′-GTATAGTAGATTCGGTGTTGAC-3′,扩增产物大小为156 bp, 作为热处理后检测异尖线虫DNA 的引物之一。 以上引物由生工生物工程(上海)股份有限公司合成。
1.3.6 异尖线虫虫体高温热处理1) 高温灭菌处理 将同类型异尖线虫虫体夹在两块鱼片中间模拟异尖线虫在鱼内的环境,将其放入罐头内模拟鱼罐头产品高温灭菌环境,在121 ℃的高温灭菌锅内处理20、30、40、60、80、100、120、140、160、180 min。
2) 油炸处理 将同类型异尖线虫虫体夹在两块鱼片中间模拟异尖线虫在鱼内的环境,待油温升高至180 ℃将其放入油中分别炸90 s、3 min、5 min。
1.3.7 热处理后异尖线虫DNA 提取参照方法1.3.2。
1.3.8 热处理后异尖线虫蛋白质提取在提取异尖线虫粗蛋白常规方法[17]基础上略微更改:取0.5 g异尖线虫放入3 mL PBS 中均质, 冰浴超声5 min(功率90 W),之后在4 ℃下以10 000 g 离心40 min后收集上清液。 为避免蛋白质降解,向粗提取物中添加蛋白酶抑制剂混合物,并放入-80 ℃冰箱中冻存。
1.3.9 目标基因扩增普通PCR 扩增体系及条件如1.3.3 方法所示。采用实时荧光定量PCR 技术,将不同条件处理后的异尖线虫DNA 作模板, 反应体系:引物(10 μmol/L)各0.4 μL、ROX Reference DyeⅡ(荧光定量PCR 参比染料) 0.4 μL、TB Green Ex Taq Ⅱ(核苷酸胶体染料) 10 μL、模板2.0 μL,加灭菌双蒸水补至20 μL。 反应条件:循环前95 ℃高温30 s,95 ℃变性5 s,58 ℃退火30 s,72 ℃延伸30 s,40 个循环。
1.3.10 圆二色谱仪测定蛋白质二级结构将0.2 mg/mL 异尖线虫蛋白质溶液在圆二色谱仪上进行测定。测试条件:样品池厚0.1 cm,扫描范围195~260 nm, 扫描速度200 nm/min, 带宽2 nm, 并用CNDD 软件计算各构象单元含量。
1.3.11 SDS-PAGE 分析采用不连续凝胶垂直板电泳法对异尖线虫蛋白质组分进行分析。浓缩胶为5%,分离胶为10%(均为体积分数)。样品(1.8 mg/mL)和上样缓冲液混合后于100 ℃金属浴中加热10 min,快速离心后直接上样, 浓缩胶电泳电压采用80 V,蛋白质转至分离胶后采用120 V, 待溴酚蓝指示剂接近底部时停止电泳,用考马斯亮蓝R-250 染色2 h,用蒸馏水反复冲洗后,再用脱色液过夜脱色。
1.3.12 蛋白免疫印迹鉴定按照上述方法电泳结束后,小心剥离分离胶,用转印缓冲液浸泡后放置在转印装置上,300 mA 条件下2 h 电转移至PVDF膜上。 已转印的PVDF 膜用质量分数5%的脱脂奶粉封闭,室温摇床过夜,加入一抗(兔多克隆抗体,稀释倍数2 500)4 ℃孵育12 h, 取出膜后在摇床用TBST 洗膜3 次,每次10 min,然后加入用TBST 稀释的二抗(羊抗兔IgE-HRP,稀释倍数2 000)室温孵育2 h,采用同样方法洗膜,最后采用BeyoECL 显色液避光显色,鉴定纯化的过敏蛋白活性。
2 结果与分析
2.1 异尖线虫鉴定与检测
以提取的DNA 为模板, 用异尖线虫通用引物扩增后,出现特异性条带,目的条带大小约为1 000 bp,电泳结果见图1(a)。
限制性内切酶HinfⅠ将派氏异尖线虫目的基因(1 000 bp) 酶切成约240、290 和340 bp 3 个片段,将简单异尖线虫目的基因酶切成约230、620 bp 2 个片段[18](见图1(b)和图1(c));限制性内切酶TaqⅠ将简单异尖线虫和派氏异尖线虫目的基因均酶切成400、430 bp 2 个片段(见图1(d))。 综上分析,所收集的异尖线虫均为简单异尖线虫和派氏异尖线虫。
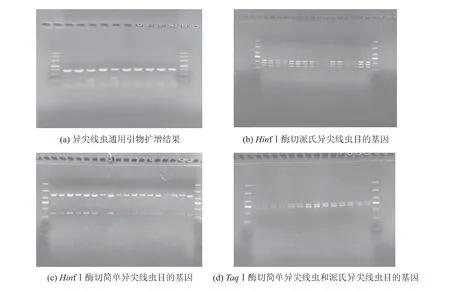
图1 异尖线虫通用引物扩增及分型结果Fig. 1 PCR products amplified by universal primers and genotyping of Anisakis larvae
2.2 热处理后异尖线虫基因检测
用自主设计的引物DUR/DUF 以及常规检测异尖线虫的引物SS1/NC2 对热处理后异尖线虫基因进行检测(见图2、图3)。 图2(a)的泳道S1 为涡虫DNA 阴性对照,扩增不出条带。 高温灭菌对异尖线虫DNA 的降解效果见图2。 琼脂糖凝胶电泳显示,由于DNA 降解具有随机性, 处理20 min 后,1 000 bp 的目的条带大部分被降解,仍有小部分呈现肉眼可见的微弱条带;40 min 后所有重复样本均已完全扩增不出目的条带;156 bp 的目的条带在处理20、40 min 后均能被扩增出来,且条带亮度和未处理组相比没有显著变化。 随着热处理时间不断增加,特异性条带亮度逐渐变弱, 处理180 min 后仍有肉眼可见的微弱条带。 实时荧光定量PCR 结果显示(见图4(a)),随着高温灭菌处理时间不断增加,Ct 值逐渐变大, 处理60 min 后SS1/NC2 引物扩增片段的Ct 值在28 上下浮动,处理120 min 后DUF/DUR 引物扩增片段的Ct 值在22 上下浮动, 继续增加处理时间不会继续变化,Ct 值有效范围为15~35, 因此在高温灭菌处理中,利用上述两对引物均能检测出异尖线虫DNA。
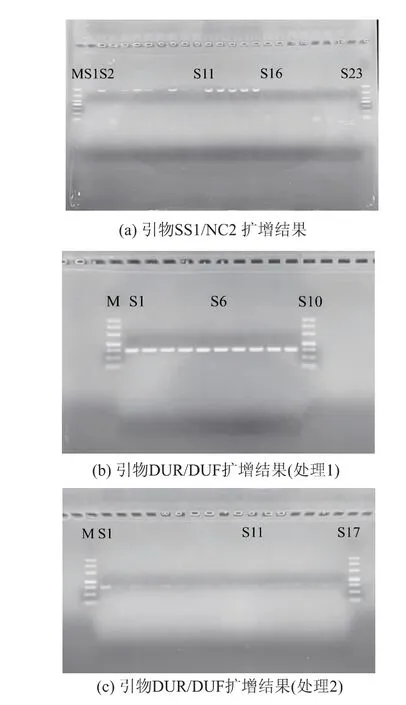
图2 高温灭菌处理对异尖线虫基因的降解作用Fig. 2 Degradation of Anisakis gene treated by high temperature sterilization
琼脂糖凝胶电泳显示在油炸处理90 s 时,所有样本中1 000 bp 的目的条带都无法被扩增出,156 bp 的目的条带亮度没有显著变化(见图3);油炸5 min 后156 bp 的目的条带基本被降解,特异性条带亮度极弱。 实时荧光定量PCR 结果显示 (见图4(b)),随着油炸时间不断增加,Ct 值逐渐变大,油炸5 min 后SS1/NC2 引物扩增片段的Ct 值在33 上下浮动, 油炸3 min 后DUF/DUR 引物扩增片段的Ct值在24 上下浮动, 继续增加处理时间不会使Ct 值发生显著变化,所有目的片段均可被检测出来。
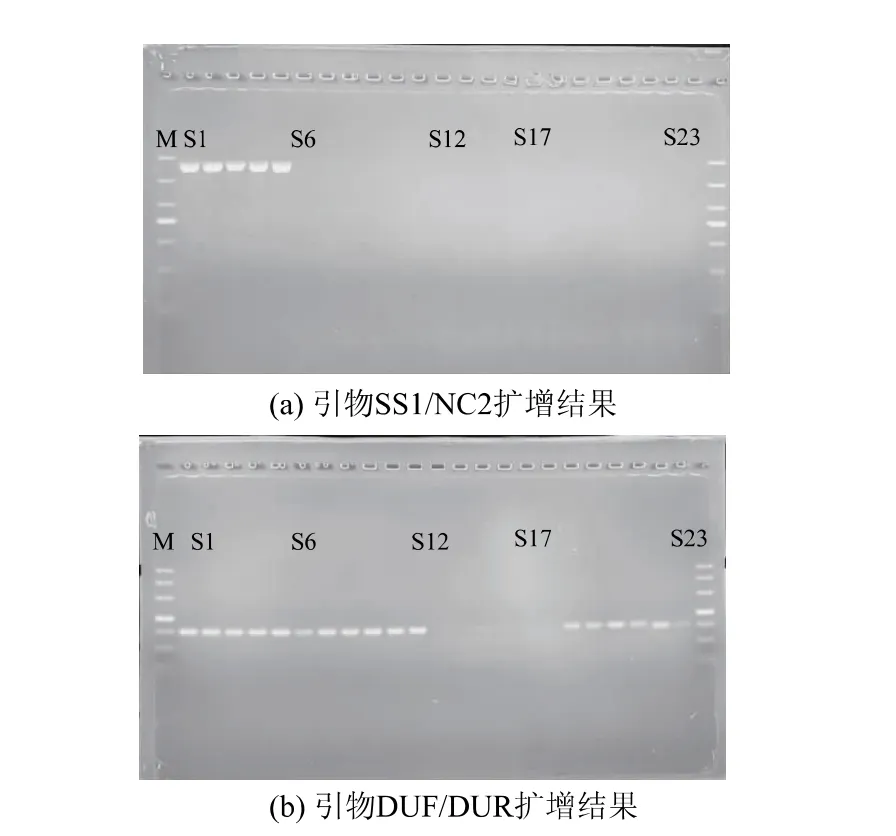
图3 油炸处理对异尖线虫基因的降解作用Fig. 3 Degradation of Anisakis gene treated by deep frying
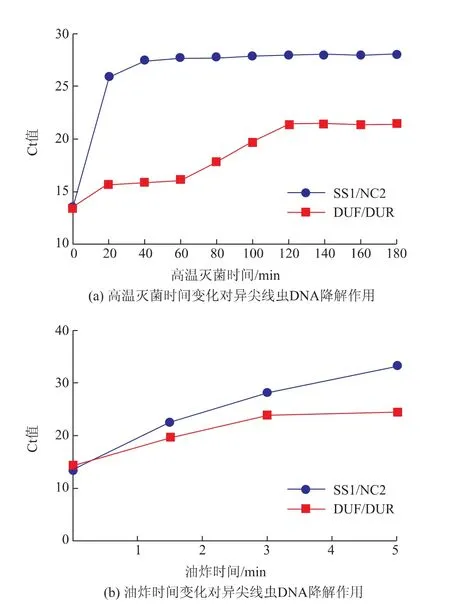
图4 热处理对异尖线虫基因的降解作用Fig. 4 Degradation of Anisakis gene by thermal treatment
综上可知,对于检验热加工食品中异尖线虫幼虫是否残留, 实时荧光定量PCR 比普通PCR 更为灵敏,且宜用小分子DNA 片段的引物。
2.3 圆二色谱分析
时α-螺旋含量最低,为23.15%; β-折叠和β-转角的含量均存在先降后升的变化趋势,处理60 min 时的β-折叠和β-转角含量最高, 分别为33.05%和16.65%。油炸条件下(185 ℃),α-螺旋的含量与未处理组相比显著降低,但两个处理组间的变化相差不大,β-折叠和β-转角的含量均显著增加。 两种热处理方式相比,油炸对蛋白质的破坏效果更强。
数据表明, 热处理主要使α-螺旋变性形成β-折叠或无规则卷曲,也可能在β-折叠和无规则卷曲之间建立相互转换。 蛋白质分子相邻肽键间的氢键被破坏,维持α-螺旋的氢键断裂,发生解螺旋,α-螺旋结构的含量减少; 一部分α-螺旋结构展开,蛋白质结构由有序趋向于无序,无规则卷曲结构的含量增加; 另一部分α-螺旋结构在分子间相互作用下转换为β-折叠结构,β-折叠结构存在于蛋白质内部折叠区域, 通常造成β-折叠结构含量的增加,从而改变了蛋白质的二级结构,使蛋白质结构变得疏松不紧密[19],这与前人的研究结果[20]一致。 蛋白质二级结构中无规则卷曲含量的增加,可能与等电点和由蛋白质降解引起的疏水性变化有关[21]。
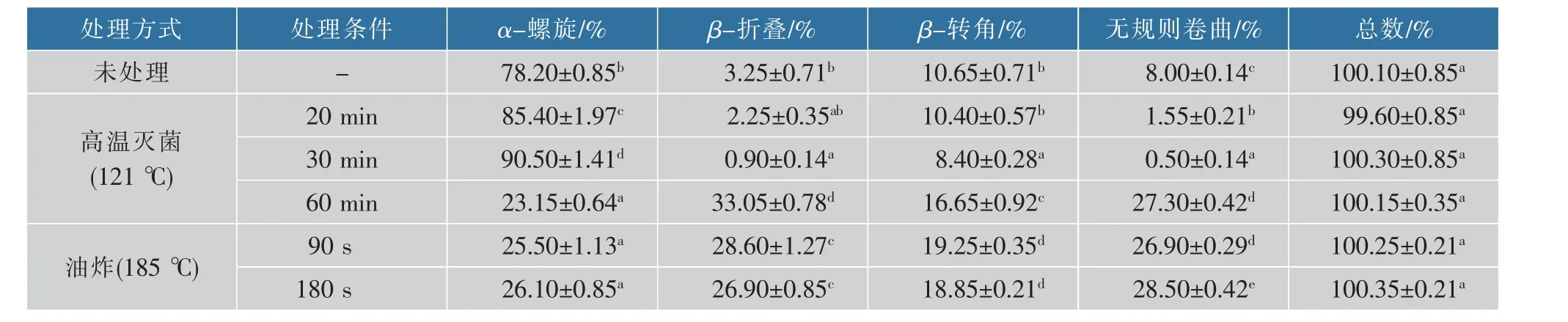
表1 不同加热条件下异尖线虫全虫蛋白质二级结构含量Table 1 Secondary structure contents of Anisakis by different thermal treatment
2.4 SDS-PAGE 结果
异尖线虫体蛋白质变化结果见图5。泳道S1 为阳性对照,未处理的异尖线虫粗提液中可辨条带有14 条,分布在相对分子质量10 000~235 000 之间,其中主条带有6 条, 主要分布在相对分子质量30 000~53 000 之间。
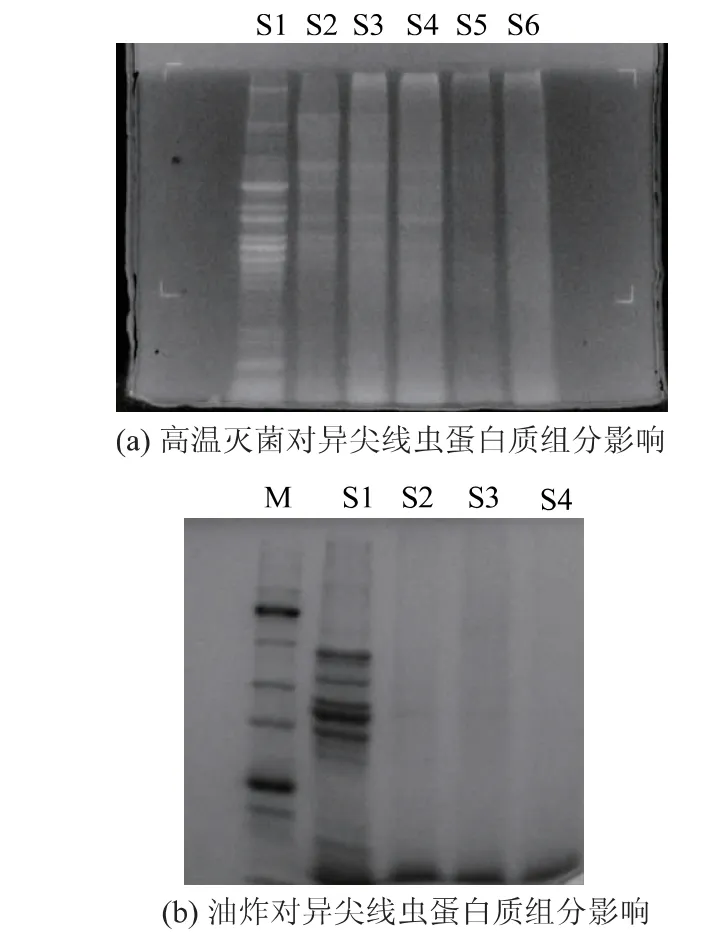
图5 热处理对异尖线虫蛋白质组分影响的SDS-PAGE 图谱Fig. 5 Effects of thermal treatment on Anisakis protein composition observed by SDS-PAGE
在高温灭菌条件下(121 ℃)处理20 min 的全蛋白质条带亮度减弱十分显著, 随着处理时间增加,全蛋白质条带亮度减弱越来越明显,热处理40 min 后只剩下相对分子质量41 000 附近蛋白质有微弱可见条带, 热处理60 min 后无肉眼可见条带。油炸条件下(185 ℃),异尖线虫全蛋白质条带灰度减弱更为明显, 油炸90 s 后大量全蛋白质条带消失,相对分子质量41 000 附近有微弱可见蛋白质条带,油炸3 min 后无肉眼可见条带,异尖线虫的全蛋白质条带基本完全消失。 可见油炸的加工方式能够对异尖线虫蛋白质产生破坏影响。 结合对异尖线虫全蛋白质二级结构变化的检测,说明热处理条件下虫体蛋白质变性, 蛋白质构象和性质发生改变,可溶性蛋白质含量随着热处理时间增加而降低,不再溶解于用来提取蛋白质的PBS 溶液;热处理可能会导致蛋白质的肽链发生断裂,长链蛋白质断裂成短链和小肽,在电泳过程中,小肽长度超出了凝胶的检测范围,因而蛋白质条带减少。 结果表明,热处理温度与处理时间与异尖线虫蛋白质破坏效果呈正相关,处理温度越高,处理时间越长,蛋白质破坏越明显,油炸对异尖线虫的破坏速度最快、效果最彻底。 这与常见食物蛋白质(如虾、蟹等)在热处理条件下的变化趋势一致[22-24]。
2.5 高温灭菌对异尖线虫过敏蛋白影响的蛋白免疫印迹鉴定
图6(a)为异尖线虫虫体全蛋白质的免疫印迹结果。 经过蛋白免疫印迹鉴定后,异尖线虫虫体粗蛋白质中有一条过敏条带 (相对分子质量约为41 000),可与兔多克隆抗体呈阳性反应。 高温灭菌处理显著降低了异尖线虫蛋白质与IgG 的结合能力(P<0.05),随着热处理时间增加,异尖线虫蛋白质与兔多克隆抗体的结合能力逐渐变弱,处理60 min后存在微弱阳性条带。 灰度分析结果表明,处理60 min 后灰度值为未处理的1.8%。 这可能是由于加热后改变了异尖线虫蛋白质分子内、分子间的共价键或非共价键的相互作用, 从而改变了蛋白质的二、三级结构, 使抗原性构象表位受到破坏或者遮蔽,降低了异尖线虫蛋白质的致敏性;也可能是热处理影响了异尖线虫蛋白质溶解度,使过敏蛋白变为非水溶性蛋白质,从而降低了其致敏性。

图6 高温灭菌对异尖线虫蛋白质的降解作用Fig. 6 Degradation of Anisakis protein treated by high temperature sterilization
3 结 语
在我国海洋鱼类感染的寄生线虫中,异尖线虫为主要病原之一。 在我国黄海、渤海海域及辽宁、舟山、 青岛等主要地区均发现了异尖线虫感染现象,且海域中鱼类的感染率相当高[25-29],开展异尖线虫相关研究具有必要性。 但目前国内外学者对常见海鱼加工处理后异尖线虫幼虫残留检测及虫体蛋白质过敏原的降解研究很少。
热加工对异尖线虫的基因和蛋白质均有显著破坏效果,与加热温度和时间呈正相关。 在DNA 检测方面, 实时荧光定量PCR 比普通PCR 更灵敏,DNA 在所有热加工条件下均能被检测出来, 因此,实时荧光定量PCR 检测体系可有效应用于海产鱼类食品异尖线虫安全隐患排查及风险防控。 在蛋白质方面,油炸比高温灭菌处理对异尖线虫蛋白质破坏更为显著。 异尖线虫蛋白质破坏效果受处理温度和时间的影响,较高温度下短时间处理即可破坏全虫体蛋白质。 虽然某些异尖线虫过敏蛋白具有一定的热稳定性,但高温长时间处理能够有效破坏此类蛋白质。 在海鱼罐头生产工艺中,一般高温灭菌处理时间为80~100 min,足以完全破坏异尖线虫的过敏蛋白,致敏风险很低。 在家常鱼肉烹调过程中,为了避免异尖线虫过敏蛋白的致敏风险,要注意控制鱼肉的烹调温度及时间, 建议海鱼以熟食为主,不生食(半生食)产品。

