新建体外受精实验室的鼠胚实验质控和氧气浓度对胚胎体外发育的影响
余柯达 毛佳婷 柴娟 包云 高辉 师帅
不孕不育症已成为一种常见疾病,在我国已婚夫妇中的比列约为10%,其发病率呈逐年上升趋势[1]。辅助生殖技术是治疗不育不孕症主要的技术手段,体外受精(in vitro fertilization,IVF)实验室是辅助生殖技术中最重要的组成部分,是人类配子和胚胎体外培养的场所。人类配子和胚胎在体外对环境非常敏感,因此对新建IVF实验室整个培养系统进行质控评估,是进行辅助生殖技术治疗前的必要程序[2]。目前鼠胚实验(mouse embryo assay,MEA)已应用于 IVF领域的试剂、耗材和仪器设备的质量控制,以及新建或新启动IVF实验室的质量控制[3]。金华市人民医院IVF实验室于2020年初建成,经过前期洁净消毒和“热处理”[4]后,自2021年4至5月采用MEA检测实验室的培养环境和培养体系是否符合辅助生殖技术人类胚胎体外培养的要求,并探讨不同培养环境(O2浓度)对小鼠早期胚胎体外发育的影响,为开展人类胚胎体外培养提供可靠的实验依据及质量保障,现将结果报道如下。
1 材料和方法
1.1 实验动物 无特定病原体级4~8周龄雌性ICR小鼠100只、8周龄以上雄性ICR小鼠20只,均购自金华市实验动物中心,在恒温(25℃)环境下饲养,12 h光照12 h黑暗环境,正常昼夜节律自由饮食,喂养1周后用于实验。动物实验内容及操作均获金华市食品药品检验检测研究院实验动物伦理委员会批准(批准编号:AL-JSYJ202199)。
1.2 试剂与设备 孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)和人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)均购自宁波第二激素厂;取卵-胚胎处理液G-MOPS PLUS、洗精受精液G-IVF PLUS、卵裂胚培养液G-1 PLUS、囊胚培养液G-2 PLUS、石蜡油均购自瑞典Vitrolife公司;二氧化碳培养箱(二气,日本SANYO公司);二氧化碳培养箱(三气,日本 ASTEC公司);解剖显微镜(日本NIKON公司);倒置显微镜(日本 OLYMPUS公司);HARIOMED IVF工作站(中国华粤行仪器有限公司)等。
1.3 小鼠超排卵 用0.9%氯化钠溶液将PMSG和hCG分别配制成100 U/ml的溶液,分装保存于-80℃。于17∶00雌鼠腹腔内注射PMSG 10 U/只,48 h后再腹腔内注射hCG 10 U/只。根据受精方式将雌鼠分为体内受精组和IVF组。
1.4 体内受精组 注射hCG后将50只雌鼠和雄鼠按1∶1合笼,次日8∶00观察雌鼠阴道栓形成情况,分3批进行。将形成阴道栓的雌鼠颈椎脱臼处死,无菌条件下取出卵巢和输卵管,在G-MOPS PLUS中洗涤3遍,在解剖显微镜下用1 ml注射器刺破输卵管膨大部位使合子团(颗粒细胞包裹的原核胚)自动溢出,吸取合子团置于透明质酸酶中去除颗粒细胞,观察原核胚的形成情况后进行微滴培养。
1.5 IVF组
1.5.1 卵母细胞的采集 注射hCG后次日8∶00颈椎脱臼处死50只未合笼的雌鼠,无菌条件下取出卵巢和输卵管,在G-MOPS PLUS中洗涤3遍,在解剖显微镜下用1 ml注射器刺破输卵管膨大部位使卵子团(颗粒细胞包裹的卵子)自动溢出,吸取卵子团置于G-IVF PLUS中。
1.5.2 精子的采集与处理 将上述20只雄鼠颈椎脱臼处死,无菌条件下取出附睾及部分输精管在GMOPS PLUS中洗涤3遍,放入G-IVF PLUS液滴中,在解剖显微镜下用1 ml注射器刺破附睾,使精子游出,将含有精子的G-IVF PLUS液滴加入装有G-IVF PLUS的试管底部,上游法处理30~60 min,活动力好的精子均游到G-IVF PLUS的上层液体中。
1.5.3 IVF与培养 收集获能后G-IVF PLUS上层液体中的精子,观察其活力,并用精子计数板计算浓度,取适量含精子的G-IVF PLUS加入含有卵子团的GIVF PLUS中,使精子终浓度约为1×106/ml,受精4~6 h后观察原核。
1.6 不同O2浓度下培养 将体内受精组所获得的原核胚分别放入二气(37℃,6% CO2,大气O2浓度)和三气(37 ℃,6% CO2,5% O2)CO2培养箱中进行培养。IVF组则是将加入精子悬液后的卵子团分别放入二气和三气CO2培养箱中进行培养,观察原核后将原核胚再次放回对应CO2培养箱中培养。
1.7 原核及早期胚胎的观察与培养 倒置显微镜下观察原核及早期胚胎培养情况。当天(D0):原核观察,转移至G-1 PLUS微滴中培养;D1:2细胞期胚胎观察;D2:4细胞期胚胎观察;D3:8细胞期或桑椹期胚胎观察,并转移至G-2 PLUS微滴中培养;D4:囊胚观察;D5:孵化期囊胚观察。
1.8 受精率、卵裂率和囊胚形成率计算 受精率=受精卵数/获卵数×100%,卵裂率=2细胞胚胎数/受精卵数×100%,囊胚形成率=囊胚数/2细胞胚胎数×100%。
1.9 统计学处理 采用SPSS 16.0统计软件。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 小鼠胚胎的体外培养观察情况 卵子团为颗粒细胞包裹的卵子(图1a,见插页);D0可见受精卵内双原核及双极体(图1b,见插页);D1可见受精卵分裂为2个大小均匀的卵裂球,为2细胞期胚胎(图1c,见插页);D2可见4个大小均匀的卵裂球,为4细胞期胚胎(图1d,见插页);D3可见8个大小均匀的卵裂球,为8细胞期胚胎(图1e,见插页),或为卵裂球互相融合的桑椹期胚胎(图1f,见插页);D4可见胚胎进入早期囊胚或扩张期囊胚阶段(图1g,见插页);D5可见囊胚的一部分或全部从透明带中逸出,为孵化期囊胚(图1h,见插页)。
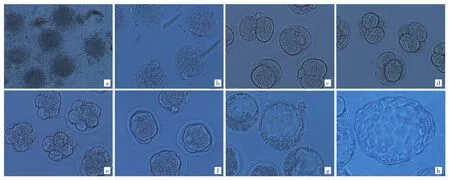
图1 小鼠的卵子团和胚胎发育情况(a:卵子团;b:受精卵;c:2细胞期胚胎;d:4细胞期胚胎;e:8细胞期胚胎;f:桑椹期胚胎;g:早期囊胚及扩张期囊胚;h:孵化期囊胚;×200)
2.2 体内受精组和IVF组胚胎发育情况比较 体内受精组和IVF组各处理了50只雌鼠。体内受精组共获卵1 387个,受精率、卵裂率和囊胚形成率分别为86.37%、94.74%和91.72%;IVF组共获卵1 345个,受精率、卵裂率和囊胚形成率分别为80.67%、94.75%和91.05%。体内受精组的受精率明显高于IVF组(P<0.05),但两组卵裂率和囊胚形成率比较差异均无统计学意义(均P>0.05),见表 1。
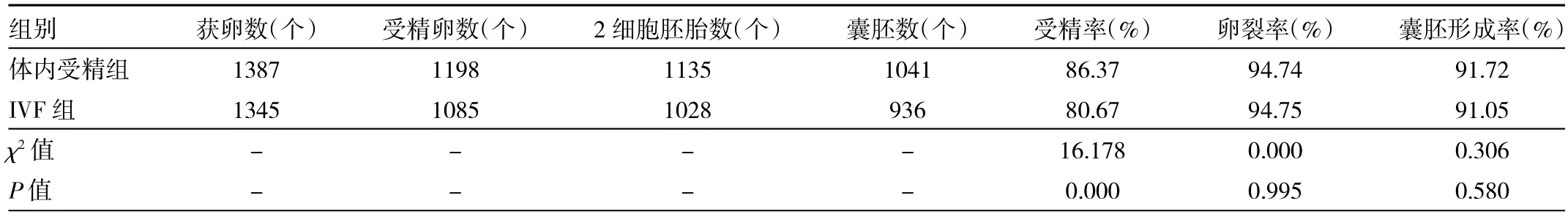
表1 小鼠体内受精组和IVF组胚胎发育情况比较
2.3 不同O2浓度对小鼠胚胎发育的影响 体内受精组中,二气培养环境下,受精率、卵裂率和囊胚形成率分别为87.04%、93.09%和88.19%;三气培养环境下,受精率、卵裂率和囊胚形成率分别为85.79%、96.21%和94.75%。二气培养与三气培养受精率比较差异无统计学意义(P>0.05),但二气培养卵裂率和囊胚形成率均低于三气培养(均P<0.05)。IVF组中,二气和三气培养环境下的鼠胚发育情况与体内受精组类似,二气培养与三气培养受精率比较差异无统计学意义(P>0.05),但二气培养卵裂率和囊胚形成率均低于三气培养(均 P<0.01),见表 2。
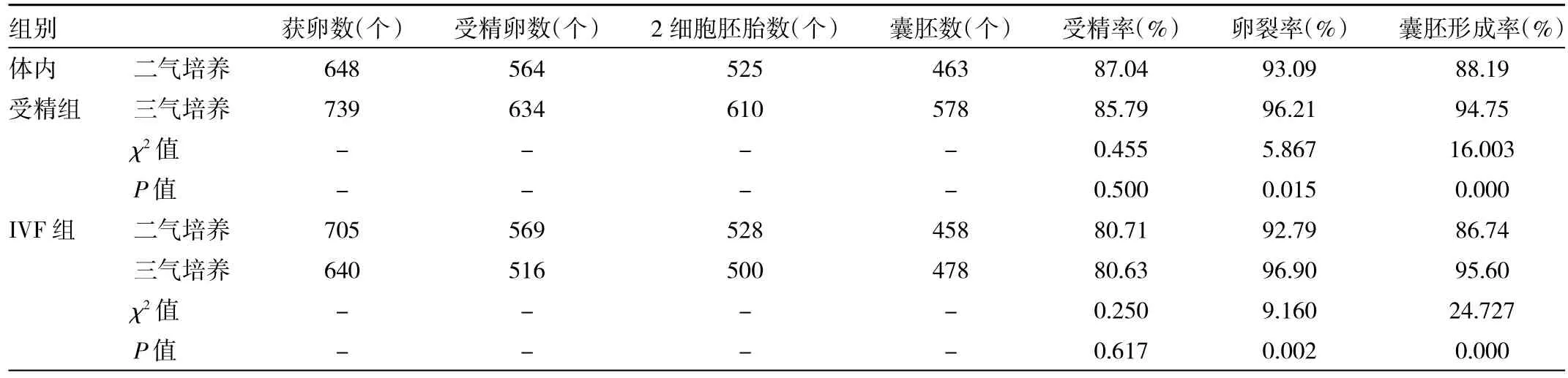
表2 不同O2浓度对小鼠胚胎发育的影响
3 讨论
健康的单胎活产是IVF的目标,这一目标的实现在一定程度上取决于良好的培养环境,即IVF实验室,其能够支持实现具有植入潜能的健康胚胎的发育[5]。良好的IVF实验室培养环境评估需要进行质量控制,MEA是新建或新启动IVF实验室最广泛应用的质量控制方法[2,6-8],其可以有效检测空气质量、温湿度、耗材、培养试剂、培养箱和实验人员的技术水平等[9]。
本研究利用ICR小鼠进行体内受精和IVF实验,结果表明体内受精组的受精率为86.37%,高于IVF组的80.67%,原因可能是体内受精的受精过程是在无光、恒温、恒湿、低氧的小鼠输卵管内进行的,而IVF则受到体外环境(温湿度、渗透压、pH等)的影响[10];体内受精组和IVF组的囊胚形成率达91.72%和91.05%,均大于辅助生殖技术实验室质量控制标准的80%,且超过近几年国内文献报道的囊胚形成率[2,6-7]。表明本院生殖医学中心新建的IVF实验室的培养环境、培养体系和实验室人员的技术水平已达到标准,能够开展人类辅助生殖技术。
早期胚胎在体外培养过程中,O2浓度会影响其发育的速度和质量,其是调节胚胎发育的重要生理因素。目前国内外IVF实验室进行早期胚胎体外培养时培养箱中的O2浓度5%和20%均存在[11]。本研究发现,在小鼠的体内受精组和IVF组中,二气培养(大气O2浓度,约20%)和三气培养(5% O2)的受精率比较差异无统计学意义,但二气培养的卵裂率和囊胚形成率均低于三气培养,表明三气培养更有利于小鼠早期胚胎的发育。这一结果与高亚可等[12]和Ciray等[13]的研究结果一致。
最早进行IVF治疗时,早期胚胎体外培养是在大气O2浓度(约20%)下进行的,数百万健康婴儿的出生证明了这种方法的有效性[14]。然而,目前许多研究表明在大气O2浓度下,胚胎在体外培养过程中活性氧(reactive oxygen species,ROS)的增加会导致氧化应激,会使哺乳动物的胚胎在体外培养过程中发育受损[15-17]。在胚胎发育早期阶段DNA复制活跃,ROS会导致细胞中DNA断裂及不可逆的双链断裂,从而导致胚胎不均匀分裂、延迟分裂和发育停滞等情况发生[18]。哺乳动物母体输卵管环境中生理O2浓度约为5%,大部分研究表明低氧环境可有效促进哺乳动物胚胎的发育和提高囊胚的质量[12,19]。而本研究中O2浓度对受精率无影响的可能原因是受精过程中大气O2浓度下并未产生过量的ROS,或者是配子与胚胎的自我修复机制抵消了这部分影响[20]。
综上所述,MEA的体内受精和IVF均可有效评估新建或新启动IVF实验室的培养环境和培养体系的可靠性,本研究MEA的囊胚形成率达到了IVF实验室的质控标准。目前辅助生殖技术实验室质控标准统计的是体内受精的1细胞期或2细胞期胚胎形成囊胚的比例,但其无法评价配子和受精卵对培养环境和培养体系的敏感性,且不能对实验室人员的IVF技术水平进行全面评价,因此本研究建议进行培养环境和培养体系质控时,除了关注囊胚形成率,还应结合IVF的受精情况。目前新建实验室IVF的受精率均在80%以上[2,6-7,12],因此建议 MEA IVF 的受精率应达 80%。对于IVF实验室进行早期胚胎体外培养的气体环境的选择,本研究建议选用三气培养(5% O2),其可有效减少ROS对早期胚胎的氧化应激作用,并可提高其发育潜能。

